不同花色紫斑牡丹的CDDP体系优化及其遗传多样性分析
2018-12-05李婉茹
陈 燕,李婉茹,唐 红
(甘肃农业大学 林学院,兰州 730000)
牡丹原产于中国,素有国色天香的美誉,古有“自李唐来,世人甚爱牡丹”之说。目前中国的栽培牡丹划分为中原、西北、江南和西南四大品种群,其中西北牡丹即紫斑牡丹是仅次于中原牡丹品种群的第二大品种群[1]。紫斑牡丹因花基部有一块明显的紫斑而得名。在长期的自然选择及人工栽培下,紫斑牡丹的遗传变异类型更加丰富。但是,紫斑牡丹种源复杂,不同地区各自命名,因此同名异物、同物异名的情况很普遍,这就给紫斑牡丹的品种鉴定和育种工作带来了诸多困难。开发简单快捷、信息量丰富、鉴别能力强的分子标记技术对植物品种鉴定及选育是必要的[2]。自20世纪末以来,牡丹种质资源DNA水平上的研究一直被国内外学者关注,但多侧重于探讨牡丹组野生种间亲缘关系、遗传多样性及起源和分类[3],关于紫斑牡丹品种水平上的遗传多样性及品种鉴定研究相对较少[4-6]。裴颜龙等[7]最早用RAPD技术研究了矮牡丹和紫斑牡丹基因组DNA,发现,RAPD技术不仅可以检测野生牡丹居群内与居群间的遗传变异,还具有研究种间进化和亲缘关系的潜力;陈向明等[8]利用RAPD-PCR技术研究了不同花色牡丹品种的亲缘关系;朱红霞[9]利用AFLP分子标记技术初步建立了牡丹、芍药部分品种的DNA指纹图谱;王燕青[10]和王娟[11]等分别利用SRAP-PCR标记研究了33个中原牡丹品种间的遗传多样性和20个牡丹品种基因组DNA多态性。然而,这些传统意义上的随机DNA分子标记得到的位点通常与目标性状基因距离较远,品种间鉴别效率不高。随着DNA分子标记技术的不断发展,新型标记方法如CDDP、EST-EER、SNP等也逐渐运用在植物分子水平的研究[12-14]。
CDDP (conserved DNA-derived polymorphism)分子标记技术是由Collard和Mackill于2009年在水稻研究中开发出来的基于DNA保守序列的新型分子标记方法。它是一种目的基因标记方法,能产生与目标性状连锁的功能性分子标记[15-16]。对水稻、菊花、大豆、玫瑰的研究表明,CDDP分子标记方法具有操作简单、成本低廉、多态性丰富等优点[16-18]。该方法是对RAPD、AFLP、ISSR等传统标记方法的有效补充,更是对形态学、细胞学鉴定方法的辅助,能从分子角度为植物品种间的遗传多样性分析及鉴定提供科学帮助。本研究利用CDDP分子标记对47个不同花色紫斑牡丹品种的基因组DNA进行遗传多样性分析,为紫斑牡丹品种鉴定提供技术支持。
1 材料与方法
1.1 试验材料
试验于2018年4月至6月在甘肃农业大学林学院林木遗传分子实验室完成。供试材料为47个紫斑牡丹栽培品种(表1)。根据成仿云等[1]提出的花色、花型分类标准,随机选择具有代表性的品种作为试验材料。所有材料均采于甘肃省兰州市榆中县和平油用牡丹良种种苗繁育基地。于2018年4月采集紫斑牡丹茎秆顶端的嫩叶,每个品种采集嫩叶约1 g,将采集到的嫩叶表面灰尘等杂物擦去,用锡箔纸包裹好,置于液氮中存放,带回实验室之后立即取出并存放在-80 ℃冰箱中,用于后续的DNA提取。
1.2 研究方法
1.2.1基因组DNA的提取与检测采用天根公司的植物DNA提取试剂盒提取紫斑牡丹嫩叶的基因组DNA,采用超微量分光光度计检测DNA浓度与质量,并将部分DNA原液稀释成浓度为15 ng/μL的母液,保存在-4 ℃冰箱备用,DNA原液存放在-20 ℃冰箱中。
1.2.2CDDP-PCR扩增体系优化1)反应体系优化 试验所用的21条引物均由上海生工生物有限公司合成,引物编号及序列信息见表2。所有引物稀释成10 pmol/μL的母液,用20 μL离心管分装后保存在-20 ℃冰箱备用。
CDDP-PCR反应总体系为20 μL,其中2×Es Taq MasterMix(含染料)10 μL,采用正交试验设计对引物浓度、DNA模板浓度进行2因素4水平优化,选出适合紫斑牡丹的反应体系。以“天女散花”为DNA模板,MYB1(Pr1)为引物,共16个处理(表3)。
反应程序为94 ℃预变性3 min;94 ℃变性1 min,退火1 min,72 ℃延伸2 min,35个循环;72 ℃后延伸5min,最后4 ℃短期保存。
2)退火温度筛选 根据候小改等提出的PCR复性温度一般低于引物Tm值15 ℃到5 ℃,由PCR仪自动生成8个温度梯度。以引物18为例,其Tm值为62.7 ℃,则在42.7~57.7 ℃的温度范围内,PCR仪自动生成的温度分别为47.7、48.1、49.4、51.2、53.6、55.6、56.9和57.7 ℃。用此法分别对21条引物进行最适退火温度的筛选。
1.2.3电泳及检测取6 μL扩增产物在溶有4 s gelred核酸染料2%琼脂糖凝胶上电泳分离,电压5 V/cm,电泳2 h,最后在凝胶成像系统上观察并采集图像。

表1 供试紫斑牡丹品种信息
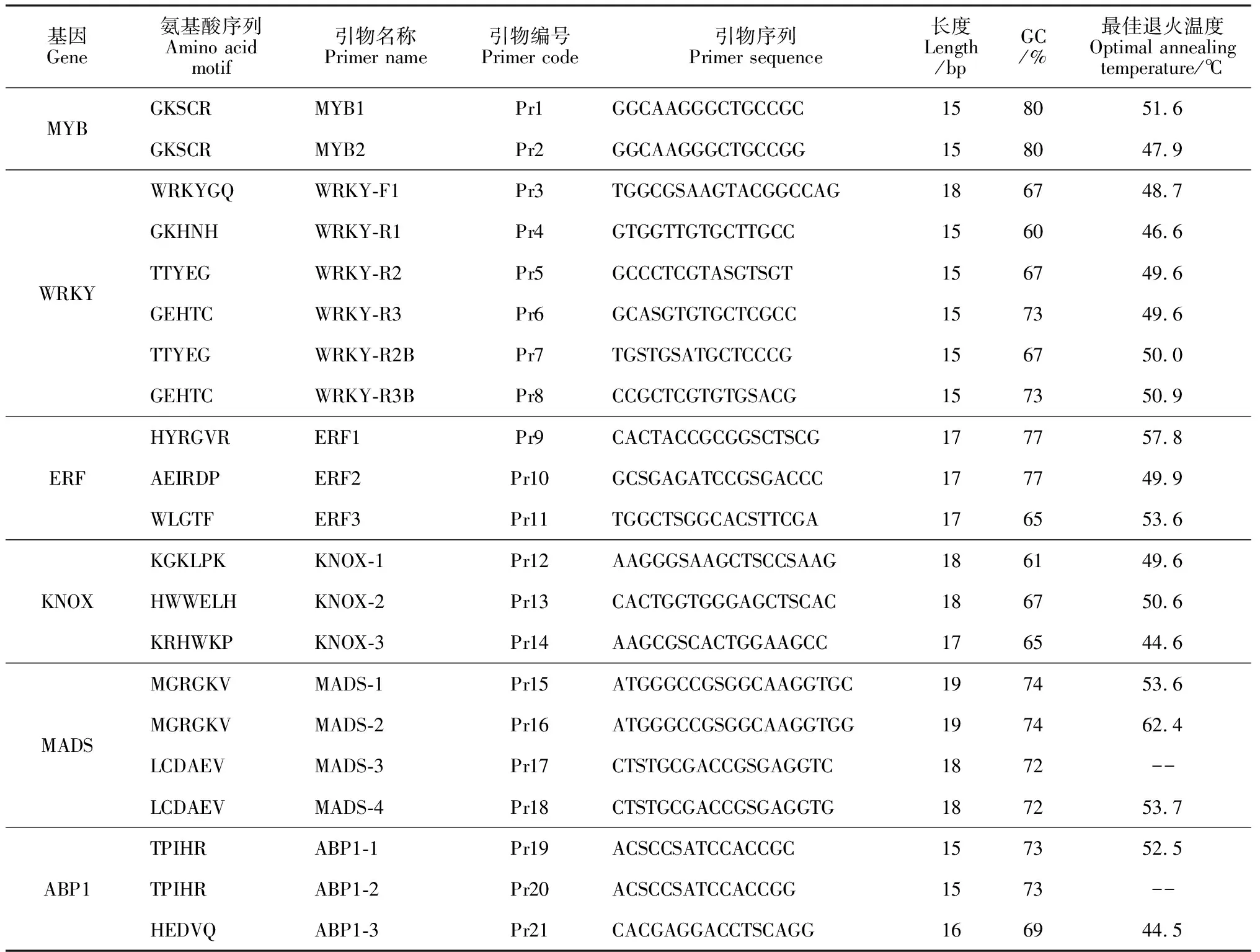
表2 用于紫斑牡丹品种遗传关系分析的CDDP引物

表3 PCR正交试验设计表
1.2.4数据统计将每条CDDP引物扩增出来的每条带视为一个位点,采用Gel-Pro analyzer条带统计软件结合人工识别的方法统计位点总数及多态性位点数,条带清晰的记为1,缺失记为0。引物的位点多态信息量(polymorhism information content, PIC)按公式PIC=1-∑(Pi)2,其中Pi为第i种等位位点占总等位位点的比率。
2 结果与分析
2.1 紫斑牡丹CDDP反应体系优化
根据表3正交试验设计扩增结果(图1)可以看出,扩增出的条带清晰明亮,条带数量多且整齐。当DNA含量固定为15、30、45和60 ng时,随着引物量的增加,扩增条带数目也在增加,但当引物含量超过15 pmol时,条带数又开始减少,因此引物浓度不宜过高,最佳值为15 pmol。当引物含量一定时,随着DNA浓度的增加,扩增的条带数也增加,且亮度提高。最后确定15号为最佳体系,即20 μL体系中,DNA模板量为60 ng,引物含量为15 pmol。最后确立紫斑牡丹CDDP反应最佳体系为:PCR总反应体系20 μL,其中包括2×EsTaqMasterMix酶(含染料)10 μL,1.0 pmol/μL引物1.5 μL,15 ng/μL DNA模板4 μL,ddH2O 4.5 μL。
2.2 引物的筛选
采用上述稳定的紫斑牡丹CDDP反应体系,以紫斑牡丹品种“醉妃”基因组为DNA模板,对21条引物进行多态性筛选。试验结果显示,除引物Pr17和Pr20没有扩增出任何条带,其余19条引物均能扩增出清晰可辨的条带,每条引物扩增出的条带数2~6条不等(图2)。因此,除引物Pr17和引物Pr20外,其余19条引物均可用于紫斑牡丹品种的多态性分析。
2.3 引物退火温度的筛选
引物的退火是影响PCR扩增结果的关键因素。退火温度过低,扩增出的产量较高,但是很容易引起模板DNA与引物的错配从而导致杂带较多;退火温度过高,DNA模板和引物结合差,条带数目少,亮度低。理想状态下,引物处于最佳退火温度,才既可以保证引物同目的序列有效退火又可以减少非特异性的结合。本实验以“醉妃”为DNA模板对所有引物的最适退火温度进行筛选,扩增产物在2%琼脂糖上电泳分离。以Pr18引物为例,其在47.4、48.1、49.4、51.2、53.6、55.6、56.9和57.7 ℃时都能扩增出清晰明亮的条带,但在温度为53.6 ℃时,扩增出的条带无弥散拖尾现象,条带最为清晰整齐(图3)。确定该引物的最佳退火温度为53.6 ℃。各引物最佳退火温度见表2。
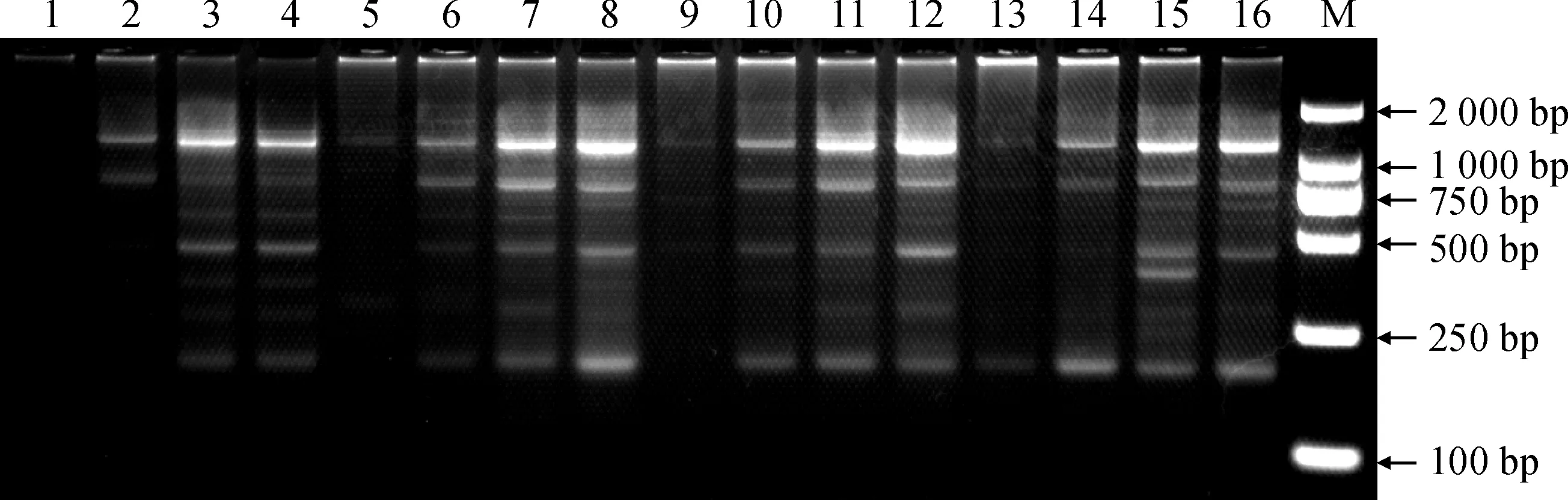
1~16对应表3中的处理号; M.DL2000图1 正交试验下的扩增结果1-16 was correspond to those treatments listed in Table 3; M. DL2000 plusFig.1 The results of orthogonal design
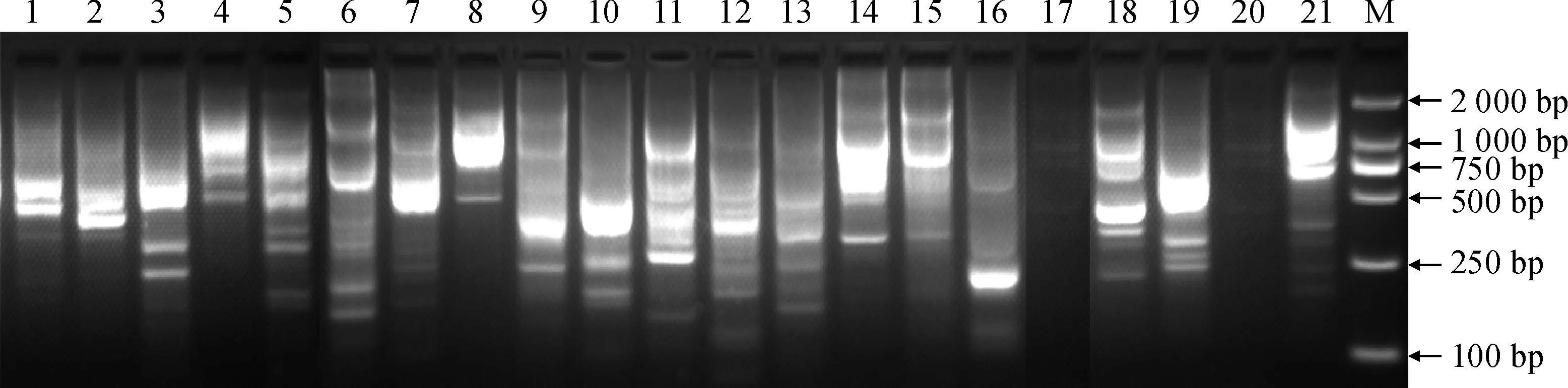
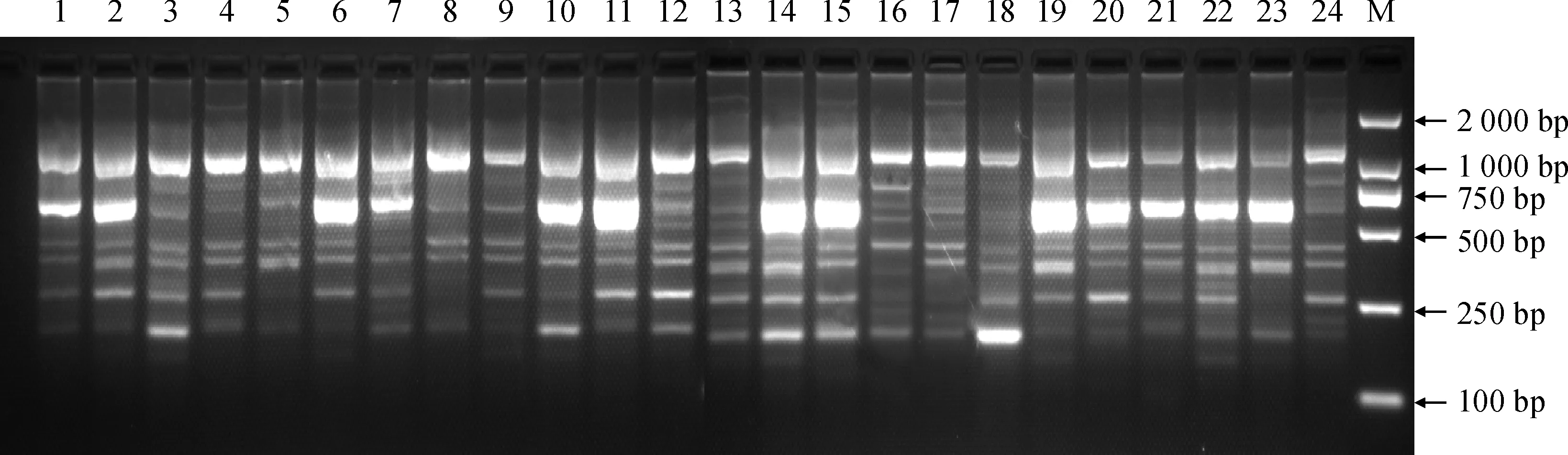
1~21引物1~21;M. DL2000图2 21条引物对紫斑牡丹品种‘醉妃’的扩增结果1-21 primer 1-21; M. DL2000Fig.2 The amplification of 21 CDDP primers to P. rockii cultivar ‘Zuifei’

图3 引物MADS-4(Pr18)退火温度筛选Fig.3 The annealing temperature screening of primer MADS-4(Pr18)
2.4 CDDP分子标记鉴定紫斑牡丹品种的遗传多态性分析
从表4可看出,筛选出来的19条适用于紫斑牡丹引物一共扩增出112条带,其中多态性条带97条,多态性比率为 86.61%。PIC是衡量基因变异程度高低的多态信息含量的指标:当PIC> 0.5时,则表示该位点呈高度多态性;当0.25 由UPGMA聚类分析(图4)可知,47份紫斑牡丹的遗传相似系数变化范围是0.72~0.95,平均遗传相似系数为0.835,显示供试样品遗传多样性高。当遗传相似系数为0.72时,所有供试材料聚为两类,第Ⅰ类由45个供试样品组成,第Ⅱ类由2个黄色品种:“海黄”和“华夏金龙”组成。从观赏性状上看,相同花色的品种大体上聚为一类,但也并非完全聚在一起。 表4 CDDP引物扩增结果 材料编号同表1图4 47份紫斑牡丹材料的UPGMA聚类分析图Material number is shown in Table 1Fig.4 Dendrogram obtained from 47 P. rockii genotypes based on UPGMA analysis generated by SM 1~24对应表1中材料编号;M.DL2000图5 5号引物的样品扩增图1-24 was correspond to sample numbers listed in Table 1; M.DL2000Fig.5 The amplification of Pr5 primer to individual of P. rockii 任意2个品种在同一引物下产生的带型不同则表明该引物可以区分这2个品种。本研究中CDDP引物ERF3(Pr11)可区分的样本数最多(13个),引物ERF2(Pr10)可区分的样本数最少为0。由表4知,CDDP引物对紫斑牡丹的鉴别力在0~13之间,其中鉴别力超过10 的有3条引物,分别是WRKY-R2(Pr5)、ERF3(Pr11)和MADS-4(Pr18)。 根据表4条带分析结果,19条引物共产生了30条特异性条带,除引物Pr1、Pr2、Pr10、Pr11、Pr15及Pr18没有产生特异性条带,其余13条引物均产生了1~5条特异性条带。特异性条带即只有某一品种具有或者某一品种缺失的条带,它能够便捷地将该品种与其他品种区分开来,为紫斑牡丹品种间的鉴别提供了研究方向。部分扩增结果见图5。 遗传多样性可能是对进化的适应,它是物种适应不断变化的环境的一个重要反应[19]。通常情况下,一个物种的遗传多样性越丰富,其对环境的适应能力也就越强。普遍认为稀有的或者分布区狭窄的物种遗传多样性水平偏低[20]。然而,近年来一些研究发现,一些特有的和濒危的物种仍然保持着较高的遗传变异[5]。本研究采用的CDDP分子标记方法,得出供试的47份紫斑牡丹的多态性比例达86.61%,这一结果高于杨美玲等[5]用ISSR标记方法在16份紫斑牡丹研究出的71.6%和裴颜龙等[7]利用RAPD标记方法在紫斑牡丹中得出的27.6%。在特异性条带比例上,CDDP分子标记的方法产生的特异性比例为26.79%,远高于苏雪等[6]用RAPD技术在16个紫斑牡丹品种中的3.33%。与以上分子标记方法相比,CDDP法具有操作更简便、应用成本低等优点,因此CDDP分子标记方法是分析紫斑牡丹品种遗传多样性新的可靠的方法。 甘肃是紫斑牡丹主产地,也是早期人工培育紫斑牡丹的中心。成仿云等[21]利用自然杂交和人工杂交的方式培育出了500多个紫斑牡丹新品种。在不定向的人工杂交过程中,60余个中原牡丹品种被引入,导致紫斑牡丹更加多元化的遗传背景。遗传多样性的最直接反应是形态多样性。紫斑牡丹从形态上表现出极高的多样性,植株高矮、花色、花型、叶片形状等均有很大差异。 紫斑牡丹品种群是由野生紫斑牡丹引种驯化形成了一些原始品种后,再由中原牡丹品种的种质介入而产生了一大批传统品种,最后又通过回交和中原牡丹的再次介入产生了许多新品种。最主要和直接的种源是裂叶紫斑牡丹,而矮牡丹和阳杨山牡丹通过中原牡丹间接地产生了影响。目前尚没有文献关于紫斑牡丹品种间鉴别的报道,一般研究多偏向于紫斑牡丹遗传多样性的分析,关于品种鉴别研究收获较少,只有苏雪等利用RAPD技术将16个紫斑牡丹品种区分开来。本研究采用特异条带加单一引物鉴别的方式,将统计出的0、1条带转化为十进制数,分析比较后一共区分出了39个品种,品种鉴别性高,可为以后紫斑牡丹品种鉴别提供新方向。 种质资源保护及优良品种选育的重要前提就是对不同种质资源的精确鉴定和遗传多样性描述[22]。根据条带分析,引物11鉴别性最强,共可以鉴别13个品种,这是截至目前紫斑牡丹品种鉴定中突破前人研究的成果。这些特异性标记是区分紫斑牡丹品种的关键信息,在紫斑牡丹品种的特征描述、保护和开发利用中起到至关重要的作用。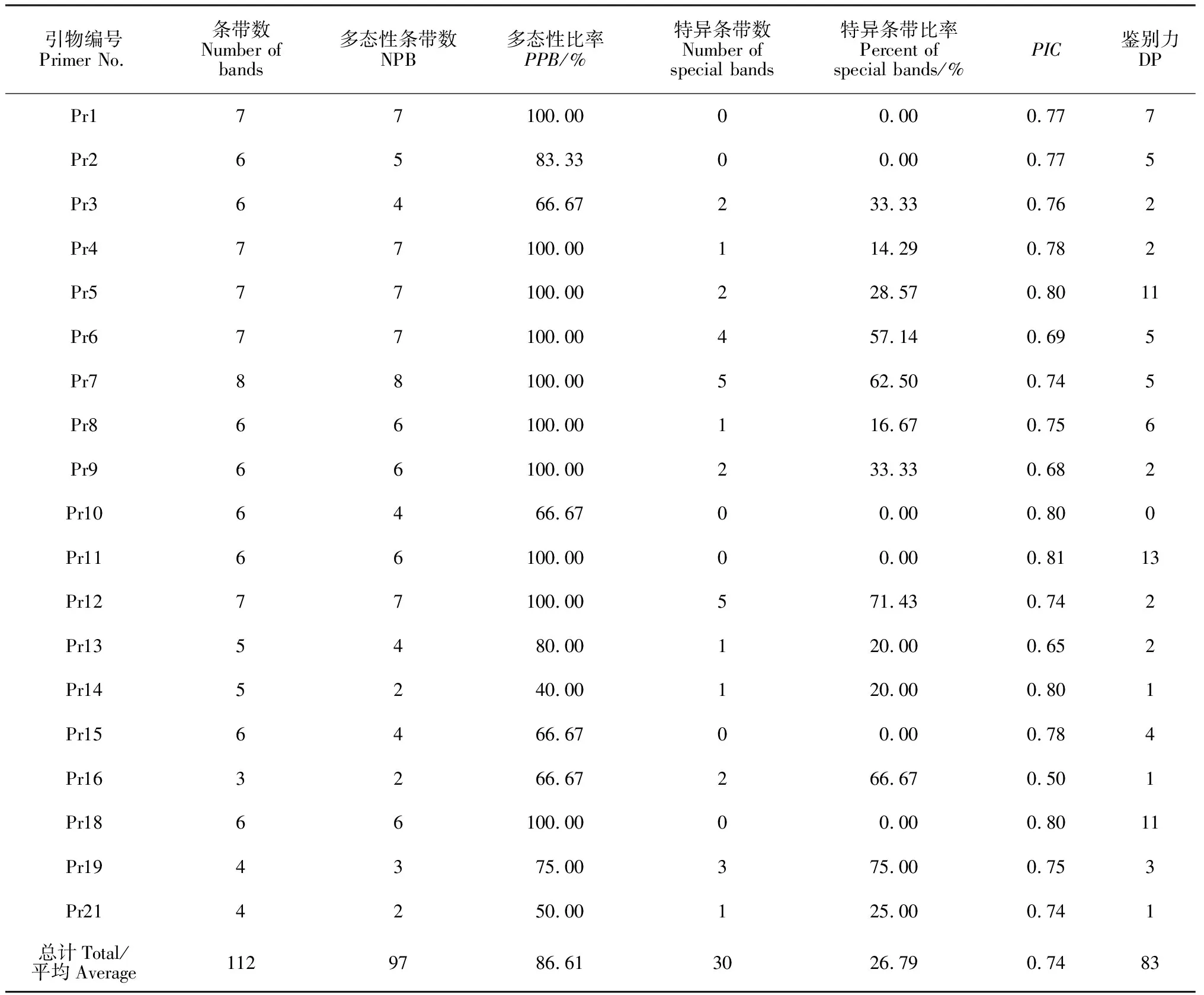

2.5 紫斑牡丹品种鉴定
3 讨 论
3.1 利用CDDP分子标记技术分析紫斑牡丹遗传多样性
3.2 利用CDDP分子标记技术进行紫斑牡丹品种鉴别
