白菜型油菜RbohC和RbohF基因克隆与表达分析
2018-12-05张腾国刁志宏史中飞
张腾国,李 瑶,刁志宏,史中飞,王 娟,郑 晟
(西北师范大学 生命科学学院,兰州 730070)
在自然环境中,植物的生长会受到各种非生物胁迫的影响,例如干旱、高盐和极端温度,是世界许多地区植物生长和生产力最重要的制约因素之一,植物对逆境的反应很复杂,涉及细胞、生理生化和分子机制。最近的研究表明,在胁迫条件下,植物细胞能够感知并通过活性氧(reactive oxygen species,ROS)信号诱导适应性反应,作为其胁迫耐受机制的一部分,而NADPH氧化酶是产生ROS的关键酶,能通过调节ROS产生来响应不同的非生物胁迫和生物胁迫[1],因此NADPH氧化酶在生物生长、发育过程中起重要作用[2-3]。在植物中,NADPH氧化酶也被称为呼吸爆发氧化酶同系物(respiratory burst oxidase homolog,Rboh),主要结构包含6个保守的跨膜结构域,其具有C-末端FAD和NADPH亲水结构域、2个血红素基团和2个N-末端Ca2+结合EF-手性基序。目前已经在多种植物中鉴定和克隆得到Rbohs基因。拟南芥基因组含有10个NADPH氧化酶编码基因,命名为AtRbohA-J,在整个植物发育过程和响应环境因素时表现出不同的表达模式[1,4],AtRbohA,AtRbohB和AtRbohC只在根中表达,特别是在伸长区,且AtRbohC在根毛发育中起作用[5],AtRbohH和AtRbohJ在花粉中表达,而AtRbohD和AtRbohF在所有植物器官中均表达[6]。同时,AtRbohD已被证明参与由多种非生物胁迫诱导的快速系统信号传导[7],能够影响H2O2的积累,并参与乙烯信号传导抑制根系伸长的释放[8],并且是拟南芥中血红素加氧酶介导的盐适应信号传导所必需的[9]。有研究表明,盐胁迫能诱导AtrbohF基因的表达,调节拟南芥根脉管系统的ROS水平,进而响应盐胁迫[10],番茄中大量的ROS积累能够诱导SlRboh1基因(与AtRbohF同源)的表达水平上调[11]。也有研究表明,在大多数情况下,抑制NADPH氧化酶使得ROS积累减少,从而导致对细胞死亡和抗逆性的反应的变化,如用DPI(二苯基碘)抑制NADPH氧化酶活性,减少了H2O2的产生,从而降低了水稻中乙烯诱导的细胞死亡率[12],并导致番茄中几种非生物胁迫相关的防御相关基因的表达下调[13]。
油菜属于十字花科、芸薹属植物,是世界重要的油料作物之一,也是主要经济作物[14],其中油菜作为中国第一大油料作物,其生产以冬油菜为主,占全国油菜种植面积的90%左右,而甘肃天水以西以北的广大北方旱寒区气候严寒,低温、干旱少雨,地表水缺乏,土地沙漠化程度大,自然生态条件十分严酷,冬茬农作物很难与严酷的冬季低温、干旱抗争,越冬十分困难,冬油菜尤其如此[15]。甘肃农业大学培育的‘陇油6号’强抗寒冬油菜品种,可在北方-32 ℃极端低温条件下越冬,解决了北方冬油菜种植的越冬问题,为北方冬油菜种植提供了保障。而推广冬油菜种植不但可以增产油料,在增加北方冬季土地覆盖率、提高土壤有机质、改善生态环境、减少沙尘暴等方面也有重要意义。
近年来研究表明,在植物应答生物胁迫和干旱、冷、盐、ABA以及重金属等非生物胁迫时,可通过Rboh基因的表达变化而起作用。在盐胁迫环境中AtRbohD和AtRbohF产生的ROS作为信号分子来调节体内Na+/K+的平衡,从而提高了拟南芥的耐盐性[16];ABA 作为信号分子可以调节水分平衡和诱导胁迫耐受性,在拟南芥中通过ABA诱导保卫细胞使AtRbohD、AtRbohF基因表达[17];玉米ZmRbohA/B/C/D基因表达受水分胁迫所诱导[18],油菜RbohB基因表达受低温、高盐、H2O2诱导[19]。目前,以上关于其他植物中Rboh基因表达对非生物胁迫的响应主要集中在RbohD基因方面,在油菜Rboh基因表达对非生物胁迫的响应主要集中在RbohB基因方面,而RbohC和RbohF基因对非生物胁迫的响应还没有相关报道。因此,本研究以抗寒性强的白菜型品种‘陇油6号’和抗寒性弱的‘天油2号’为研究材料,克隆得到了‘陇油6号’油菜NADPH氧化酶基因RbohC和RbohF,并对其进行生物信息学分析,探讨了抗寒性不同的2种油菜在低温、干旱、盐、ABA、H2O2、H2O2清除剂DMTU、MAPKK抑制剂U0126、NADPH氧化酶抑制剂DPI和IMD处理下,对油菜RbohC、RbohF基因表达水平的影响,为深入研究油菜RbohC、RbohF基因的生物学功能提供科学依据。
1 材料和方法
1.1 材料培养及处理
白菜型油菜(B.rapa)种子(‘陇油6号’和‘天油2号’)由甘肃农业大学提供。将购自上海森科园林公司的进口的丹麦品质草炭土与蛭石按2∶1的比例混合均匀,装入事先用84消毒液消毒并洗涤干净的小花盆中,用含有0.05 g/L艾美乐杀虫剂(拜耳作物科学有限公司)的Hoagland营养液完全浸透土壤,挑选颗粒饱满,大小一致的2种油菜种子若干,经1% NaClO消毒后播种到营养土中,每盆8~10粒,播种结束后标记,置于14 h/10 h(光照/黑暗)、250 μmol·m-2·s-1的光照培养架上培养大约4周左右后,挑选长势一致的幼苗进行以下处理:1)低温处理:将长势相同的2种油菜幼苗置于4 ℃低温培养箱中进行不同时间段(12、24、36、48 h)的胁迫处理;2)PEG-6000模拟干旱处理:将2种油菜幼苗缓苗后分别浸泡于含有4个浓度PEG-6000(5%、10%、15%、20%)的Hoagland营养液中处理6 h;3)NaCl胁迫处理:将缓苗后的2种油菜幼苗分别浸泡于含有0、50、100、150、200 mmol·L-1NaCl的Hoagland营养液中处理12 h;4)ABA处理:长势相同的2种油菜分别用50、100、150、200 μmol·L-1的ABA喷洒叶片,直到叶片滴水为止,处理12 h;5)H2O2处理:分别用5、10、15、20 mmol·L-1的H2O2喷洒2种油菜叶片,直到叶片滴水为止,处理12 h;6)抑制剂处理(包括H2O2清除剂DMTU、NADPH氧化酶抑制剂DPI和IMD、MAPKK抑制剂U0126处理):将长势一致的2种油菜幼苗从营养土中刨出,缓苗4 h后分别浸泡于含有10 μmol·L-1U0126、40 mmol·L-1DMTU、10 μmol·L-1DPI和 150 mmol·L-1IMD的 Hoagland营养液中处理12 h,处理结束后分别剪取上述处理的2种油菜叶片,用于总RNA提取。
1.2 油菜RbohC、RbohF基因的克隆
使用总RNA提取试剂盒(Bioteke公司)提取油菜叶片中的总RNA,参照PrimerScriptTMRT reagent Kit with gDNA Eraser(Perfect Real Time)反转录试剂盒(TaKaRa公司)合成cDNA的第一条链。
从GenBank查找并下载RbohC(GenBank 登录号:XM_009134386)、RbohF(GenBank 登录号:XM_009114548)基因的预测序列,并依照RbohC、RbohF基因的预测序列设计引物RBOHC-U、RBOHC-D、 RBOHF-U、RBOHF-D(表1)。以‘陇油6号’油菜反转录cDNA为模版,按照Premix Ex Taq DNA Polymerase 说明书(TakaRa公司)进行PCR扩增,扩增体系为:Premix Ex Taq DNA Polymerase 12.5 μL,上下游引物和模板各1 μL,加灭菌ddH2O至总体积25 μL。PCR扩增程序为:95 ℃预变性3 min,95 ℃变性15 s,46.5 ℃(克隆RbohF基因CDS区时52 ℃)退火15 s,72 ℃延伸3 min,循环30次后72 ℃延伸5 min。反应结束后,用1%的琼脂糖进行电泳检测,按照EasyPure Quick Gel Extraction Kit(离心柱型)回收试剂盒(全式金公司)进行目的片段的回收,回收产物与pTG19-T vector载体连接,反应体系与条件为:T4DNA Ligase Buffer 0.5 μL、胶回收产物3.5 μL、pTG19-T vector载体0.5 μL、T4DNA Ligase 0.5 μL,置于4 ℃连接过夜后转化Trans5α大肠杆菌感受态细胞,蓝白斑筛选阳性克隆,送华大基因公司测序。

表1 PCR引物序列
1.3 目的基因序列及其蛋白质的生物信息学分析
利用在线工具ExPASy ProtParam(http://web.expasy.org/protparam/)分析2种蛋白质的分子量、理论等电点、不稳定性和平均疏水性,SignalP 4.1 Server(http://www.cbs.dtu.dk/services/SignalP/)和ProtCompv.9.0(http://linux1.softberry.com/berry.phtml?topic=protcompp)工具在线预测该蛋白的信号肽和亚细胞定位;利用SMART程序(http://smart.embl-heidelb-erg.de)NCBI CDD(https://www.ncbi.nlm.nih. gov/Structure/ cdd/ cdd.shtml)、TMHMM Server v.2.0(http://www.cbs.dtu.dk/services/TMHMM/)和TMpred(http:// www.ch.embnet. org/softwa-re/TMPRED_form.html)预测EF手性模体结构(EF-hand)、跨膜结构域(TM)、黄素腺嘌呤二核苷酸结合结构域(FAD)、NAD焦磷酸结合结构域和NADP核糖保守结合位点,并使用DNAMAN软件进行多重序列比对,Mega 5.0软件对油菜的Rbohs蛋白进行聚类分析,并构建系统发育树。
1.4 油菜RbohC、RbohF基因在不同组织及非生物胁迫下的表达
剪取长势相同的2种油菜不同组织(根、茎、叶),通过实时荧光定量PCR检测油菜RbohC、RbohF基因在不同组织中的表达模式。提取低温、PEG-6000模拟干旱、ABA、H2O2处理后的‘陇油6号’和‘天油2号’叶片总RNA,经反转录成cDNA后,以ActinF、ActinR为管家基因引物,RBOHC-U1、RBOHC-D1为RbohC引物,RBOHF-U1、RBOHF-D1为RbohF引物,依据SYBR Premix Ex TaqTM试剂盒(TaKaRa公司)用25 μL反应体系进行定量检测,每个样品做3个重复。定量反应体系为:SYBR Premix Ex TaqTM12.5 μL,上、下游引物各1 μL,cDNA模板2 μL,ddH2O 8.5 μL。反应程序为:95 ℃预变性30 s;95 ℃变性5 s,60 ℃退火20 s,40次循环;55~95 ℃每30 s升高0.5 ℃,81个循环。每个样品均重复3次,采用2-ΔΔCt法[14]分析基因的相对表达量。
1.5 数据处理与分析
用SPSS 20.0软件进行数据统计分析,用Excel 2013软件作图。
2 结果与分析
2.1 油菜RbohC、RbohF基因的克隆
从GenBank中查找RbohC(GenBank登录号:XM_009134386)、RbohF(GenBank 登录号:XM_009114548)基因的预测序列,根据预测序列设计引物以抗寒性强的‘陇油6号’油菜总RNA反转录cDNA为模版,扩增得到2条3 000 bp左右的单一条带(图1,A和图1,B),测序得到全长3 050 bp的油菜RbohC基因序列和2 995 bp的RbohF基因序列;与NCBI中公布的RbohC(XM_009134386)进行blast比对,克隆得到的的油菜RbohC基因序列与其完全一致,其包含2 733 bp的开放阅读框,起始密码子ATG之前有72 bp的5′非翻译区,终止密码TAA之后有245 bp的3′非翻译区,其编码910个氨基酸(图1,A);克隆得到的油菜RbohF基因序列包含2 847 bp的开放阅读框,起始密码子ATG之前有56 bp的5′非翻译区,终止密码TAA之后有92 bp的3′非翻译区,其编码948个氨基酸(图1,B),与NCBI中公布的RbohF氨基酸序列比对,有3处突变,分别是84位的异亮氨酸(Ile)→甲硫氨酸(Met),458位的苯丙氨酸(Phe)→缬氨酸(Val),495位的缬氨酸(Val)→异亮氨酸(Ile),进行多次独立重复实验,突变位点是一致的,可能是由于不同物种特异性所致。
2.2 油菜RbohC、RbohF基因编码蛋白同源性比较与结构分析
利用DNAMAN软件,将克隆的油菜RbohC、RbohF基因编码的氨基酸与NCBI中登录的拟南芥AtRbohC (AAS15724.1)、萝卜RsRbohC (XP_018476885.1)、盐芥EsRbohC (XP_006402027.1)、草莓FvRbohC (XP_004309557.1)、拟南芥AtRbohF (NP_564821.1)、萝卜RsRbohF (XP_018457117.1)、荠菜CrRbohF (XP_006301285.1)、盐芥EsRbohF (XP_006391675.1)的氨基酸序列进行同源性分析和多重序列比对,结果表明(图2),油菜RbohC、RbohF编码蛋白与多种植物相应蛋白氨基酸序列具有较高的同源性,且两者都与萝卜RsRbohC同源性最高,分别为95%和96%,这些序列高度保守并且含有NADPH氧化酶的典型保守结构域,包括2个可以与Ca2+结合的EF手性模体结构(EF-hand)、6个跨膜结构域(TM I-TM VI)、黄素腺嘌呤二核苷酸结合结构域(FAD)、NAD焦磷酸结合结构域和C末端区域中的NADP核糖保守结合位点。

M.DL4500图1 油菜RbohC、RbohF基因片段电泳图Fig.1 RbohC and RbohF gene fragments electrophoresis in rapeseed
2.3 油菜RbohC和RbohF基因的系统发育分析
为了探究油菜中RbohC和RbohF基因家族成员的系统进化关系,从GenBank中检索到拟南芥、萝卜、盐芥、草莓和荠菜的RbohC和RbohF编码蛋白序列,用Mega 5.0软件对油菜的RbohC和RbohF编码蛋白进行聚类分析,并构建系统发育树(图2)。结果表明,油菜BrRbohC与萝卜RsRbohC聚集在一个分支上,而油菜BrRbohF与荠菜CrRbohF进化关系较密切。
2.4 油菜RbohC和RbohF基因编码蛋白的生物信息学分析
对油菜RbohC和RbohF基因编码蛋白进行生物信息学在线分析可知,油菜RbohC和RbohF蛋白的开放阅读框长度分别为2 733 bp和2 847 bp,分子量分别为103 kDa和108k Da,理论等电点为9.47和9.21,不稳定系数分别为42.96和47.18,为不稳定蛋白;平均疏水性为-0.245和-0.269,为亲水性蛋白,该家族蛋白均不存在信号肽序列,为非分泌蛋白,但油菜RbohC含有4个跨膜螺旋(TMHs),其RbohF蛋白含有6个跨膜螺旋,亚细胞定位都为质膜。
2.5 油菜RbohC、RbohF基因在不同组织中的特异性表达分析
植物NADPH氧化酶基因是个多基因家族,不同的Rbohs基因的组织分布、基因表达情况都不相同,本研究剪取长势相同且在正常培养条件下生长的‘天油2号’和‘陇油6号’植株,提取其根、茎、叶和下胚轴中的总RNA,用反转录得到的cDNA为模板实时荧光定量PCR检测RbohC、RbohF基因在不同组织中的表达,实验结果表明:RbohC、RbohF基因在2种油菜的根、茎、叶和下胚轴中均表达,且RbohC基因在2种油菜的根中表达量最高,叶中最低(图4),而RbohF基因在2种油菜的下胚轴中表达量最高,茎中最低(图4)。

图2 油菜RbohC和RbohF的系统进化树分析Fig.2 Phylogenetic tree analysis of RbohC and RbohF in rapeseed
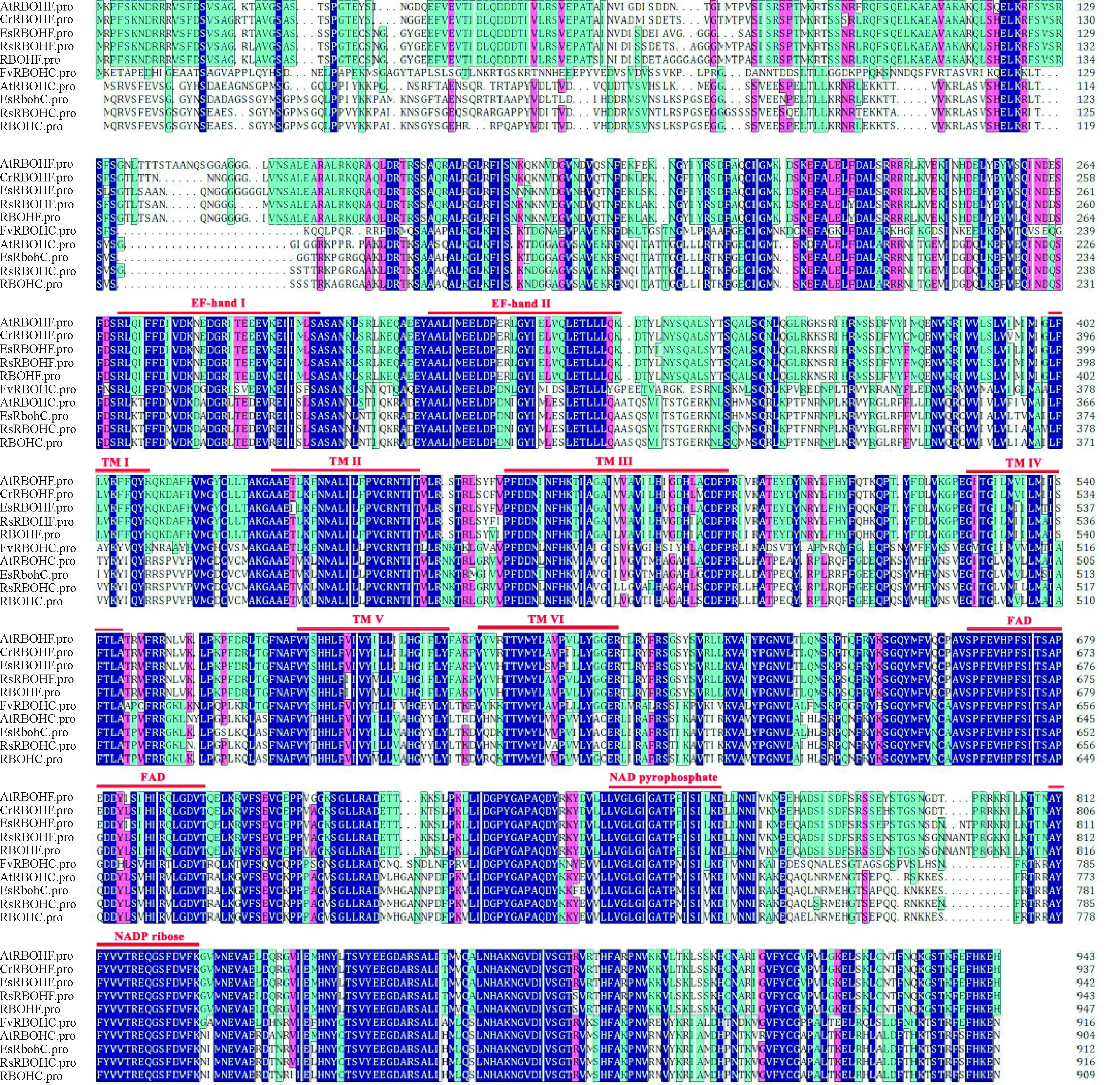
AtRbohC、AtRbohF.拟南芥;RsRbohC、RsRbohF.萝卜;EsRbohC、EsRbohF.盐芥;FvRbohC.草莓;CrRbohF.荠菜; RbohC、RbohF.油菜;下同;EF-handⅠ、Ⅱ. 2个与Ca2+结合的EF手性模体结构;TMⅠ~Ⅵ. 6个跨膜结构域;FAD.黄素腺嘌呤二核苷酸结合结构域; NAD.焦磷酸结合结构域;NADP. C末端区域中的NADP核糖保守结合位点图3 油菜与其他植物RbohC、RbohF氨基酸序列比对AtRbohC and AtRbohF. Arabidopsis thaliana; RsRbohC and RsRbohF. Raphanus sativus; EsRbohC and EsRbohF. Eutrema salsugineum; FvRbohC. Fragaria vesca subsp. vesca; CrRbohF. Capsella rubella; RbohC and RbohF. Brassica rapa; EF-hand Ⅰ-Ⅱ. Two EF chiral phantom structures combined with Ca2+; TM Ⅰ-Ⅵ. 6 transmembrane domains; FAD. Flavin adenine dinucleotide binding domain; NAD. Pyrophosphate binding domain; NADP. NADP ribose conserved binding site in the C-terminal region; The same as belowFig.3 Alignment of the forecast amino acid sequence of RbohC and RbohF between rapeseed and other plant species
2.6 油菜RbohC、RbohF基因在不同胁迫下的表达分析
2.6.1低温胁迫图5,A表明,低温胁迫处理不同时间(0、12、24、36、48 h)后,两品种油菜的RbohC和RbohF基因的表达量都呈先上升后下降的趋势,且RbohC、RbohF基因的表达量在‘陇油6号’中始终高于‘天油2号’;它们的RbohC基因的相对表达量均在36 h达到最大值,分别为对照的33.1和18.2倍,RbohF基因的相对表达量在12 h时达到最大值,分别为对照的4.9和3.1倍。可见,低温诱导两品种油菜RbohC和RbohF基因表达量的变化趋势一致,但抗寒性强品种表达量及其变化幅度均明显大于抗寒性弱品种,同时RbohF基因表达量达到峰值时间明显早于RbohC基因,说明不同品种和基因对低温胁迫的响应过程存在差异。

LYC、TYC分别代表‘陇油6号’和‘天油2号’品种的RbohC基因,而LYF、TYF分别代表‘陇油6号’和‘天油2号’品种的RbohF基因;相同品种同一基因内不同字母表示基因表达量于组织间(处理间)在0.05水平存在显著差异(P<0.05);下同图4 不同品种油菜RbohC、RbohF基因组织特异性表达LYC and TYC stand for RbohC gene in cultivar ‘Longyou 6’ and ‘Tianyou 2’, while LYF and TYF stand for RbohF gene in cultivar ‘Longyou 6’ and ‘Tianyou 2’, respectively; The different letters within the same gene and cultivar indicate significantly different expression among tissue (treatment) at 0.05 level (P<0.05); The same as belowFig.4 The expression of RbohC and RbohF in different tissues of different rapeseed cultivars
2.6.2干旱胁迫由图5,B可知,PEG-6000模拟干旱胁迫处理(5%、10%、15%和20%)2种油菜6 h后,它们的RbohC和RbohF基因表达量都随浓度增加而呈现逐渐上升趋势,且均比对照显著升高,均在20% PEG-6000处理时表达量达到最大值;同时,在相同PEG-6000胁迫浓度下,‘陇油6号’两基因表达量始终明显高于‘天油2号’,RbohC基因表达量始终明显高于RbohF基因表达量。研究结果表明,2种油菜中RbohC和RbohF基因表达随干旱胁迫程度表现出相同的变化趋势,但升高的幅度在品种间和基因间存在差异,并以抗寒性强品种和RbohC基因升高幅度较大,即不同品种和基因对干旱胁迫的响应也存在差异。
2.6.3盐胁迫图5,C显示,用不同浓度的NaCl(0、50、100、150、200 mmol·L-1)处理2种油菜,RbohC和RbohF基因的表达量均呈先上升后下降的趋势。其中,RbohC基因的表达量在‘陇油6号’和‘天油2号’中分别比对照提高1.3~4.7倍和0.85~3.8倍,并均在150 mmol·L-1NaCl处理下达到最大值;RbohF基因的表达量在‘陇油6号’和‘天油2号’中分别比对照提高1.3~3.7倍和1.1~1.9倍,且均在100 mmol·L-1NaCl处理下达到最大值。可见,油菜RbohC和RbohF基因的表达随盐胁迫浓度的整体变化趋势一致,但表达量因品种和基因而异,其中抗寒性强的品种明显高于抗寒性弱品种,RbohC基因在低浓度(50~100 mmol·L-1)时低于RbohF基因,在高浓度(150~200 mmol·L-1)时则高于RbohF基因。
2.6.4ABA处理从图5,D来看,2种油菜经不同浓度的外源ABA(50、100、150、200 μmol·L-1)处理12 h后,RbohC和RbohF基因的表达在2种油菜中表现出不同的变化趋势。其中,RbohC基因表达量在‘陇油6号’随ABA浓度增加而逐渐升高,比对照组提高3.4~61倍,而在‘天油2号’中呈先升高后下降的趋势,并在100 μmol·L-1时达到最大值,比对照提高6.8倍;RbohF基因表达量在‘陇油6号’中随外源ABA 浓度的升高呈先升后降的趋势,比对照提高1.9倍~4.5倍,并在150 μmol·L-1时达到最大值,而在‘天油2号’中与外源ABA 浓度呈正向相关,比对照提高1.8~3.3倍。这表明油菜RbohC和RbohF基因的表达均受到ABA的诱导,但在2种油菜品种中整体变化趋势和幅度均不同,其在抗寒性强品种中表达量明显高于抗寒性弱品种,而RbohC表达量又高于RbohF,尤其以抗寒性强品种RbohC表达量变化最为突出。
2.6.5H2O2处理用不同浓度的H2O2(5、10、15、20 mmol·L-1)处理2种油菜12 h后,RbohC和RbohF基因的表达量均呈先升高后下降的变化趋势(图5,E)。其中,‘陇油6号’和‘天油2号’RbohC基因的表达量均在15 mmol·L-1时达到最大,分别比对照显著增加了6.4和5.5倍;RbohF基因的表达量在‘陇油6号’中于10 mmol·L-1时达到最大,比对照组显著提高5.9倍,而在‘天油2号’中于15 mmol·L-1时达到最大,为对照的3.1倍。以上结果表明,油菜RbohC和RbohF基因的表达均受到H2O2的诱导,且表达量随胁迫浓度的整体变化趋势在2种油菜中一致,但表达量因品种和基因而异,具体表现为抗寒性强品种明显高于抗寒性弱品种,RbohC基因高于RbohF基因。
2.6.6抑制剂处理‘陇油6号’和‘天油2号’经DPI、IMD、DMTU和U0126处理12 h后,其RbohC、RbohF基因的表达量均比对照大幅显著下降(图5,F),但两品种和基因其受 DPI、IMD、DMTU和U0126的抑制强度存在差异;RbohC基因表达量受到DMTU和U0126的抑制程度明显较大,而RbohF基因均受各抑制剂的严重影响,同时‘陇油6号’表达量受各抑制剂的影响始终比‘天油2号’轻。表明DPI、IMD、DMTU和U0126均能显著抑制两品种油菜RbohC、RbohF基因的表达,但抑制程度因品种和基因而异,抗寒性弱品种和RbohF基因更易受到影响。

图5 不同逆境胁迫和抑制剂处理下油菜RbohC和RbohF基因表达分析Fig.5 Analysis of RbohC and RbohF gene expression in rapeseed under different stresses and inhibitors
3 讨 论
NADPH氧化酶最早发现于人免疫系统的吞噬细胞,是一个异源多聚体蛋白。在植物应答生物胁迫和干旱、冷、盐、ABA、H2O2等非生物胁迫反应时,质膜NADPH氧化酶通过短时间内大量产生信号分子活性氧(ROS)调节基因表达和细胞的新陈代谢,是诱导产生超氧化物生成所必需的,使植物及时应对逆境胁迫作出反应,以适应环境的变化[19-20]。本研究从‘陇油6号’油菜中克隆得到了含完整编码序列的NADPH氧化酶RbohC和RbohF基因,序列分析表明油菜RbohC和RbohF基因与其他植物中已克隆得到的RbohC和RbohF基因同源性很高。不同逆境胁迫均可以诱导Rbohs基因的表达变化,但不同的Rbohs基因的组织分布、基因表达情况都不相同。有研究表明机械损伤能够诱导番茄Rbohs基因的表达[21]和马铃薯块茎中St-rbohA基因表达上调[22]。轻度盐胁迫会诱导ROS积累和AtRbohD表达呈双峰变化[23]。干旱、高温、盐和外源Ca2+可以诱导水稻中9个rboh基因的特异性表达[24]。本研究发现,在低温、PEG-6000模拟干旱、盐处理后,‘陇油6号’和‘天油2号’油菜RbohC、RbohF基因的表达与对照相比均明显增加,但‘陇油6号’中RbohC和RbohF基因受诱导程度均高于‘天油2号’,表明油菜RbohC、RbohF基因的表达受到低温、干旱、盐胁迫的诱导,该基因在响应非生物胁迫中发挥作用,而抗寒性强品种RbohC和RbohF基因对胁迫的响应更敏感。同时,低温胁迫和PEG-6000模拟干旱胁迫下油菜RbohC基因的表达量均高于RbohF基因,可能在低温胁迫和干旱胁迫下油菜RbohC的作用更明显。另外,随着盐胁迫浓度的升高,油菜RbohC基因的表达量高于RbohF基因,表明油菜RbohC基因响应盐胁迫诱导调控表达更敏感。
脱落酸(ABA)在植物的整个生长发育过程中和植物应对各种生物和非生物胁迫的反应中起重要作用[25],NADPH氧化酶已被证实是ABA诱导ROS产生的主要来源,ROS的大量产生会引起植物体ABA含量的升高,从而介导ABA信号通路。拟南芥的保卫细胞中ABA能够诱导AtRbohD和AtRbohF表达[26-27]。玉米中的研究发现,水分胁迫能引起的内源ABA含量升高,外源ABA能够诱导NADPH氧化酶活性的显著提高,且伴随有大量的活性氧的产生[28]。在玉米叶片中,ABA能够诱导4个编码NADPH氧化酶基因(ZmrbohA-D)表达,且这些基因的表达具有双峰特征[29]。本研究中,外源ABA能诱导2种油菜RbohC、RbohF基因的表达上调,且‘陇油6号’中RbohC和RbohF基因受诱导程度均高于‘天油2号’,表明油菜RbohC、RbohF基因可能与ABA信号途径有关,参与植物对非生物胁迫的响应,其中抗寒性强的油菜RbohC和RbohCF基因对ABA的响应更敏感。
MAPK激酶级联途径是调节植物多种非生物胁迫的重要途径之一,且MAPK参与NADPH氧化酶活性的调节,番茄中NO和NADPH氧化酶依赖性氧化爆发也受MAPK信号调节[30],玉米中ZmMPK5可通过调控转录因子而正反馈调节NADPH氧化酶的基因表达与酶活性,从而放大H2O2信号[31];此外,H2O2能够诱导NADPH氧化酶基因表达产生ROS,并放大ROS信号,调控下游信号通路中的基因表达,促进各种抗氧化防护酶活[32-33]。拟南芥突变体中,AtrbohD已被证实对于ROS信号的放大是必需的[34]。细胞内较少的ROS通过NADPH氧化酶将ROS信号放大,使信号迅速向下游传递是ROS信号转导的重要机制。但目前对H2O2能否负反馈调节MAPK激酶级联途径,抑制RBOH的表达,降低ROS的积累方面的研究较少。本研究中用MAPKK抑制剂U0126处理油菜后,其RbohC、RbohF基因的表达均被抑制,表明油菜RbohC、RbohF基因的表达受到MAPK激酶信号途径的调节,而用H2O2处理后RbohC、RbohF基因的表达上调,H2O2清除剂DMTU、NADPH氧化酶抑制剂DPI和IMD处理下油菜RbohC、RbohF基因的表达均被抑制,又表明油菜RbohC、RbohF基因的表达受到H2O2的反馈调节,但用H2O2、H2O2清除剂和NADPH氧化酶抑制剂处理油菜后‘陇油6号’中RbohC和RbohF基因受诱导程度均高于‘天油2号’,表明抗寒性强品种‘陇油6号’中RbohC和RbohCF基因对H2O2和MAPK激酶信号途径的响应更敏感,而MAPK激酶信号途径、RbohC和RbohF以及H2O2之间是否存在着关联调节机制,有待进一步研究。
