山乌桕叶片转色前后主要色素含量变化研究
2018-12-03林成立
林成立
(福建省林业科技试验中心,福建 南靖363600)
山乌桕(Sapiumdiscolor(Champ.exBenth.)Muell.Arg)属于大戟科乌桕属植物,为落叶乔木或灌木,高度在3~12m左右,广泛分布于江西、云南、福建等长江以南的多个省区,为中国特有的经济树种[1]。目前,国内针对山乌桕的研究报道现主要集中在分类特征、食品工艺、化学成分分析、苗木繁育等方面[2~6]。山乌桕树干通直、树皮光滑、树形优美,叶片在秋冬季转色变红,十分美观,具有较高的园林观赏价值。彩叶树种叶片转色过程,是叶绿素不断降解、花色苷和类胡萝卜素和一些其他色素不断累积而共同作用的结果[7~9]。为进一步揭示山乌桕叶片转色机制,本研究以山乌桕的叶片为研究材料,提取转色前后10个家系山乌桕叶片的叶绿素、类胡萝卜素及花色苷,检测3种色素转色前后的含量变化,鉴定花色苷组分,初步揭示了山乌桕叶片的转色机理,可为山乌桕观赏性价值的开发应用提供参考依据。
1 材料与方法
1.1 材料来源
实验材料来源于福建省洋口国有林场山乌桕试验林。试验林中有10个家系,种源来源于福建省林业科技试验中心所选的10株山乌桕树,依次编号为1~10。在试验林中随机选取各家系样株4株,做好标记。在叶片变色前后分别在东南西北4个方位各收集叶片20片。山乌桕为冬季全落叶乔木,因此所采叶片均为当年生。采集时间分别为2016年12月6日和12月29日。样品夹冰送回实验室,液氮速冻,置于-40°C保存备用。
1.2 方法
1.2.1 叶绿素和类胡萝卜素含量的测定
参考王学奎[10]的方法,采用分光光度法测定叶绿素和类胡萝卜素含量。
1.2.2 花色苷含量的测定
花色苷的提取及含量测定参照林植芳等[11]的方法。
1.2.3 花色苷的提取和纯化
山乌桕叶片花色苷的提取、分离纯化参考Zhang等[9]的方法。取转色后山乌桕叶片20g,按照1︰5(w/v)加入经过冰浴冷却的1%的盐酸甲醇溶液,并用研磨棒研磨充分至匀浆状态。在4°C的条件下提取过夜。萃取液用滤纸进行过滤,滤液在40℃下旋转蒸发直至10mL左右。将浓缩后的滤液上XAD-7柱 (2.5cm×20cm),以水洗2个柱体积以去除柱内杂质,而后用0.1% HCl甲醇溶液进行洗脱,分部收集并分别测定光密度D510nm。收集合并高峰管,在40℃条件下旋转蒸发至粉末状,而后以0.1% HCl甲醇溶液进行充分溶解,离心去除不溶性杂质,上清即为初纯化的花色苷溶液。
初纯化样品过Sephadex LH-20柱 (1.0cm×55cm,1%蚁酸溶液平衡),以1%蚁酸溶液洗脱。分部收集并分别测定光密度D510nm,收集合并高峰管,旋转蒸干。用一定量的1%蚁酸溶液进行充分溶解,获得纯化的山乌桕叶片中的花色苷样品[9]。
1.2.4 花色苷的HPLC ESI-MS/MS鉴定
将柱纯化获得的花色苷样品,按照以下程序进行HPLC-MS/MS分析。
HPLC(Agilent 1260) 色谱条件为:Agilent Eclipse Plus C18色谱柱 (2.1mm×100mm,3.5μm),柱温35℃,流速0.3mL/min,紫外-可见光检测器。采用梯度洗脱方式,流动相A为2.5%甲酸水溶液,流动相B为甲醇,洗脱程序:0~1.0min,10%溶剂B;1.0~9.0mim,10%~80%溶剂B;9.0~11.0mim,80%溶剂B。质谱 (Agilent 6410) 条件为:电喷雾(ESI),毛细管电压3.5kV;离子源温度350°C;干燥器 (N2) 流速:11L/min,雾化压力:2.4138MPa;Delta EMV:300V;Mass采集范围:100~2000m/z。选用正离子模式检测。
1.3 数据处理
将数据输入至EXCEL和DPS软件,并进行相关统计分析。
2 结果与分析
2.1 转色前后叶绿素含量的变化

图1 山乌桕叶片叶绿素a含量变化
实验结果如图1~3所示,可见供试的样品中只有家系7在转色前后叶绿素含量无显著性差异,其他家系的山乌桕叶片转色后叶绿素a、叶绿素b和总叶绿素含量显著高于转色前。山乌桕叶片中叶绿素a、叶绿素b和总叶绿素含量总体呈下降趋势。
2.2 转色前后类胡萝卜素的变化
实验结果如图4所示,转色前后不同家系山乌桕叶片中的类胡萝卜素含量变化趋势不同,家系1和9的含量显著下降,而家系8的显著上升,其他家系转色前后含量差异不显著。与叶绿素转色前后的变化趋势不同,不同家系山乌桕叶片中的类胡萝卜素转色后含量更趋于接近,而野外调查发现不同家系叶色转红的程度却不同。因此,推测类胡萝卜素在山乌桕叶色变红过程中所起的作用可能不大。
2.3 转色前后花色苷含量的变化
转色前后叶片花色苷含量的变化如图5所示,转色期间不同家系的山乌桕叶片其花色苷含量均急剧累积。山乌桕叶片转色前各家系叶片中的花色苷色素含量均小于0.32mg/g FW,相对于山乌桕叶片变红后的含量,转色前的花色苷含量几乎可以忽略不计。山乌桕叶片转色后花色苷含量至少是转色前的10倍,呈显著上升趋势。
2.4 山乌桕叶片花色苷的分离、纯化
将经过过夜提取的花色苷过滤、旋转蒸发后所得的浓缩液过水平衡的XAD-7柱,洗脱获得1个D510nm高峰(图6)。收集合并高峰管17~27,经旋转蒸发后过分子筛Sephadex LH-20。分子筛色谱结果表明(图7),山乌桕花色苷在Sephadex LH-20柱上只显示单一组分峰,该组分与分子筛介质具较强疏水作用力,致使其洗脱出峰很慢。合并收集D510nm的高峰管,旋转蒸干后再以1%蚁酸进行溶解,获得纯化的山乌桕花色苷溶液。
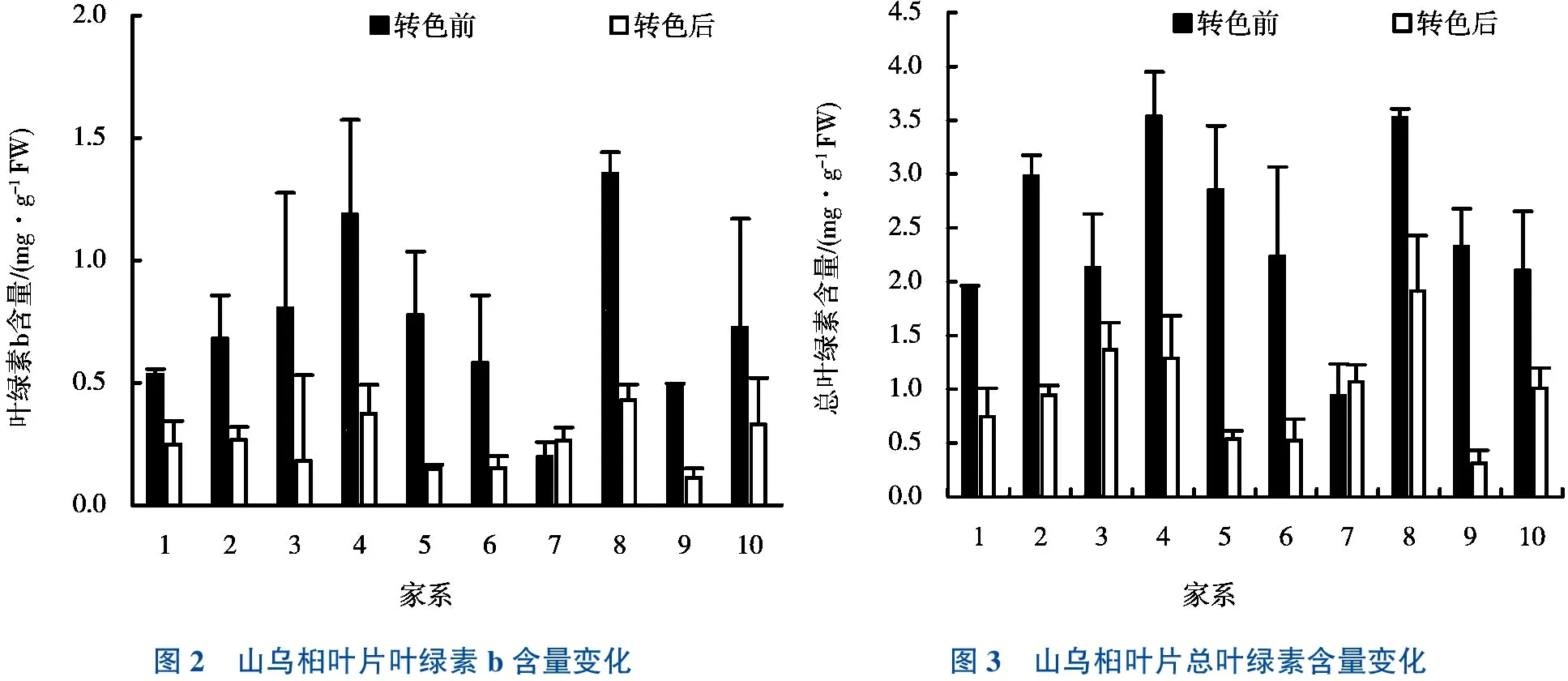
图2 山乌桕叶片叶绿素b含量变化图3 山乌桕叶片总叶绿素含量变化

图4 山乌桕叶片总类胡萝卜素含量变化图5 山乌桕叶片花色苷含量变化
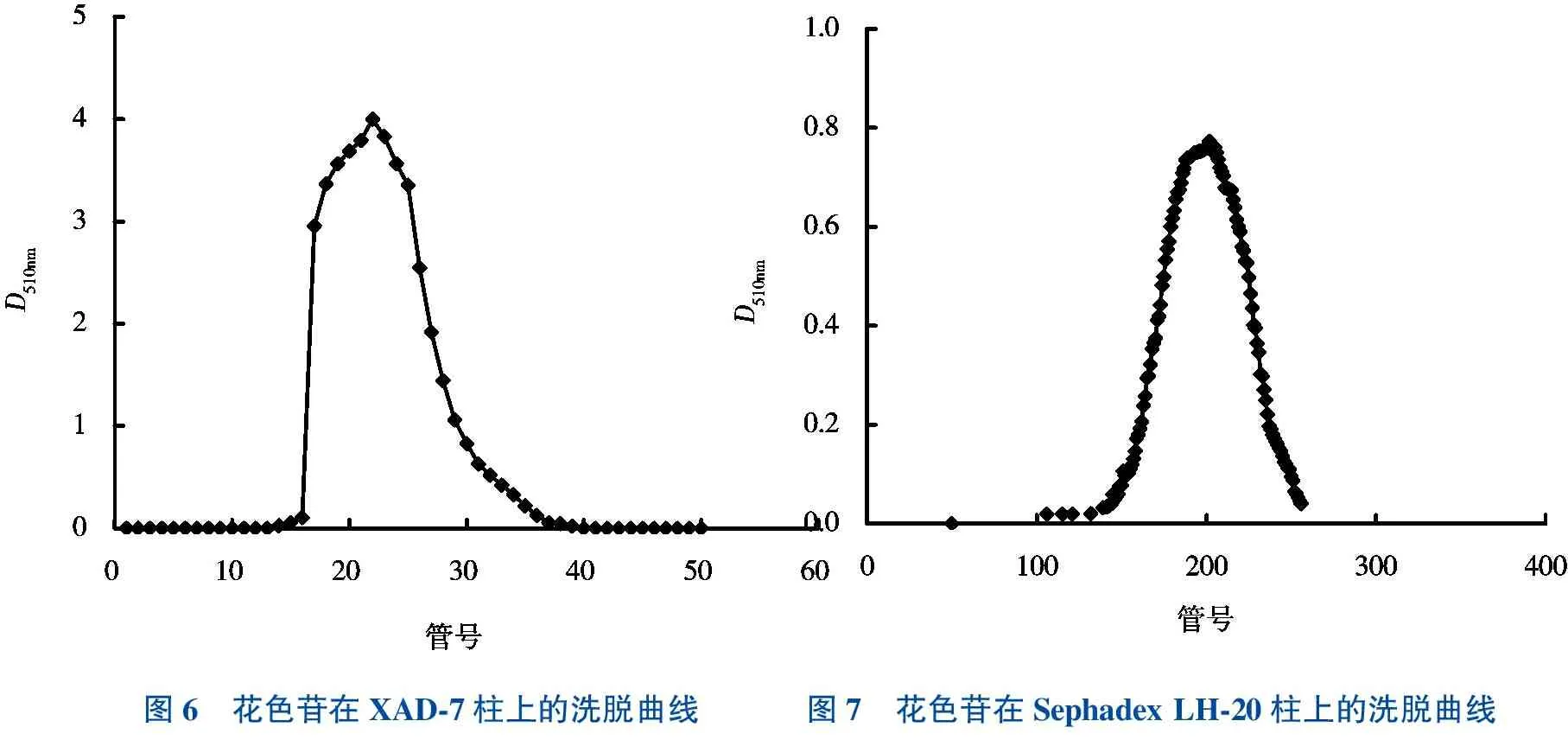
图6 花色苷在XAD-7柱上的洗脱曲线图7 花色苷在Sephadex LH-20柱上的洗脱曲线
2.5 山乌桕叶片花色苷的结构鉴定
将纯化得到的山乌桕叶片花色苷进行HPLC-MS/MS分析,对比紫外254nm和可见光区510nm检测结果,显示样品的花色苷为单一组分,即保留时间(RT)为7.0min的色谱峰(图8)。

图8 山乌桕叶片花色苷的高效液相色谱(HPLC)图
ESI正离子模式下的质谱全离子扫描结果显示(图9、图10),在RT为7.0~7.8min间,最主要含1个质荷比(m/z)为449.2的离子,此外还具1个质荷比为287.1的离子。

图9 山乌桕叶片花色苷的全离子 (TIC) 图
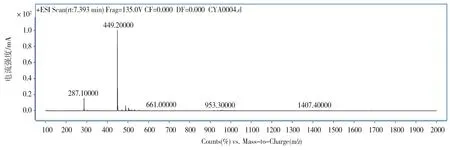
图10 花色苷的离子扫描结果
对质荷比449.2的母离子进行离子碰撞,显示其进一步碎裂,产生质荷比287.1和288.2 2个最主要的碎片离子(图11)。结合前人的研究[12,13],可以确定RT7.0min的色谱峰为矢车菊素-3-O-葡萄糖苷(图12)。因此,在离子扫描中,质荷比449为矢车菊素-3-O-葡萄糖苷的母离子([M+H]+),而质荷比287离子为矢车菊素-3-O-葡萄糖苷部分母离子在质谱条件下糖苷键断裂,产生矢车菊素的离子碎片峰([M-Glucose+H]+)。
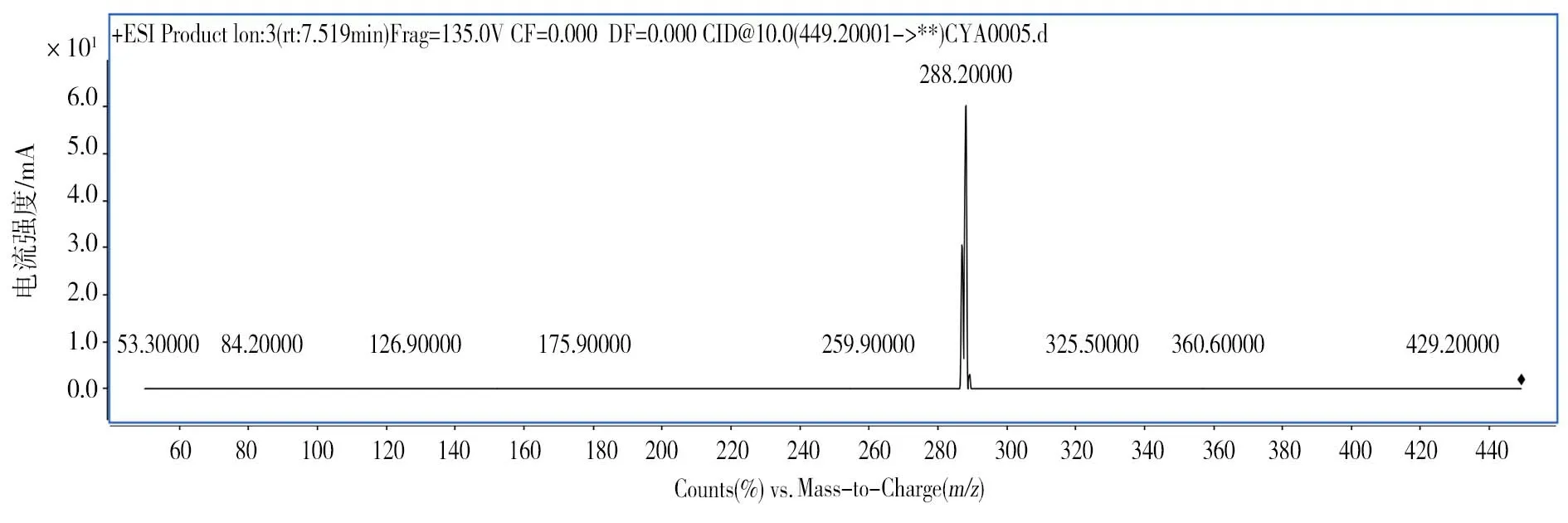
图11 质荷比449.2母离子的离子碰撞图
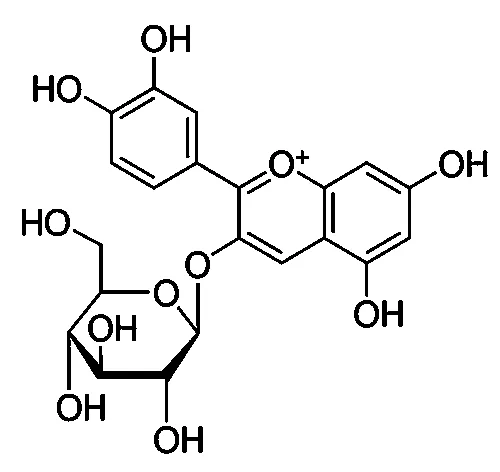
图12 矢车菊素-3-O-葡萄糖苷的结构图
3 讨论
叶绿素是植物进行光合作用的主要色素,是一类含脂的色素家族,通过吸收大部分的红光和紫光,反射绿光,使植物叶片呈绿色。胡萝卜素是一类重要的天然色素的总称,广泛存在于植物细胞中,在植物器官呈黄色、橙色和红色等颜色扮演着重要的角色[7,8]。花色苷属于类黄酮物质,广泛分布于花、茎、叶、果皮等器官的表皮细胞的细胞液之中,并使其呈现出红色、紫红色等不同颜色。部分研究认为,彩叶树种叶片变色过程,是叶绿素不断降解、花色苷和类胡萝卜素和一些其他色素不断累积而共同作用的结果[7~9]。本研究结果显示,山乌桕叶片在转色过程中,叶绿素总体大幅下降;类胡萝卜素变化较小,且不同的家系变化趋势不一致,有的家系类胡萝卜素含量呈下降趋势,有的家系呈上升趋势;叶片转色后,各家系花色苷急剧累积。说明山乌桕叶片变红过程,可能是叶绿素逐渐减少、花色苷逐渐积累的过程,而类胡萝卜素可能在山乌桕叶片转色过程中作用不大。
本研究对山乌桕叶片中的花色苷进行了分离纯化,并对其组分进行了液质分析,色谱检测结果显示,其花色苷为单组分;结合ESI正离子扫描和MS/MS离子碰撞,认为该组分为矢车菊素-3-O-葡萄糖苷。近年来,林木遗传育种已从传统的选育方法发展到分子遗传育种。通过实验结果分析,山乌桕叶片在一定条件的环境胁迫下,激发能增多矢车菊素-3-O-葡萄糖苷含量的相关基因的表达,导致山乌桕叶色变红。以此可以推测,若想选育出叶色更红、或者保持红叶时期更长的山乌桕品种,应当在花色苷有关基因的表达上进行研究。因此,本研究结果可为山乌桕的分子育种提供参考。
