miR-34c在口腔鳞状细胞癌的表达及对Tca8113细胞生物学行为的影响
2018-12-03高继萍宋晓娜续国强卫佳宁田晓琳宋国华
常 凯,高继萍,宋晓娜,续国强,卫佳宁,田晓琳,宋国华*
(1.山西医科大学实验动物中心,实验动物与人类疾病动物模型山西省重点实验室,太原 030001; 2.晋中学院生物科学与技术学院,山西 晋中 030600)
口腔癌是常见的恶性肿瘤,在全球常见癌症中居第6位,其中90%属口腔鳞状细胞癌(oral squamous cell carcinoma,OSCC),口腔癌发病率高且预后生存率低。microRNA(miRNA)的异常表达与口腔癌的发生、转移和预后密切相关[1]。miR-34是一类在进化上非常保守的miRNA,miR-34家族(miR-34s)包括三个同源基因:miR-34a、miR-34b及miR-34c。研究发现:miR-34c参与肺癌、结直肠癌、胃癌、鼻咽癌、前列腺癌、乳腺癌等常见癌症的发生,主要通过促进肿瘤细胞凋亡;抑制肿瘤细胞增殖与分化;抑制肿瘤细胞的侵袭和迁移等生物学效应发挥抑制肿瘤的作用。但是并没有关于miR-34c在口腔癌的功能的报道,我们课题组进行miRNA测序,结果发现miR-34c在口腔黏膜癌组织特异性表达,提示我们miR-34c对于口腔黏膜癌的临床价值,为进一步明确miR-34c在口腔癌中的作用,我们利用脂质体转染调节miR-34c在口腔癌中的表达,探讨miR-34c对口腔癌细胞生物学行为的影响。
1 材料和方法
1.1 实验材料
1.1.1 实验动物
实验选用清洁级雄性8~10周龄的中国地鼠60只,体重25~35 g,由山西医科大学实验动物中心提供[SCXK (晋) 2015-0001]。屏障环境[SYXK (晋) 2015-0001]中饲养,温度为25℃左右,相对湿度40%~70%。动物实验严格按照山西医科大学实验动物管理委员会制定的操作规程(IACUC号:2015011),符合3R原则。
1.1.2 细胞株
体外实验选用人舌鳞癌细胞株Tca8113购自Boster(博士德)。
1.2 主要试剂与仪器
TriPure Isolation Reagent试剂购于Roche;All-in-OneTMmiRNA qRT-PCR Detection Kit,All-in-OneTMqPCR Mix和All-in-OneTMqPCR Primer均购于GeneCopoeia;脂质体RNAiMAX试剂购于Invitrogen;Opti-MEM培养基购于Gibco;miRNA-34c mimics和miRNA-34c inhibitor均由Gene Pharma合成;Express miRNA Extraction试剂盒,HG Taq Man miRNA cDNA Synthesis试剂盒和HG Taq Man miRNA qPCR试剂盒均购自Hai Gene;RPMI 1640培养基购自Hyclone;胰酶、胎牛血清和Cell-Counting Kit-8试剂盒购自Boster;100 U/mL青霉素和100 mg/mL链霉素购自Solarbio。普通PCR仪(美国Bio-Rad公司);Step one plus荧光定量PCR仪(美国ABI公司);酶标仪(美国Bio-Rad公司);CO2细胞培养箱(Sanyo公司);倒置相差显微镜(日本Olympus公司)。
1.3 实验方法
1.3.1 组织miR-34c表达水平的检测
0.5% DMBA丙酮液涂擦中国地鼠双侧颊囊制备口腔黏膜癌模型。本实验选取中国地鼠口腔癌组织和正常组织(保存于-80℃冰箱)进行qPCR验证实验。用TriPure提取中国地鼠口腔癌和正常组织总RNA(各取3只中国地鼠),用分光光度计测定RNA浓度和纯度,A260/A280均在2.0左右。然后按照miRNA qRT-PCR Detection Kit试剂盒说明书逆转录成cDNA,以大鼠5s RNA作参照进行相对定量分析,根据All-in-OneTMqPCR Mix说明书进行。qRT-PCR采用3步法:Stage 1(预变性):95℃,10 min,1个循环;Stage 2(PCR反应)95℃,10 s,60℃,20 s,然后72℃,10 s,40个循环;Stage 3(溶解曲线分析)72℃~95℃,温度间隔0.5℃,10 s/each。结果以2-ΔΔCt法表示miRNA-34c的相对表达量。
1.3.2 细胞的培养
Tca8113于含10%胎牛血清、100 U/mL青霉素和100 mg/mL链霉素的RPMI 1640培养基,37℃、5% CO2的细胞培养箱中培养。
1.3.3 细胞的转染
将细胞接种于培养板,待细胞融和度达到60%~80%按照Lipofectamine RNAiMAX Reagent说明书进行脂质体转染,实验分为miR-34c模拟物组(miR-34c mimics,终浓度为50 nmol/L)、miR-34c抑制物组(miR-34c inhibitor,终浓度为50 nmol/L)和空白对照组(control)。hsa-miR-34c mimics序列为:AAUCACUAACCACACGGCCAGG,UGGCCGUGUGG UUAGUGAUUU;hsa-miR-34c inhibitor序列为:CCUG GCCGUGGUUAGUGAUU。
1.3.4 细胞中miR-34c表达水平的检测
按照Express miRNA Extraction试剂盒说明书提取转染48 h处于生长对数期细胞的miRNA,使用酶标仪测定提取的浓度及纯度(A260/A280)。按照HG Taq Man miRNA cDNA Synthesis试剂盒说明书逆转录成cDNA,采用加A法进行反转录。qRT-PCR按照HG Taq Man miRNA qPCR试剂盒说明书配制反应体系(20 μL体系)。以RNU6B作为内参,采用2步法:Stage 1(Holding stage)95℃,10 s,1个循环;Stage 2(Cycling stage)95℃,10 s,然后60℃,60 s,40个循环。结果以2-ΔΔCt法表示miRNA-34c的相对表达量。
1.3.5 细胞增殖能力的检测
按每孔1.0 × 103的密度将细胞接种于96孔培养板上,每孔加含10%胎牛血清的RPMI 1640培养液100 μL,待细胞贴壁融和度达到60%~80%后,加入转染试剂,按照CCK-8试剂说明书,于加入转染试剂之前和加入转染试剂24 h、48 h、72 h后在酶标仪450 nm波长处检测每孔吸光度(optical density,OD)值,以OD值反映细胞增殖情况。
1.3.6 细胞迁移能力的检测
将生长状态良好的细胞接种于六孔板,待细胞贴壁后加入转染试剂,待细胞生长密度达到90%以上,用200 μL无菌枪头在6孔板内以“1”字形划痕,然后立即用PBS漂洗悬浮细胞,加入RPMI 1640培养基继续培养,分别于划痕后0 h、24 h、48 h和72 h在荧光倒置显微镜下观察细胞愈合情况,用Image Pro Plus 6.0处理图片并记录相对迁移距离。
1.4 统计学方法
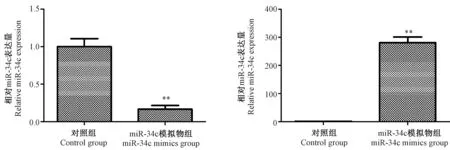
注:与对照组比较,*P< 0.05,**P< 0.01。图2 miR-34c在口腔癌细胞中的表达Note. Compared with the control group,*P< 0.05,**P< 0.01.Figure 2 Expression of miR-34c in the Tca8113 cells
2 结果
2.1 口腔癌中miR-34c的表达
课题组在前期已成功构建中国地鼠口腔颊囊黏膜癌和鳞癌模型,并对口腔黏膜癌组织和正常组织进行高通量测序技术测序及生物信息分析,发现miR-34c在中国地鼠口腔黏膜癌组织中表达显著上调,对其进行qPCR验证,结果表明:与正常组织相比,口腔癌组织中miR-34c表达明显升高,其表达量是正常组的11.95倍。结果见图1所示。
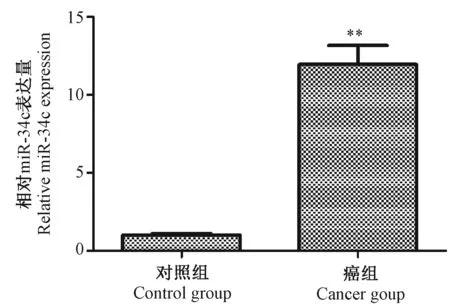
注:与对照组比较,*P< 0.05,**P< 0.01。图1 口腔癌组织中miR-34c表达量Note. Compared with the control group,*P< 0.05,**P< 0.01.Figure 1 Expression of miR-34c in the oral squamous cell carcinoma tissues
2.2 miR-34c转染效率的检测
转染miR-34c inhibitor后,miR-34c表达量是对照组的0.166倍,miR-34c表达量明显下调,差异有显著性(P< 0.01)。转染miR-34c mimics后,miR-34c表达量是对照组的280.917倍,miR-34c表达量明显上调,差异有显著性(P< 0.01)。结果见图2。
2.3 miR-34c对Tca8113细胞增殖能力的影响
72 h的CCK-8实验结果显示,与对照组相比,miR-34c mimics组的增殖能力显著减弱(P<0.01),miR-34c inhibitor组的增殖能力显著增强(P<0.05),说明上调miR-34c表达可抑制细胞增殖,降低细胞活力。结果见图3。
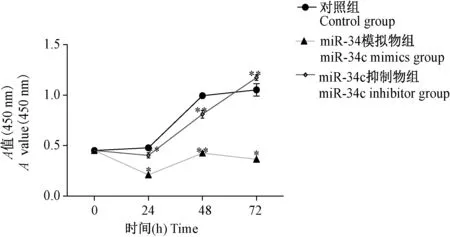
注:与对照组比较,*P< 0.05,**P< 0.01。图3 调节miR-34c表达水平对Tca8113细胞活力的影响Note. Compared with the control group,*P< 0.05,**P< 0.01.Figure 3 Effect of miR-34c on the proliferation of tongue cancer cell line Tca8113 cells
2.4 miR-34c对Tca8113细胞迁移能力的影响
划痕实验显示,随着时间的推移,各组迁移距离都逐渐增加。与对照组72 h迁移扩张距离相比,miR-34c mimics组的迁移能力与对照组差异无显著性,miR-34c inhibitor组的迁移能力显著增强,说明下调miR-34c表达可促进细胞迁移。结果如表1和图4所示。

表1 调节miR-34c表达水平对Tca8113细胞迁移的影响
注:与对照组比较,*P< 0.05,**P< 0.01。
Note. Compared with the control group,*P< 0.05,**P< 0.01.
3 讨论
多种miRNA在口腔癌中异常表达,其与口腔鳞状细胞癌(OSCC)的发生、诊断及预后密切相关[2]。miRNA可作为癌基因或抑癌基因,对肿瘤的生物学行为有重要的调控作用[3 - 5]。miR-34a/375/195/26a/29b等miRNA可通过多种转录因子和靶基因来调控舌鳞癌细胞的增殖、周期、迁移、侵袭和凋亡,并与肿瘤大小、转移、复发以及预后等临床病理特点相关,为舌鳞癌患者的预后判断以及手术和靶向治疗方案提供了参考[6]。
本课题组前期利用高通量测序成功构建中国地鼠口腔癌组织和正常组织差异表达的miRNA表达谱,发现11个表达差异有显著性的miRNA。我们挑选了与肿瘤密切相关的miR-34c,对其进行qPCR验证,结果表明miR-34c在口腔癌组织中表达显著上调[7]。人类miR-34家族包括miR-34a、miR-34b和miR-34c。在正常细胞中miR-34a发挥促进细胞衰老、使细胞周期阻滞在G1期和诱导细胞凋亡等作用[8]。miR-34a也参与乳腺癌、前列腺癌、结肠癌、恶性胶质瘤、胰腺癌和肺癌等多种疾病的发生[9 - 10],Jia等[11]的研究表明miR-34a靶向调控MMP-9和MMP-14,从而抑制舌鳞状癌细胞的转移和侵袭。miR-34a在TSCC淋巴结转移患者的预后和基因治疗中也具有潜在的应用价值。miR-34b和miR-34c也具有潜在的抑癌作用[12]。miR-34c在乳腺癌、前列腺癌、卵巢癌、结肠癌、脑胶质瘤、鼻咽癌、喉癌、胃癌和肺癌等多种肿瘤中表达下调[13]。武震东[14]转染miR-34c-3p mimics和miR-34c-5p mimics于胶质瘤细胞,结果表明miR-34c可抑制胶质瘤细胞增殖、迁移和侵袭,使细胞周期停滞在S期及G2/M期的,诱导细胞凋亡。miR-34家族与p53形成抗肿瘤正反馈环路:p53由于DNA损伤被激活,活化的p53促使miR-34s表达,从而抑制c-myc、E2F3、Cyclin E2、CDK6、MET、BCL-2等相关蛋白,导致细胞凋亡。同样miR-34s也可通过抑制组蛋白去乙酰酶SIRT1,从而促进p53因乙酰化而活化[15]。

注:A:对照组;B:miR-34c模拟物组;C:miR-34c抑制物组。图4 调节miR-34c表达水平对Tca8113细胞迁移的影响(× 40)Note. A: Control group; B: miR-34c mimics group; C: miR-34c inhibitor group.Figure 4 Effect of miR-34c on the migration of tongue cancer cell line Tca8113 cells
为了进一步研究miR-34c在口腔癌中的作用机制,本研究通过体外转染miR-34c mimics和miR-34c inhibitor,探讨miR-34c对口腔癌Tca8113细胞中的生物学行为的影响。于转染48 h后利用qPCR检测转染效率,miR-34c模拟物组和抑制物组miR-34c的表达量较对照组都差异有显著性,提示转染成功。脂质体转染的转染效率高,但也存在会对细胞产生毒性的问题,于转染24 h后CCK-8和划痕实验结果表明,细胞活力和迁移距离都有降低的趋势,转染条件还需进一步优化。我们的实验结果表明,细胞转染72 h后miR-34c对细胞具有抑制增殖和迁移的作用,在高宁[16]、王萌[17]、李甫钥[18]和张金霞[19]的实验中都得到了类似的结论,高表达miR-34c可抑制细胞增殖和迁移,促进细胞凋亡。转染miR-34c在不同细胞中发挥作用的时间不同,武震东[14]的实验结果表明:上调miR-34c 48 h后,可抑制胶质瘤的增殖、迁移和侵袭能力,这可能是由于肿瘤异质性造成的。miR-34c在多种肿瘤中表达下调,提示miR-34c有潜在的抑癌作用,这与我们的实验结果一致,但我们的高通量测序结果表明miR-34c在癌组较正常组高表达,这需要我们进一步明确其机制来作出判断。肿瘤的发生是多基因协同作用的结果[20],miRNA存在个体差异[15],口腔癌的组织学表型和染色体分析的结果表明口腔癌中存在不同表型的肿瘤细胞[21-22]。miR-34c作为口腔癌的标志物投入临床使用仍需进一步的探究和验证。
介于miRNA的特性,通过调控其表达抑制肿瘤是目前肿瘤治疗的新策略。以miRNA为基础的基因治疗进入了一个新的阶段,有很大的应用前景[23]。在miR-34的表达受到抑制或下调的情况下,可通过合成miR-34类似物,增加miR-34的表达;或在miR-34异常表达导致病变时,可利用反义寡核苷酸直接结合miR-34阻断其活性,从而发挥治疗作用[24]。
注:中国地鼠(Cricetulusbarabensisgriseus)是仓鼠科仓鼠亚科动物,在公开出版物中使用仓鼠作为名称更为科学。但鉴于目前我国实验动物国家标准中提到的动物的种类都是地鼠,作为专业人员能够清楚该物种在动物分类中地位,并不妨碍科学研究的成果和使用。中文名称后面的拉丁文不会对该研究的主体产生歧义,故本文在发表时仍沿用“中国地鼠”,待国标修订后再统一命名为“仓鼠”。
