改进型胰胆管支架在全覆膜金属支架治疗良性胆管狭窄中的应用价值*
2018-12-03林美举张诚李婧伊杨玉龙马跃峰
林美举,张诚,李婧伊,杨玉龙,马跃峰
(1.大连大学附属中山医院 胆道微创外科,辽宁 大连 116001;2.同济大学附属东方医院 胆石中心,上海 200120)
良性胆管狭窄(benign biliary stricture,BBS)是由外科手术损伤、慢性胰腺炎、原发性硬化性胆管炎或其他炎症等非肿瘤因素所引起的胆管管腔变窄的一种病理改变,可引起结石、梗阻性黄疸及胆汁淤积性肝硬化等并发症[1]。经内镜逆行胰胆管造影术(endoscopic retrograde cholangiopancreatography,ERCP)置入全覆膜自膨式可回收金属支架(full-covered selfexpanding removable metal stent,FCSERMS)是目前治疗BBS的新手段,与传统塑料支架相比,FCSERMS可以获得更大的扩张直径、更低的堵塞率及更少的内镜操作次数[2-3]。大量的临床研究显示,经ERCP置入FCSERMS治疗肝外BBS的狭窄解除率达到66.0%~90.0%,但是术后胰腺炎的发生率高达8.3%~13.1%,明显高于常规ERCP术后的3.5%[4-6]。经ERCP置入FCSERMS术中预先放置胰管支架可以降低术后胰腺炎和高淀粉酶血症等并发症的发生率。但是,胰管支架的长期留置可发生支架堵塞,进而诱发慢性胰腺炎、胰管结石及胰腺脓毒症等并发症[7]。为了控制胰管支架的排出时间,对常规鼻胆引流管及胰管支架进行了改进,其胰管支架可随鼻胆管一起拔除,无需二次内镜操作[8]。本研究回顾性分析了2012年1月-2017年12月采取ERCP置入FCSERMS治疗的59例BBS患者的临床资料,旨在探讨改进型胰管支架在FCSERMS治疗BBS围手术期中的应用价值。
1 资料与方法
1.1 一般资料
选取2012年1月-2017年12月ERCP置入FCSERMS治疗的BBS患者共59例。其中,男24例,女35例,年龄18~75岁,平均53.8岁。按照放置胰管支架类型的不同分为改进型胰胆管支架组(试验组)及单猪尾胰管支架组(对照组),支架类型由患者选择,其中试验组23例,对照组36例,两组患者基线资料差异无统计学意义(P>0.05),具有可比性,见表1。本研究经大连大学附属中山医院伦理委员会批准,所有患者术前均签署手术同意书。
纳入标准:①BBS诊断明确;②年龄>18岁;③接受ERCP置入FCSERMS治疗;④放置胰管支架;⑤资料完整。
排除标准:①急、慢性胰腺炎病史;②合并肝内胆管结石或狭窄;③胆囊结石;④不能除外恶性胆管狭窄;⑤胆道探查及乳头球囊扩张或探条扩张手术病史;⑥既往行ERCP治疗;⑦副乳头括约肌切开。
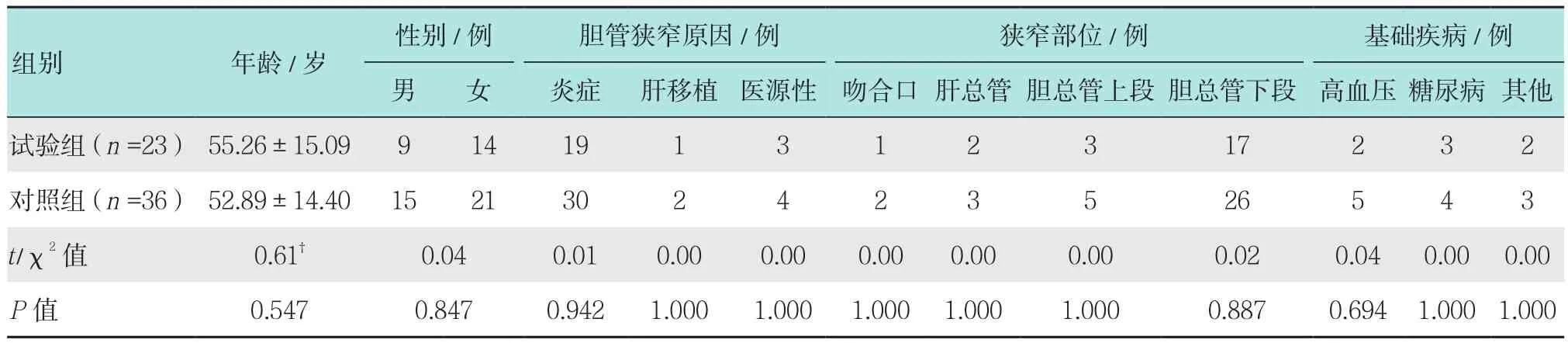
表1 两组患者一般资料比较Table 1 Comparison of general information between the two groups
1.2 胰管支架放置标准
具有以下两个或两个以上因素:年轻女性、超氧化物歧化酶(superoxide orgotein dismutase,SOD)、胆红素正常、困难插管(定义为经常规导丝引导插管反复进入胰管≥5次或选择性插管10 min未成功进入胆管)、乳头括约肌预切开、乳头括约肌切开(endoscopic sphincterotomy,EST)、胰管括约肌切开(endoscopic pancreatic sphincterotomy,EPS)、乳头括约肌球囊扩张(endoscopic papillary balloon dilatation,EPBD)、胰管造影、腔内超声检查、Oddi括约肌测压、学员参与关键操作的ERCP[8]。乳头长度小于1 cm或进行乳头注射止血的患者常规放置胰管支架。
1.3 仪器与设备
电子十二指肠镜TJF-260vs(日本Olympus);导丝、球囊扩张导管、鼻胆引流管、WallFlex全覆膜金属支架(美国Boston);乳头括约肌切开刀、造影导管、取石球囊、取石网篮、圈套器、异物钳、单猪尾及直型胰管支架(德国Endo-Flex)。
1.4 治疗方法
1.4.1 改进型胰胆管支架的制作 将鼻胆管以及减去尾翼的直型胰管支架用缝合线连接而成(国内发明专利:ZL201510238034.9、ZL201510242219.7、ZL201510236031.1和 ZL201510236020.3)。
1.4.2 ERCP治疗及胰管支架放置 术前准备及麻醉方式同常规。对照组ERCP操作如下:①符合胰管支架置入标准者,先行EPS后置入胰管支架,胰管支架长度及直径根据胰管走向、形状及直径确定;②胆管插管、造影,确定狭窄的部位及长度;③EST联合EPBD后,取净肝外胆管结石;④越过狭窄放置FCSERMS,支架近端位于胆管狭窄段上至少2 cm,保留支架远端位于十二指肠乳头外,最后行内镜下鼻胆管引流术(endoscopic naso biliary drainage,ENBD)。试验组ERCP操作如下:①符合胰管支架置入标准者,先行胰管插管并留置斑马导丝;②胆管插管、造影,确定狭窄的部位及长度;③EST联合EPBD后,取净肝外胆管结石;④越过狭窄放置FCSERMS,支架近端位于胆管狭窄段上至少2 cm,保留支架远端位于十二指肠乳头外;⑤在胰管内导丝的引导下置入改进型胰胆管支架,胰管支架放置后,经鼻胆管插入导丝行胆管插管,在导丝引导下置入鼻胆管[9]。
1.4.3 术后处理 术后继续禁食水并予以对症支持治疗,观察体温和腹痛情况。腹痛加重者术后6 h复查血常规、血气、淀粉酶/脂肪酶和肝功能等生化指标,出现急性胰腺炎者使用生长抑素治疗;腹痛无加重者次日晨复查血液生化指标。淀粉酶/脂肪酶升高者,术后3 d复查血液生化指标,病情稳定者,术后1周行鼻胆管造影,造影剂排泄顺畅者在导丝辅助下拔除鼻胆管及改进型胰胆管支架,次日复查血液生化指标。
1.4.4 FCSERMS及胰管支架取出 十二指肠镜进入十二指肠降段,圈套器套取胰管支架尾端后经钳道取出,活检钳咬住回收环并退出十二指肠镜取出FCSERMS,再次进入十二指肠镜放置鼻胆引流管[10]。
1.5 观察指标
记录放置及取出FCSERMS术后急性胰腺炎(acute pancreatitis,AP)、高淀粉酶血症(hyperamylasemia,HP)、一般淀粉酶升高(general amylase elevation,GAE)、出血和穿孔等并发症的发生率。
1.6 诊断标准
选择术后6 h及次日晨淀粉酶和脂肪酶的最高值作为诊断指标。
1.6.1 AP诊断标准 ①与AP符合的腹痛(急性、突发、持续、剧烈的上腹部疼痛,向后背部放射);②血清淀粉酶和(或)脂肪酶至少大于3倍正常上限值;③增强CT或磁共振成像(magnetic resonance imaging,MRI)或腹部超声呈AP影像学改变。ERCP术后发生上述3项特征中的2项即可诊断为AP,同时 ERCP术后胰腺炎(post-ERCP pancreatitis,PEP)分为轻、中和重3个等级[11]。
1.6.2 HP诊断标准 ①血清淀粉酶和(或)脂肪酶至少大于3倍正常上限值;②无胰腺炎临床表现。
1.6.3 GAE诊断标准 ①血清淀粉酶和(或)脂肪酶大于正常上限值,小于3倍正常上限值;②无胰腺炎临床表现。
1.7 统计学方法
所有数据采用SPSS 21.0软件包进行分析。计数资料用直接计数法计算,采用χ2检验比较。计量资料以均数±标准差(±s)表示,各组间数据的比较依据资料的性质,采用t检验或方差分析。以P<0.05为差异具有统计学意义。
2 结果
2.1 胆管狭窄的患者置入金属支架及胰管支架围手术期并发症情况
59例患者均成功放置FCSERMS、鼻胆管、胰管支架或改进型胰胆管支架,术中未发生出血和穿孔等并发症。两组术后均无AP发生,HP及GAE的发生率差异均无统计学意义(4.3% vs 5.6%,P=0.516;26.1% vs 22.2%,P=0.508)。见表 2。
2.2 两组留置金属支架期间并发症情况
FCSERMS留置7~12个月,平均(7.88±1.29)个月,两组FCSERMS及胰管支架无移位,两组均无AP发生,试验组HP及GAE的发生率低于对照组,但两组比较GAE的发生率差异有统计学意义(0.0%vs 2.7%,P=0.246;0.0% vs 8.3%,P=0.007)。见表3。
2.3 两组金属支架及胰管取出后并发症情况
59例FCSERMS及36例胰管支架均成功取出,未发生出血、肠穿孔、AP和HP等并发症,对照组取出的胰管支架均显示有蛋白栓堵塞。两组术后GAE的发生率差异无统计学意义(13.0% vs 8.3%,P=0.249)。
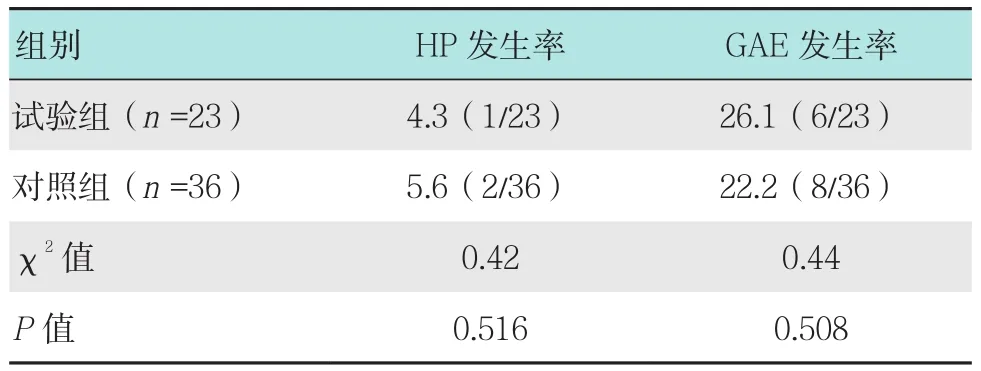
表2 两组FCSERMS置入术后胰腺损伤情况比较 %Table 2 Comparison of pancreatic injury between the two groups after FCSERMS implantation %
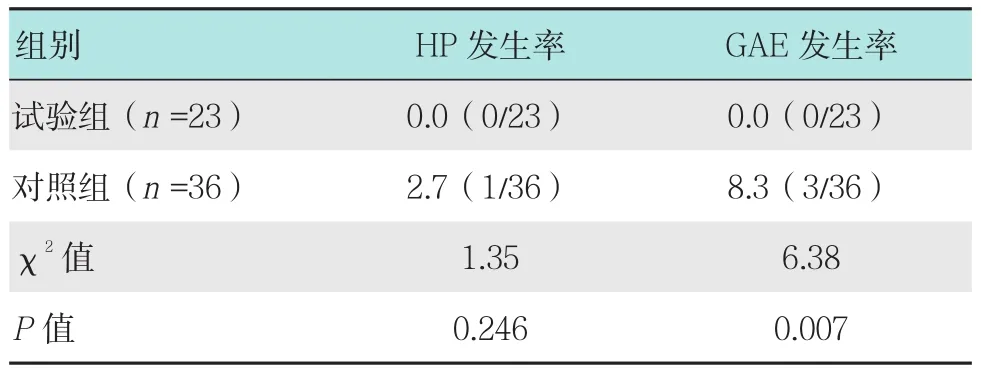
表3 两组FCSERMS留置期间胰腺损伤情况比较 %Table 3 Comparison of pancreatic injury between the two groups during FCSERMS implantation %
3 讨论
PEP是采取十二指肠镜技术治疗肝胆胰疾病术后四大并发症之一,由于PEP发生率相对较高且危害程度重而受到广泛关注。PEP危险因素按照其来源不同,可分为患者因素及操作因素;按照胰腺损伤性质的不同,可分为机械性损伤、化学性损伤、热损伤、流体静力损伤、细菌感染及过敏性损伤等[11]。无论是何种来源或损伤,PEP发生的基础均与胰液排泄不畅所形成的胰管高压相关[12-13]。近期的临床研究显示,留置FCSERMS治疗BBS术后AP发生率为13.2%,明显高于常规ERCP取石术后的2.5%,除了上述损伤外,FCSERMS压迫胰管括约肌是其主要原因[6,14]。
目前预防PEP的药物包括非甾体类抗炎药及胰酶抑制剂,其代表药物为吲哚美辛、生长抑素、乌司他丁和加贝酯等[15]。大量临床研究显示,胰管支架不仅能降低PEP的发生率,而且能降低PEP的严重程度,其临床效果优于非甾体类抗炎药[16]。此外,放置鼻胆引流管也具有预防PEP的作用[17]。其作用机制是:能通畅引流、降低胰管压力和减轻炎症反应。因此,预防FCSERMS术后胰腺损伤的关键是保持胰液引流通畅来降低胰管高压,抑制胰酶激活,减轻炎症反应,从而阻止胰腺炎的发生和发展。本研究结果显示,放置FCSERMS前置入胰管支架,术后无胰腺炎发生,明显低于不放置胰管支架的13.2%,说明FCSERMS治疗BBS术中放置胰管支架可以降低术后PEP的发生率[6]。
既往的临床研究显示,5Fr/5~7cm的塑料胰管支架对预防术后胰腺炎术是安全和有效的,尤其是高危患者[7]。本研究也得出了相似的结论,但是一般淀粉酶升高率却高达22.1%~26.1%,说明放置胰管支架也会引起胰腺的损伤。与胰管支架置入前的胰管插管、胰管括约肌切开及胰管造影相比,此种损伤往往难以避免。但是该损伤程度较轻,患者一般无临床症状或体征,经药物保守治疗可恢复正常。因此,采取胰管支架预防FCSERMS治疗BBS术后胰腺炎也是安全和有效的。但是,有临床研究显示,大多数的胰管支架在置入术后1个月即发生堵塞[18],建议在术后1或2周取出支架,以避免支架堵塞及移位所致的相关并发症[19]。本研究显示,胰管支架留置7~12个月,取出的胰管支架管腔均提示蛋白栓堵塞,后期持续性HP及GAE的发生率高达2.7%及8.3%,堵塞的胰管支架甚至有诱发AP和胰管结石等严重胰腺损伤的可能。而术后1周取出胰管支架后观察,FCSERMS留置期间并无AP、HP及GAE等胰腺损伤病例,说明采取FCSERMS治疗BBS术后1周拔除胰管支架是安全的。
常规使用的胰管支架远端及近端移位概率分别为7.5%和5.2%,胰管支架早期脱出则失去了预防PEP的作用,而且内移位的支架取出较困难,反而增加了发生AP等胰管损伤并发症的风险[20-21]。5Fr单猪尾胰管支架自行脱出概率高达96.6%,平均脱出时间为2.4 d[16]。本研究显示,FCSERMS留置期间无胰管支架移位发生,可能与FCSERMS对胰管支架的挤压相关。但是未移位胰管支架仍需二次内镜取出。内镜下取出胰管支架后,使用活检钳或圈套器取出FCSERMS,术后有发生胆漏的风险,随着FCSERMS留置时间的延长,其取出难度也随之增加[22-23]。本研究中使用的改进型胰胆管支架,在拔除鼻胆管的同时取出胰管支架,无需二次内镜操作,避免了胰管支架排出过程中可能发生的肠激惹、穿孔和梗阻等并发症。术后所有FCSERMS均顺利取出,未发生重大并发症。但是,试验组及对照组有13.0%和8.3%的患者出现了一般性淀粉酶升高,两者差异无统计学意义,说明:无论胰管支架存在与否,FCSERMS支架取出术中均可引起轻度的胰腺损伤,此种胰腺损伤可能与金属网及支架表面附着的胆泥或结石刺激乳头黏膜相关,导致十二指肠乳头水肿,引起胰液排泄不畅及胰管高压,该损伤一般较轻,可自行恢复。
综上所述,ERCP置入胰管支架可以预防FCSERMS治疗BBS的术后胰腺炎,早期取出用于预防FCSERMS治疗BBS术后胰腺炎的胰管支架是安全的,可以避免支架堵塞引起的胰腺损伤,其临床效果优于单猪尾胰管支架。
