扩散峰度成像在WHO Ⅱ级脑胶质瘤IDH基因分型的预测研究
2018-12-01武文杰张辉王效春谭艳秦江波杨国强
武文杰,张辉,王效春,谭艳,秦江波,杨国强
脑胶质瘤是颅内中枢神经系统(central nervous system,CNS)最常见的肿瘤,既往根据肿瘤组织学特征分为Ⅰ~Ⅳ级。随着研究的不断深入,过去10多年间发现组织学类型相同的脑胶质瘤存在不同基因遗传特性,例如异柠檬酸脱氢酶(isocitrate dehydrogenase,IDH)突变、染色体1P/19q共缺失、O6-甲基鸟嘌呤-DNA-甲基转移酶启动子甲基化等[1]。2016版WHO中枢神经系统在传统组织学基础上增加了基因分型,其中最主要是IDH基因分型[2]。目前国内外诸多学者研究表明IDH基因分型对于胶质瘤患者预后具有重要意义[3],因此,术前无创性预测IDH基因分型具有重要的临床意义。
扩散峰度成像(diffusion kurtosis imaging,DKI)是基于非高斯分布模型的磁共振技术,是扩散张量成像(diffusion tensor imaging,DTI)技术的延伸。Tan等[4]研究表明DTI成像为评估WHOⅡ~Ⅲ级星形细胞瘤的IDH1基因状态提供了可靠的影像学手段,相较于DTI成像,DKI可以定量描述细胞内外水分子扩散的非高斯分布,量化病变组织微观结构改变。其中平均扩散峰度(mean kurtosis,MK)代表空间各梯度方向的扩散峰度平均值,反映组织结构的复杂程度[5]。因此,DKI成像能够从功能微观层面反映脑胶质瘤的异质性,为术前无创性评估IDH基因分型提供新的技术手段。
1 材料与方法
1.1 临床资料
回顾性分析2013年1月至2016年10月我院25例WHO II级脑胶质瘤患者的临床、影像资料,男10例,女15例,年龄21~71岁,平均年龄(46.32±13.19)岁。25例患者术前行常规MRI及DKI扫描检查,检查前未接受药物、化疗、放射治疗等干预措施。术后将组织蜡块送至北京泰普舜康医学检验所进行Sanger(双脱氧末端终止法)测序得到IDH基因分型。
1.2 数据采集
使用GE 3.0 T超导磁共振扫描仪,采用8通道头颈联合拓扑相控阵线圈采集信息,常规MRI扫描序列包括轴位T1WI、T2WI、T2 FLAIR,矢状位T1WI,T1WI增强扫描轴位、矢状位、冠状位。常规MR序列参数:轴位T1WI (TR 1677 ms,TE 25 ms,层厚6.0 mm),矢状位T1WI(TR 1710 ms,TE 24.5 ms,层厚6.0 mm),轴位T2WI (TR 6480 ms,TE 111 ms,层厚6.0 mm),T2WI FLAIR (TR 8000 ms,TE 125 ms,层厚6.0 mm),增强序列(TR 1500 ms,TE 14 ms,层厚6.0 mm),增强药物使用钆喷替酸葡甲胺(0.1 mmol/kg)。DKI采用平面回波序列,扫描参数:TR 23000 ms,TE 108 ms,FOV 24 cm×24 cm,层厚 6 mm,层间隔 0 mm,30个扩散敏感梯度场,取6个b值分别为0、500、1000、1500、2000、2500 s/mm2。
1.3 图像后处理及参数测量
在GE Advantage Workstation 4.4工作站通过Functool软件处理后获得DKI参数图(图1),结合MR常规序列,在肿瘤实质区、瘤周水肿区、同层面对侧正常脑白质区设置椭圆形感兴趣区(region of interest,ROI),测定每个ROI的各项异性分数(fractional anisotropy,FA)、平均扩散系数(mean diffusivity,MD)、MK、轴向扩散峰度(axial kurtosis,Ka)、径向扩散峰度(radial kurtosis,Kr)值。肿瘤实质区ROI选取需结合增强扫描,若肿瘤强化选取肿瘤强化区域,同时避开囊变、坏死、出血等;若肿瘤不强化,实质区信号不均匀,则选取肿瘤实质部分表观扩散系数(apparent diffusion coefficient,ADC)图信号最低区为ROI;瘤周水肿区ROI选取近肿瘤实质区,去除瘤体和正常脑组织成分。选取的ROI为圆形或椭圆形,每个ROI至少包括30个像素,每个ROI重复测量3次取平均值。为排除大脑内不同区域参数差异影响,将所得DKI参数除以对侧正常脑白质区得到相对扩散各项异性分数(ratio of FA,rFA)、相对平均扩散系数(ratio of MD,rMD)、相对平均扩散峰度(ratio of MK,rMK)、相对轴向扩散峰度(ratio of Ka,rKa)、相对径向扩散峰度(ratio of Kr,rKr)值。
1.4 统计学分析
2 结果
2.1 患者临床资料比较
25例胶质瘤患者中,IDH野生型9例(男4例,女5例),IDH突变型16例(男6例,女10例)。两组病例之间性别差异无统计学意义(P=0.53);IDH野生型患者平均年龄为(55.33±12.09)岁,IDH突变型患者平均年龄为(41.25±11.15)岁,两者年龄差异具有统计学意义(P<0.01),ROC曲线下面积为0.82,当截断点取57.5时,其敏感性为66.7%,特异度为93.7%。
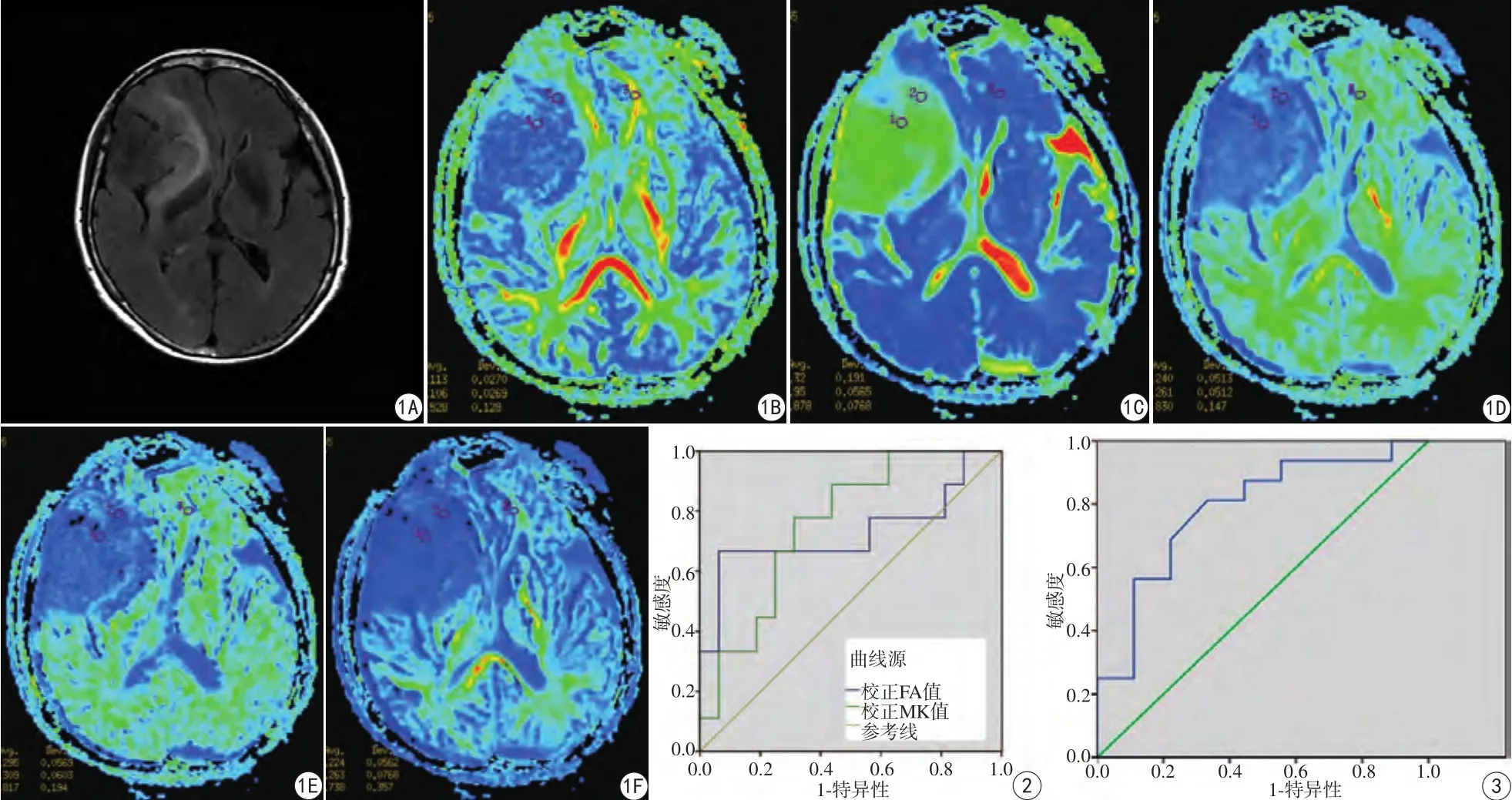
图1 女,59岁,WHO Ⅱ级星型细胞瘤。A:IDH突变型,右侧额颞岛叶异常未强化信号影;B~F:分别对应同层面的FA图、MD图、MK图、Ka图、Kr图 图2 瘤体rFA、rMK值的ROC曲线 图3 瘤体rMD值的ROC曲线Fig. 1 Female, 59 years old, WHO Ⅱ grade astrocytoma. A: IDH-mutant type, and abnormal unreinforced signal in the right frontotemporal island lobe; B—F: Respectively correspond to FA, MD, MK, Ka, Kr. Fig.2 ROC curve of the tumoral solid portion rFA and rMK. Fig.3 ROC curve of the tumoral solid portion rMD
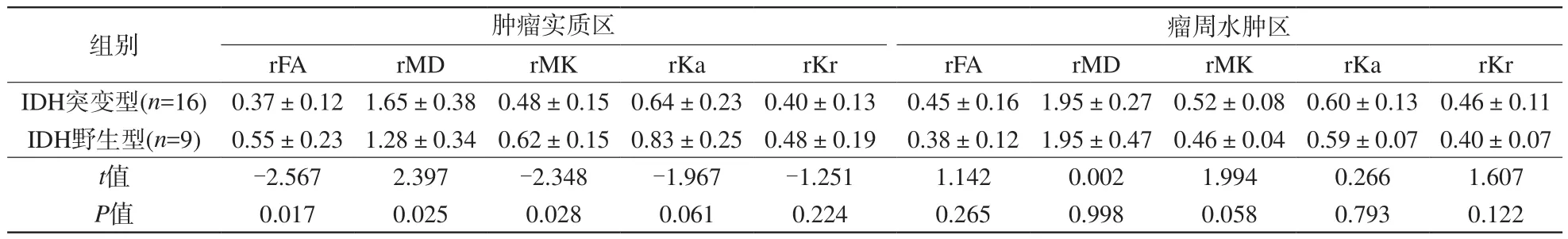
表1 不同IDH基因分型的WHO Ⅱ级脑胶质瘤DKI参数比较Tab. 1 Comparison of the DKI parameters in WHO Ⅱ brain glioma with different IDH genotypes
2.2 DKI参数比较
IDH野生型肿瘤实质区rFA、rMK值均高于IDH突变型,rMD值低于IDH突变型,且两者之间差异具有统计学意义(P<0.05);两组瘤周水肿各参数值差异无统计学意义。详见表1。
瘤体rMK值ROC曲线下面积为75.7%,当截点取0.515时,敏感性为77.8%,特异性为68.7%;瘤体rFA值ROC曲线下面积为72.9%,当截点取0.527时,敏感性为66.7%,特异性为93.7%(图2);瘤体rMD值ROC曲线下面积为75.7%,当截点取1.261时,敏感性为87.5%,特异性为66.7%(图3)。
3 讨论
3.1 临床资料分析
本研究中WHO Ⅱ级胶质瘤IDH基因突变率为64%,这与王国良等[6]报道的WHO Ⅱ级弥漫性星形细胞瘤、少突胶质瘤、少突星形细胞瘤突变率在66.7%以上符合。Metellus等[7]研究报告WHO Ⅱ级IDH突变型脑胶质瘤患者平均年龄为(38.8±11.1)岁,IDH野生型患者平均年龄为(53.9±17.5)岁,本组病例分别为(41.25±11.15)岁、(55.33±12.09)岁,年龄相差不大。由此得出WHO Ⅱ级脑胶质瘤IDH突变型发病年龄普遍低于IDH野生型,且IDH基因突变在WHO Ⅱ级脑胶质瘤中较为普遍,突变率在64%以上。
3.2 脑胶质瘤DKI参数分析
IDH基因分型是判断脑胶质瘤患者生存预后的重要因素,目前临床多应用常规MRI成像检查,通过各种影像征象进行判断。虽然国内外专家研究表明常规MRI与IDH基因具有一定的关联[8-9],但由于各种影像征象难以量化,易受诊断医师经验判断等因素影响,所以常规MRI检查应用价值有限。在人体脑胶质瘤微环境中,水的扩散运动不仅会受到细胞膜屏障、细胞内外间隙等因素影响,同时还会受肿瘤组织病理生理改变,例如瘤细胞密度、细胞异型性、细胞核多形型、新生血管形成等,使水分子运动呈非高斯分布。DKI是依据生物组织内水分子运动呈非高斯分布扩散,通过非高斯分布模型呈现组织器官微观结构改变。DKI成像可以得到多个参数值,其中MK值代表空间各梯度方向的扩散峰度平均值[10],定量描述细胞内外水分子扩散的非高斯分布,其大小取决于ROI内组织结构的复杂程度,结构越复杂,MK值就越大[11-12]。因此,DKI较传统常规MRI成像更能反映组织微观结构改变。
本研究结果显示,校正后WHO Ⅱ级IDH野生型与突变型瘤周水肿的rFA、rMD、rMK、rKa和rKr值差异均无统计学意义,其结果与Tan等[4]通过DTI成像技术研究WHO Ⅱ级IDH1野生型与突变型瘤周水肿区域rFA值结果一致。表明无论是IDH野生型还是突变型,WHO Ⅱ级脑胶质瘤对周围正常脑组织病理改变无明显差异。
IDH野生型与突变型肿瘤实质区的研究显示,IDH野生型肿瘤实质区rMK、rFA值大于IDH突变型,rMD值小于IDH突变型,差异具有统计学意义,并且在以上指标中,rMK值具有最大ROC曲线下面积。以上结果推测IDH突变型脑胶质瘤微观结构相对更为复杂,细胞核异型性大、细胞密度大、肿瘤新生血管丰富等,这些微观结构的改变导致水分子运动偏移高斯分布位移更大。Xing等[13]通过扩散加权成像与动态磁敏感灌注加权成像(dynamic susceptibility contrast-perfusion weighterd imaging,DSC-PWI)研究发现,IDH突变型WHO Ⅱ、Ⅲ级星形细胞瘤瘤体的最大相对脑血容量(relative cerebral blood volume,rCBV)值明显低于IDH野生型,而最小ADC值明显高于IDH野生型。最小ADC值的区域反映了肿瘤中细胞密度最高的部位[14],而最大rCBV值则反映了肿瘤组织内血管生成情况。这种相关性提示IDH野生型胶质瘤细胞密度较IDH突变型大,血管生成丰富,这可能与IDH突变引起2-羟基戊二酸(2-Hydroxyglutaric acid,2-HG)的积累,导致低氧诱导因子1-a活化和抑制血管源相关信号相关[15]。以上结果说明不同IDH基因类型的WHO Ⅱ级脑胶质瘤其肿瘤内部组织结构复杂程度不同。通过DKI成像参数rMK值可以预测WHO Ⅱ级脑胶质瘤IDH基因状态,从而判断患者生存的预后情况。
WHO Ⅱ级IDH野生型瘤体rFA值大于IDH突变型,与Tan等[4]通过DTI成像研究脑胶质瘤IDH1基因分型结论一致。Beppu等[16]对31例星形细胞瘤行DTI成像测量FA值,并通过CT定向活检将FA值与肿瘤组织的细胞构成和血供进行比较,认为肿瘤组织的FA值与细胞构成和血管分布呈正相关。进一步证实WHO Ⅱ级IDH野生型较IDH突变型血管分布多,细胞构成复杂。同时,本研究发现IDH突变型瘤体rMD值明显大于IDH野生型,MD值是反映扩散运动的快慢程度,代表分子的整体扩散水平和存在的全部障碍,MD值越小代表扩散运动越慢,障碍越大,IDH野生型MD值小于IDH突变型,说明IDH野生型瘤体分子扩散运动慢,障碍大,瘤体组织微观结构更为复杂,细胞密度大、间隙小。
本研究尚存在一些不足之处。首先,研究病例数相对较少,并且单独将WHO Ⅱ级脑胶质瘤进行分析,未将其他级别脑胶质瘤纳入研究范围,缺乏整体认识;其次,研究过程中涉及诸多参数值测量易受到测量者经验判断影响。或许单独通过DKI成像探索IDH基因分型稍显不足,还需要进一步综合利用DSC-PWI[17]等磁共振成像技术甚至是影像组学分析来探索术前无创性预测胶质瘤的IDH基因分型。
综上所述,DKI成像参数rMK、rFA、rMD值有助于WHO Ⅱ级脑胶质瘤的IDH基因分型判断,其中rMK与rMD的敏感性及特异性均较高。DKI作为一种新型的磁共振功能成像,能够提供病变组织微观结构改变,为术前无创性判断WHO Ⅱ级脑胶质瘤IDH基因分型提供了更多影像学信息。