1株产生洛伐他汀杂色曲霉的筛选、鉴定和发酵优化条件
2018-11-30许楚旋王嘉琦蒋冬花
许楚旋 王嘉琦 蒋冬花
(浙江师范大学化学与生命科学学院,金华 321004)
曲霉(Aspergillus spergillus)是最常见且具有重要应用价值的丝状真菌,在自然界的空气、土壤、水以及作物上都可以发现其存在,目前已广泛地应用在传统酿造业、生物工程研究和现代发酵等。杂色曲霉(A. versicolor)是世界性广泛分布种,也是我国最常见的曲霉之一。杂色曲霉(A. versicolor)作为曲霉属的一种,能产生多种有用的活性代谢产物,分别具有抗病[1]、抗虫[1]、抗病毒[2]、抗肿瘤[3]、抗氧化[4]、细胞免疫[5]和抗炎症[6]等多种生物活性。罗寒等[1]从分离自红树林植物内生真菌的杂色曲霉MA-229的发酵产物中得到9个化合物,分别对小麦全蚀病菌和小麦赤霉病菌有较好的抑制活性,并且还有抗虫活性;Yan等[4]从深海中分离到1株杂色曲霉,可产生具有抗氧化活性的胞外多糖体;巩婷等[6]从海洋真菌杂色曲霉F62中分离得到6个丁内酯类活性化合物,均表现出较强的抗炎活性。众多文献表明杂色曲霉(A. versicolor)生物活性物质非常丰富。
1980年,Alberts等[7]从 土 曲 霉(A. terreus)中提取到称为洛伐他汀(Lovastatin)的化合物。Lovastatin是降血脂的他汀类药物,主要作用机理是该分子酸式结构与羟甲基戊二酸辅酶A(HMG-CoA)相似,而HMG-CoA还原酶是合成胆固醇的限速酶,Lovastatin能选择性的与该限速酶结合,起到竞争性抑制作用,从而阻断胆固醇的合成来降低心血管疾病的病发[8-9]。目前,Lovastatin在食品和药品工业中已被广泛应用。微生物发酵工业中,影响产量的两个关键因素是生产菌种和发酵条件。因此,选育稳定高产Lovastatin的曲霉新菌种对并其发酵工艺进行优化,可为Lovastatin工业化生产提供理论依据。
1 材料与方法
1.1 材料
1.1.1 曲霉属菌株 从不同生境(食品、土壤、有机质等)收集的自然发酵样品,经分离筛选得到曲霉属纯菌株。
1.1.2 培养基 (1) PDA培养基(g/L):马铃薯200、葡萄糖20、琼脂15、水、pH 5.5;用于曲霉菌株的分离纯化和鉴定。(2)PD培养液(g/L):马铃薯200、葡萄糖20、水、pH 5.5;用于高产Lovastatin曲霉菌株的筛选和种子培养。(3)发酵培养液(g/L):马铃薯200、葡萄糖20、牛肉膏5、水、pH 5.5;用于高产Lovastatin菌株的发酵培养。(4)碳源筛选基础培养基(g/L):牛肉膏5、NaCl 2、KH2PO41、MgSO4·7 H2O 1、水、pH 5.5 ;用于碳源筛选。(5)氮源筛选基础培养基(g/L):乳糖20、NaCl 2、KH2PO41、MgSO4·7 H2O 1、水、pH 5.5;用于氮源筛选。
1.2 方法
1.2.1 曲霉菌株的分离纯化 从不同生境收集的样品表面挑取少量菌丝接入PDA平板,28℃培养24 h,白色绒毛状菌丝长出后,取少许顶端菌丝转接于另一PDA平板上培养3 d,显微镜观察,挑取具有曲霉的典型特征少许顶端菌丝纯化3次,得性状均一的曲霉纯菌株。编号保存于25%甘油中,4℃备用。
1.2.2 产生洛伐他汀曲霉菌株的筛选
1.2.2.1 曲霉属各菌株的培养 保存的菌株在PDA平板上28℃活化培养3 d后,取1菌饼(直径8mm)接种于PD培养液中,28℃、180 r/min摇床培养2 d,制得种子液;按8%转接到发酵培养液中,28℃、180 r/min培养7 d,发酵液用于检测Lovastatin的产量,筛选高产曲霉菌株。
1.2.2.2 薄层层析法(Thin-layer chromatography,TLC)初筛 发酵液超声破壁30 min,取1.5 mL于离心管中,8 000 r/min离心10 min,取上清液500 μL加100 μL乙酸乙酯振荡萃取取上层液为待测样品,毛细吸管吸取1/4管样品点5次于硅胶板上;Lovastatin标准品为对照,乙酸乙酯作展开剂,展开至15 cm,晾干,紫外灯(波长254 nm)观察斑点并拍照。
1.2.2.3 高效液相法(High performance liquid chromatography,HPLC)复筛 取发酵液0.4 mL于2 mL离心管中,加入1.6 mL的甲醇,25 Hz超声波30 min,50℃水浴2 h,间歇振荡3-4次,8 000 r/min离心10 min,取上清液用0.45 µm有机膜过滤到另一2 mL离心管中,HPLC法测定滤液中的Lovastatin含量。HPLC检测的色谱条件:Agilent 5 TC-C18(250×4.6 mm)液相色谱柱;乙腈为色谱纯,磷酸为优级纯,水为超纯水,检测波长λ = 237 nm,柱温28℃,流速1 mL/min,进样量20 μL。Lovastatin标准曲线的绘制参照文献[10]。
1.2.3 目标菌株的鉴定 目标菌株在PDA平板上28℃培养7 d,显微镜观察其菌丝、分生孢子头、分生孢子梗、顶囊、分生孢子等的形态特征。提取目标菌株的基因组DNA,扩增rDNA ITS基因序列,送上海生物工程公司测序。根据形态特征和rDNA ITS基因序列,参考曲霉属《The GenusAspergillus》分种检索表确定所目标菌株属种。
1.2.4 培养基配方及摇瓶发酵条件优化 用单因素实验优化培养基配方(碳源种类、氮源种类、碳源含量、氮源含量、碳氮比C/N)和发酵条件(温度、初始pH、摇床转速、接种量),实验设3次平行重复。数据用SPSS软件数据统计,Dunan’s多重检验进行均值比较,显著性水平设为P≤0.05。
2 结果
2.1 不同生境分离纯化曲霉菌株的形态特征
经分离纯化获得86株曲霉纯菌株。不同曲霉菌株的菌落形态有较大差异(图1);分生孢子头、分生孢子梗、顶囊、分生孢子等显微形态特征也各不相同(图2),表明来源于不同生境的曲霉菌株具有丰富的多样性。
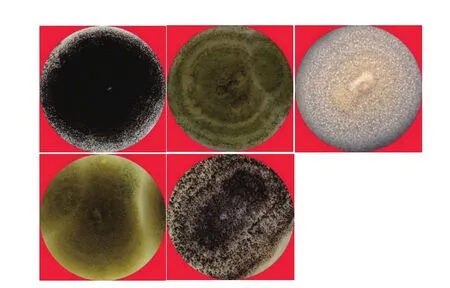
图1 5株代表性曲霉菌株的菌落形态

图2 5株代表性曲霉菌株的分生孢子头显微形态
2.2 产生Lovastatin曲霉菌株TLC法初筛结果
通过TLC法初步筛选得到36株产Lovastatin的曲霉菌株。如图3所示,不同曲霉菌株产生Lovastatin产量不同,有些菌株发酵液与标准品相同位置条带明显,表明该菌株产生Lovastatin含量较高;有些菌株在该位置条带不明显或没有,表明该菌株产生Lovastatin能力较弱或不产生。选取Lovastatin条带较明显的菌株进行HPLC法定量检测复筛。

图3 Lovastatin标准品和曲霉菌株发酵液TLC法初筛结果
2.3 产生Lovastatin曲霉菌株的HPLC法复筛结果
用HPLC法复筛结果(图4)表明不同曲霉菌株Lovastatin产量存在显著差异。Lovastatin产量大部分分布在10-25 μg/mL之间(34株),25-58 μg/mL范围内有2株曲霉菌株。经进一步筛选确证8号曲霉菌株Lovastatin产量最高,为58 μg/mL,并将其编号为A-8。

图4 Lovastatin标准品和8号曲霉发酵液HPLC检测结果
2.4 A-8曲霉菌株的鉴定结果
2.4.1 菌落形态和显微形态 PDA培养基上的菌落初期为白色绒毛状或絮状,后变成灰绿色,边缘白色,7 d菌落直径可达50 mm;显微镜观察菌丝光滑,有隔膜,分支状;分生孢子头初为球形,后呈放射形,顶囊呈半椭圆形至半球形;上半部或3/4部位着生小梗,小梗双层,分生孢子呈淡绿色,球形或近球形,粗糙,直径(4-5)μm×(4-4.5)μm(图5)。

图5 Av-8曲霉菌株PDA上培养7 d菌落(A)、分生孢子头(B、C)和分生孢子(D)
2.4.2 rDNA ITS基因序列 A-8曲霉菌株ITS基因序列如图6,长度为545 bp;系统发育树(图7)分析表明:与杂色曲霉亲缘关系最近,达99%。根据A-8曲霉菌株的菌落和显微形态特征和rDNA ITS基因序列,结合曲霉属分种检索表,鉴定8号菌株为杂色曲霉。
2.5 发酵条件的优化
发酵条件的优化结果见表1。在24-34℃温度范围内,最适发酵温度为28℃;在最适温度的基础上,初始pH以 5.2最为适宜;在适宜温度和初始pH的基础上,摇床转速以180 r/min为宜;在适宜的培养温度、pH和摇床转速的基础上,接种量以10%为宜。
2.6 培养基配方的优化
2.6.1 碳源和氮源种类的筛选 碳源和氮源种类的筛选结果见表2,乳糖为较适宜的碳源,蛋白胨为较适宜的氮源。
2.6.2 乳糖和蛋白胨含量对Lovastatin产量的影响 乳糖和蛋白胨含量对Lovastatin产量的影响结果见表3。以乳糖为适宜碳源,在70-120 g/L乳糖含量范围内设置6个梯度;当乳糖含量为100 g/L时,Lovastatin达到最大值为84.33 μg/mL。以蛋白胨为适宜氮源,在4-14 g/L蛋白胨含量范围内设置6个梯度;当蛋白胨为12 g/L时,Lovastatin达到最大值为 87.01 μg/mL。

图6 A-8曲霉菌株ITS rDNA基因序列(545 bp)

图7 基于12株曲霉属ITS rDNA基因序列建立的A-8菌株系统发育树
2.6.3 碳氮比对Lovastatin产量的影响 碳氮比对Lovastatin产量的影响结果见表4。以乳糖为碳源,蛋白胨为氮源,在碳氮比5/0.5-15/2.25范围内设置10个梯度;当碳氮比为15/1.5时,Lovastatin达到最大值为 130.04 μg/mL。
3 讨论
Alberts等[7,11]报道,红曲霉及其它一些丝状真菌如木霉属(Trichoderma)、青霉属(Penicillium)、曲霉属(Aspergillus)等都会产Lovastatin。其中曲霉属真菌报道最多,主要种类有费舍尔曲霉(A.fischeri)[12]、黄曲霉(A. flavus)[13]、黄柄曲霉(A.flavipes)[13]、黑曲霉(A. niger)[13]、寄生曲霉(A.parasiticus)[13],土曲霉(A. terreus)[14]等。目前Lovastatin的主要工业生产菌种国外为土曲霉(A.terreus)、国内为红曲霉(Monascus)。

表1 发酵条件对曲霉A-8菌株产Lovastatin的影响

表2 不同碳源和氮源对曲霉A-8菌株产Lovastatin的影响
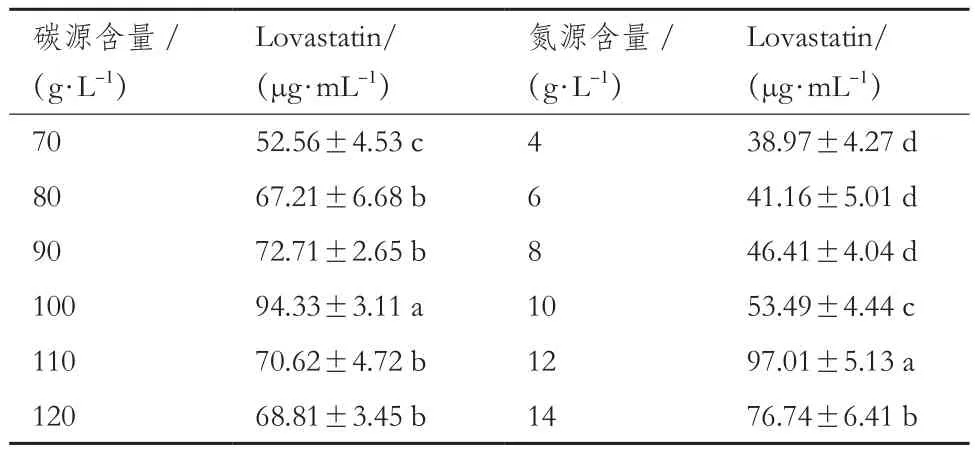
表3 不同乳糖和蛋白胨含量对曲霉A-8菌株产Lovastatin的影响
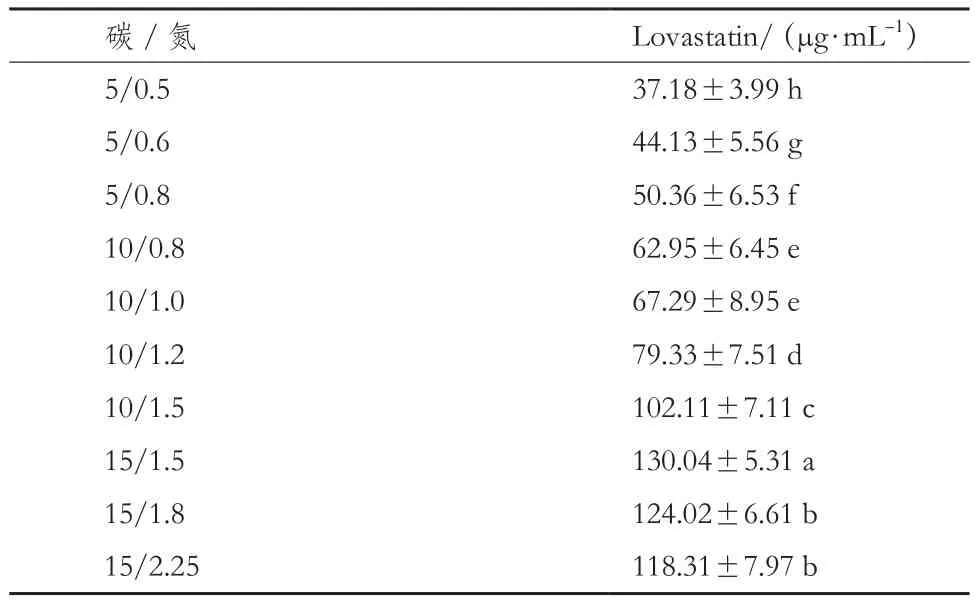
表4 碳氮比对曲霉A-8菌株产Lovastatin的影响
已报道的部分曲霉菌株Lovastatin的产量比较见表5。Javed等报道[13],用黄曲霉(A. flavusGCBL-60)发酵菌种,米糠为主要原料,在35℃、pH 5.5等条件下,液体发酵96 h,Lovastatin产量约为28.36 ± 0.76 mg/100 mL。刘爱英等[15]用紫外诱变处理1株紫色红曲霉(M. purpureusZZ),诱变后摇瓶发酵该菌株Lovastatin产量为219.9 μg/mL。童振宇等[16]对1株紫色红曲霉(M. purpureusWX)液态发酵培养基进行了优化,Lovastatin产量达到了297.4 μg/mL。游玟娟等[17]采用 Box-Behnken 设计对1株红曲霉高产突变株(Monascussp. UV-D-9)发酵生产Lovastatin条件进行了响应面优化,得到适宜发酵条件为:发酵温度 30.4℃,装液量为134mL,转速187 r/min,发酵时间 10 d,接种量8%;Lovastatin产量约为320 mg/L;章婷等[18]筛选到1株产生洛伐他汀棒曲霉(A. clavatus),经响应面优化 Lovastatin产量约为 236 μg/mL;Hasan等[19]通过基因工程手段过表达乙酰辅酶 A 羧化酶(acetyl-CoA carboxylase),使土曲霉(A. terreus)Lovastatin产量提高了40%;Fu等[20]筛选到1株产生洛伐他汀类似物的杂色曲霉(A. versicolorSC0156)。而利用杂色曲霉发酵产生Lovastatin国内外尚未见有报道,本实验室筛选的曲霉菌株A-8,经培养基配方和培养条件初步优化,Lovastatin产量达130 μg/mL左右;通过理化诱变或基因工程改良,Lovastatin产量可进一步提高,本实验丰富了生产Lovastatin的菌种资源,所选的杂色曲霉菌株具有良好的应用前景。
4 结论
本实验结果表明,来源于不同生境(食品、土壤、空气和有机质等)的曲霉菌株在菌落形态、显微形态和代谢产物产生上具有丰富的多样性。经筛选获得1株高产Lovastatin曲霉A-8菌株;经鉴定A-8菌株为杂色曲霉(A. versicolor)。经单因素实验初步优化发酵条件和培养基配方,A-8曲霉菌株发酵产生Lovastatin的水平可达130.04 μg/mL,A-8曲霉菌株是较有潜力的工业菌株。

表5 已报道的部分曲霉菌株Lovastatin的产量比较
