猪PEDV与PDCOV二重RT-PCR检测方法的建立
2018-11-30孔维欢王晶晶万鹏程石国庆
孔维欢 王晶晶 万鹏程 石国庆
(1. 石河子大学动物科技学院,石河子 832000;2. 新疆农垦科学院畜牧兽医研究所,石河子 832000)
猪流行性腹泻病毒(PEDV)和猪丁型冠状病毒(PDCOV)均属于冠状病毒科,是两种能够引起仔猪腹泻、脱水严重致死等症状的冠状病毒。其中PEDV对不同品种和各年龄段的猪都可以发生感染,尤其是出生在10日龄以内的哺乳仔猪最易感染死亡[1-2]。由PEDV感染的腹泻疾病我们称为猪流行性腹泻(PED),是以仔猪消化道病变症状为主要特征的急性、高度接触性传染病,也是目前严重危害中国规模化养猪行业仔猪腹泻病的主要病原之一[3]。早在1976年我国就首次报道了PEDV的存在,之后在2010年开始我国大面积暴发PEDV,引起仔猪因腹泻、脱水致死率高达100%,这给我国的养猪业造成了严重的经济损失[4]。
PDCOV是近年来新发现的单股正链RNA病毒,一种能够引起仔猪急性水样腹泻的新发δ冠状病毒[5],也是危害世界生猪养殖业潜在的因素。在2012年研究者Woo等[6]曾在猪粪便样品中检测到了PDCOV,接着美国俄亥俄州从腹泻仔猪中也首次发现了PDCOV[7],随后加拿大和韩国等也相继报道了PDCOV,且阳性检出率达25%[8]。在2004-2014年Dong等[9]对我国安微、广西、湖北、江苏4个地区病料检测中也陆续发现了PDCOV,说明PDCOV早在十几年前就已经在我国猪群中存在。
近年来,畜牧业规模化养殖迅猛发展,由于环境和畜禽个体等因素的相互作用,导致细菌病毒发生变异而难以控制,造成经济上的巨大损失。例如,引起仔猪腹泻疾病的PEDV变异毒株目前在全国范围内普遍传播,疫苗免疫也很难有效的防控。而且当前许多疾病的临床症状极为相似,病毒的混合感染并发症非常严重、难以诊断。如引起仔猪腹泻病的PEDV和PDCOV多混合感染,且临床症状、流行病学和病理变化非常相似[10-11],仅通过临床观察、常规诊断方法,很难满足临床上快速鉴别诊断的需求,因此建立快速、准确的检测方法至关重要。基于以上研究背景,本研究以分离的毒株为研究对象,主要采用单一RT-PCR和二重RT-PCR的方法及特异性、敏感性试验进行优化建立一种能够快速灵敏地鉴定出一种病毒或双重病毒混合感染的检测技术,并将其用于临床样品的初步检测验证。
1 材料与方法
1.1 材料
1.1.1 病毒与病料 猪流行性腹泻病毒(PEDV)和猪丁型冠状病毒(PDCOV)细胞分离毒株以及采集的疑似病毒性腹泻粪便样品,PRV、CSFV、PPV等病毒均由新疆农垦科学院兽医实验室提供保存。
1.1.2 主要试剂 琼脂糖、琼脂粉、胰蛋白胨、酵母浸出物(Biowest公司),Trizol试剂(Invitrogen公司),溴化乙锭(EB)、无水乙醇、氯仿、异丙醇(北京化工厂),反转录试剂盒、ddH2O(北京全式金公司),dNTP、Taq 酶、10×Buffer、DNA Marker(TaKaRa公司),质粒提取试剂盒、PMD18-T载体、EcoRⅠ、Hind Ⅲ内切酶(宝生物工程有限公司)。
1.1.3 主要器材 电热恒温鼓风干燥箱(XMT-152A)、恒温水浴锅(DKS22)、离心机(德国SIGMR公司)、全自动凝胶成像系统(英国Syngene公司)、核酸电泳仪(Bio-Rad公司)、分光光度计(Thermo公司)、PCR仪(Eppendorf公司)、1.5 mL离心管和培养皿等。
1.2 方法
1.2.1 病毒RNA提取及反转录cDNA单链的合成 取 200 μL病毒样品,按照 Trizol(Invitrogen)试剂说明书分别提取各病毒的总RNA。利用紫外分光光度计测定OD260/OD280值和RNA浓度,用10g/L琼脂糖凝胶电泳检测总RNA的完整性。确保所提总RNA的OD值在1.8-2.0之间,无蛋白和基因组污染。按照 TransScript®One-Step gDNA Removal and cDNA Synthesis SuperMix反转录试剂盒说明书合成cDNA,并结合实际进行适当调整。
1.2.2 引物的设计及合成 根据GenBank已收录发表的PEDV和PDCOV基因序列,应用Primer Premier 5.0进行引物设计,引物跨内含子并处在基因的高保守区域。引物序列见表1,由生工生物工程(上海)股份有限公司合成。
1.2.3 单一RT-PCR扩增 以阳性对照疫苗株RNA转录获得的cDNA为模板,分别以表1中两对引物进行单对引物扩增。采用25 μL反应体系:10×PCR buffer 2.5 μL,dNTPs 1 μL, 上 下 游 引 物 F/R 各0.5 μL,Taq 酶 0.4 μL,ddH2O 19.1 μL,cDNA 模板1 μL。94℃预变性4 min后,进入94℃变性30 s,PEDV 55℃、PDCOV 56℃退火 30 s,72℃ 45 s的循环,共循环35次;最后72℃延伸10 min,12℃保存。取PCR扩增产物经10 g/L琼脂糖凝胶电泳检测分析。将电泳分析正确的目的片段,连接pMD-18T载体,转入大肠埃希菌DH5α,进行PCR克隆与测序,DNA测序由上海生工生物工程有限公司完成,所获序列经鉴定正确。

表1 二重RT-PCR引物设计结果
1.2.4 二重RT-PCR的建立 在单对引物扩增成功的基础上,将目的基因PEDV-M、PDCOV-N加入同一PCR反应体系中配制二重RT-PCR反应混合液。将两对引物同时加入扩增体系,经反复试验优化最佳 PCR 反应体系(25 μL):10×PCR buffer 2.5 μL,dNTPs 1 μL,两对上下游引物F/R各0.5 μL,Taq酶0.4 μL,ddH2O 17.1 μL,cDNA 模板各 1 μL。建立二重RT-PCR扩增优化体系,反应程序为:94℃预变性4 min后,进入94℃变性30 s,PEDV、PDCOV均56℃退火30 s,72℃ 45 s的循环,共35次循环;最后72℃延伸10 min,12℃保存。取5 μL产物进行琼脂糖凝胶电泳检测分析,将鉴定正确的PCR扩增产物转入大肠埃希菌DH5α载体,筛选阳性重组质粒送上海生工生物工程有限公司测序。
1.2.5 特异性实验 按照1.2.1,1.2.3优化的二重RT-PCR体系条件分别对实验室保存的PRV、CSFV、PPV的核酸进行提取反转录扩增,并以PEDVPDCOV混合模板扩增为阳性对照。然后进行琼脂糖凝胶电泳检测分析,检验该方法的特异性。
1.2.6 敏感性试验 将PEDV和PDCOV细胞毒株混合物为阳性对照。用紫外分光光度计检测核酸浓度,将cDNA按10倍以内的浓度梯度稀释,调整核酸浓度,分别以它们为模板,按照已优化的二重RT-PCR反应体系进行PCR扩增。然后进行琼脂糖凝胶电泳检测分析,检测其敏感性。
1.2.7 临床应用 取实验室保存的疑似病毒性腹泻粪便样品12份,按照上述方法建立的二重RT-PCR技术,检测是否被PEDV和PDCOV感染。
2 结果
2.1 单对引物特异性RT-PCR扩增
对PEDV病料RNA进行提取反转录,通过RTPCR方法对PEDV-M基因片段进行扩增和测序,获得一条大小为750 bp的特异性目的条带(图1),并进行了测序鉴定。
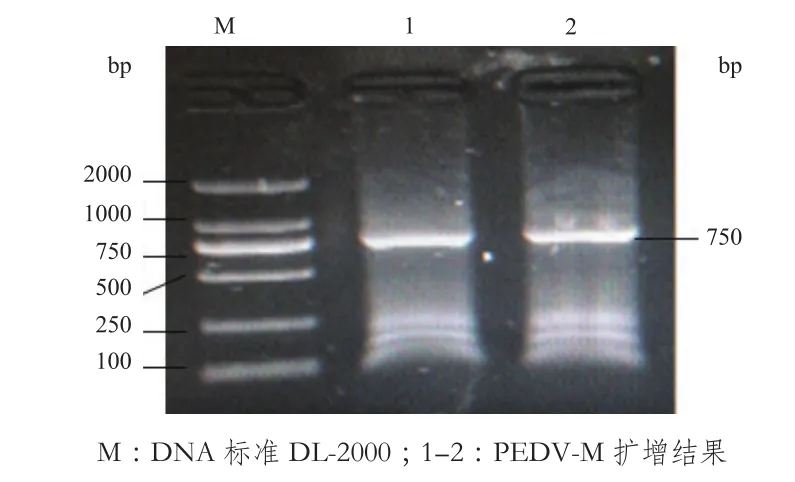
图1 PEDV凝胶电泳图
然后对PDCOV病料RNA进行提取反转录,通过RT-PCR方法对目的基因片段PDCOV-N进行扩增和测序,获得一条长度为372 bp的特异性目的条带(图2)。经测序鉴定是所设计的目的片段。从图中第1泳道可以看出,在56℃退火温度下也能扩增出750 bp大小的PEDV-M目的基因。由此,初步确定二重PCR的扩增温度为56℃。

图2 PDCOV凝胶电泳图
2.2 PEDV-PDCOV二重RT-PCR检测体系的建立与优化
在上述研究基础上,以PEDV-M和PDCOV-N凝胶回收产物为模板,按照1.2.4设计的多重PCR优化条件进行扩增,凝胶电泳进行检测分析。结果(图3)显示,在第2泳道同时扩增出PEDV和PDCOV的双重条带,且目的条带大小分别与预期目的基因片段大小一致,说明优化的最佳退火温度为56℃。

图3 二重RT-PCR的扩增结果
2.3 特异性实验结果
按照所建立的二重RT-PCR体系对PRV、CSFV、PPV和PEDV-PDCOV混合模板分别进行扩增,结果(图4)显示,PRV、CSFV、PPV等病毒基因均为阴性,而PEDV-PDCOV混合模板扩增出了相应病毒的目的片段,即说明了该二重RT-PCR体系的特异性强。
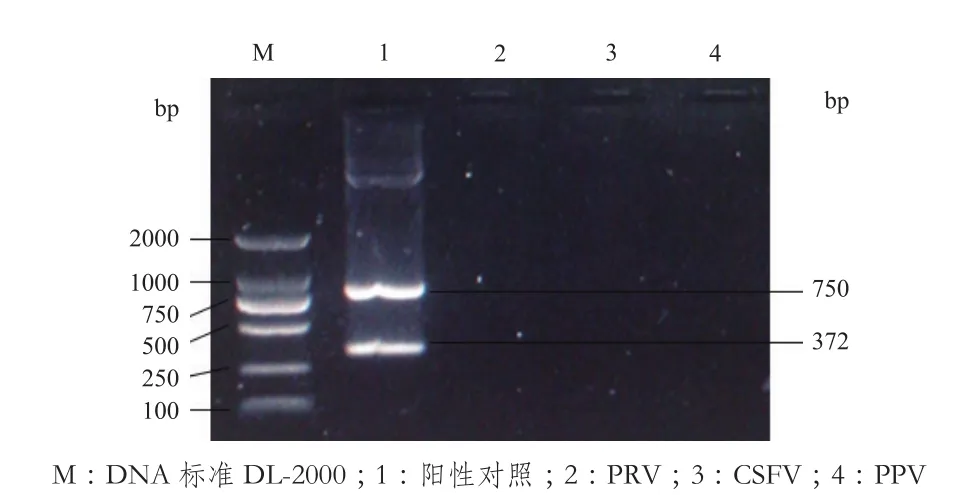
图4 特异性试验结果
2.4 敏感性实验结果
根据5 μL的PEDV和PDCOV的PCR回收产物和标准Marker的5 μL的亮度比较,初步检测确定回收产物的基因浓度为200 ng/μL和250 ng/μL,然后将核酸浓度分别稀释。两核酸混合使其浓度稀释为200 ng,100 ng,50 ng,25 ng,10 ng,5 ng,1 ng,0.5 ng,0.1 ng的总量,以此作为模板进行扩增。结果(图5)表明,核酸量为200 ng,100 ng,50 ng,25 ng,10 ng,5 ng,1 ng,0.5 ng均能扩增出相应大小片段,但亮度依次减弱的特异性条带。而0.1 ng浓度核酸并没有明显的条带出现。因此该PCR体系能够扩增的核酸浓度下限为100 pg/μL。
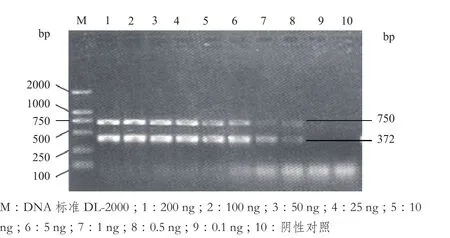
图5 敏感性试验结果
2.5 二重RT-PCR检测方法的临床应用
以建立的二重RT-PCR方法对采集的12份疑似临床病例样品进行检测。结果(图6)显示,12份疑似病例样品中有1份混合病毒感染,1份PEDV感染,2份PDCOV感染,其余8份呈阴性无病毒感染。
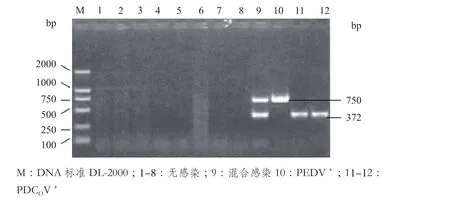
图6 二重RT-PCR临床检测结果
3 讨论
近年来,随着国内集约化规模化养猪行业突飞猛进的发展,猪病毒性疾病的发生和流行日益严重,发病率、死亡率也越来越高,且多种病毒的变异或混合感染已成当前疫病流行病学的主要形式和特点[12]。它们的临床症状有许多极为相似之处,这给兽医学者和专家们临床诊断确定疾病感染带来了很大的困难,也给养猪业造成了巨大的经济损失。
本实验针对由病毒感染引起仔猪腹泻脱水等临床症状极为相似的PEDV和PDCOV进行单项RTPCR的基础条件上,参考王隆柏等[13]建立的5种猪病多重PCR检测方法,通过对病毒引物、dNTP、模板用量及反应温度等条件的优化,建立了灵敏度好特异性强的PEDV-PDCOV二重RT-PCR快速鉴别诊断的方法。多重PCR在同一体系实现对多个目的基因的特异性扩增并不是单项PCR简单的混合,例如我们实验所建立的二重RT-PCR反应体系,引物设计就是其中一个最关键的因素。它除了决定着反应程序中的退火温度及引物二聚体的形成与否外,还影响着反应的特异性和扩增效率等。
相对于耗时费力、敏感性和特异性不高的病毒分离、免疫荧光和酶联免疫吸附实验等传统的猪群疫病检测方法,聚合酶链式反应(PCR)更能被广泛应用于各种病毒检测[14],但常规的应用多重PCR检测多种病毒也费时费力。所以,本研究通过单项RT-PCR技术条件的优化扩增出了PEDV和PDCOV相应的目的片段750 bp、372 bp。初步表明该二重RT-PCR体系的最佳退火温度为56℃,并通过建立二重RT-PCR优化体系得以验证。采用该体系对PRV、CFSV、PPV进行特异性实验,以及PEDVPDCOV进行浓度梯度敏感性扩增,发现该二重RTPCR体系特异性强、敏感性高的特点。通过临床疑似病例的检测也说明了方法的高效性。
4 结论
通过实验研究成功建立了PEDV和PDCOV的二重RT-PCR检测方法,该方法灵敏度高、特异性好,高效快捷的特点,在临床上能够快速鉴别诊断出PEDV和PDCOV单独或混合感染的病例。
