超高效液相色谱-串联质谱法测定牛奶中利巴韦林残留量
2018-11-30王紫竹邹唯嘉
文/王紫竹 周 鑫 邹唯嘉
(天津市乳品食品监测中心)
利巴韦林又称病毒唑,为核苷类似物,兽医临床上常用于腺病毒、流感病毒、呼吸道合胞病毒等感染性疾病的防治,可用于奶牛传染性鼻气管炎、牛恶性卡他热、牛溃疡性乳头炎、牛副流感等疾病的治疗及预防。因其毒性及药物滥用存在影响人类健康和生态平衡的潜在危害,2005年原农业部第560号公告废止了利巴韦林及其盐、酯以及单复方制剂的兽药用途,禁止销售及在畜禽养殖过程中使用利巴韦林制剂或原料药,在动物性食品中不得检出。
1 材料与方法
1.1 仪器和设备
超高效液相色谱-串联质谱仪(配ESI源,LC30A-8050A);电子分析天平(0.001 g);高速冷冻离心机;超声波仪;恒温水浴锅;涡旋振荡器;pH计;氮吹仪;固相萃取装置;PBA固相萃取柱(Cleanert PBA,100 mg,3 mL)。
1.2 药品和试剂
标准物质信息见表1。酸性磷酸酯酶(活力≥0.4 unit/mg),三氯乙酸,氨水,均为分析纯;乙酸铵,乙腈,甲醇,甲酸,均为色谱纯;实验用水为超纯水。
1.3 溶液的配制
1.3.1 标准溶液
准确称取利巴韦林标准品约10 mg(精确至0.1 mg),置于10 mL容量瓶中,用甲醇溶解并定容至刻度,摇匀后得到约1 mg/mL的储备液。用移液管准确移取上述储备液100 μL,置于100 mL容量瓶中,用甲醇定容至刻度,摇匀后得到浓度约为1 μg/mL的工作液。
准确称取内标利巴韦林-13C5约10 mg(精确至0.1 mg),置于10 mL容量瓶中,用甲醇溶解并定容至刻度,摇匀后得到约1 mg/mL的内标储备液。用移液管准确移取上述内标储备液100 μL,置于100 mL容量瓶中,用甲醇定容至刻度,摇匀后得到浓度约为1 μg/mL的内标工作液。
利巴韦林标准储备液与内标储备液置于-18 ℃条件下保存,有效期6个月,标准工作液与内标工作液置于0~5 ℃条件下保存,有效期为2 周。
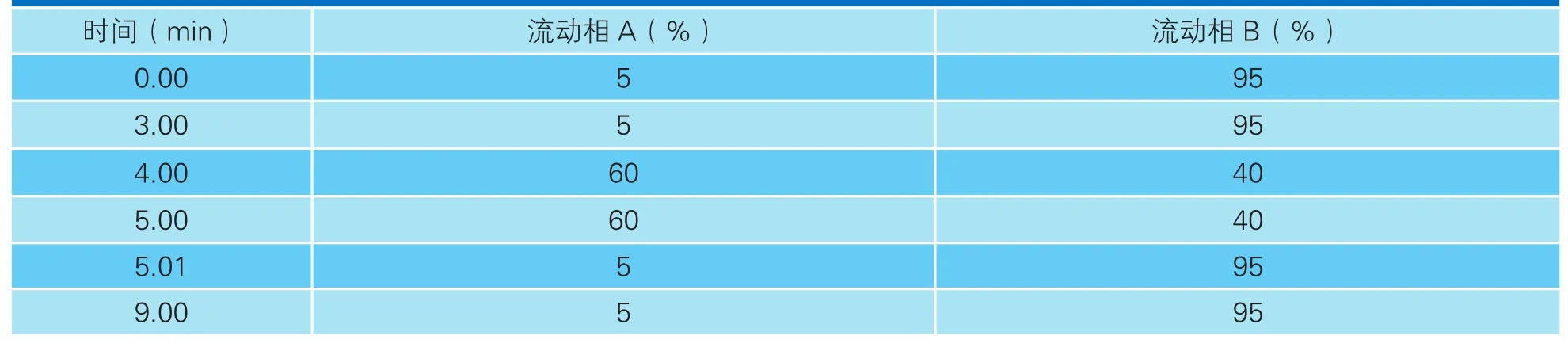
表2 液相色谱梯度洗脱条件
1.3.2 三氯乙酸溶液
称取20 g三氯乙酸,加入约950 mL水使其溶解,用氨水调节pH值至4.8±0.1,再用水定容至1 L,得到浓度为20 g/L的三氯乙酸溶液。
1.3.3 酸性磷酸酯酶溶液
准确称取酸性磷酸酯酶10 mg,置于100 mL容量瓶中,用水溶解并定容至刻度,摇匀后得到100 μg/mL的酸性磷酸酯酶解液,置于0~5 ℃条件下保存。
1.3.4 乙酸铵缓冲溶液
称取18.12 g乙酸铵固体,加入约950 mL水使其溶解,用氨水调节pH值至8.5±0.1,再用水定容至1 L,得到浓度为0.25 mol/L的乙酸铵缓冲溶液。
1.3.5 甲酸水溶液
用移液枪吸取2 mL甲酸,加入500 mL水中,得到浓度约为100 mmol/L甲酸水溶液。
1.4 试验方法
1.4.1 样品前处理
(1)提取
称取5 g(精确至0.01 g)牛奶样品,置于50 mL离心管中,用移液枪加入100 μL内标工作液(浓度为1 μg/mL),涡旋混合30 s,加入10 mL三氯乙酸溶液和3 mL乙腈,涡旋混匀2 min,在超声波仪中超声5 min,于4 ℃条件下10 000 r/min下离心5 min,取上清液于25 mL容量瓶中,再加入5 mL三氯乙酸溶液重复提取一次,离心后合并上清液至容量瓶中,用三氯乙酸溶液定容至25 mL。
(2)酶解
用移液管准确移取5 mL提取液,加入1 mL乙酸铵溶液,涡旋混匀30 s,再加入100 μL酸性磷酸酯酶溶液,加盖后涡旋1 min,于37 ℃恒温水浴中培养2 h。取出后冷却至室温。用氨水调pH值至8.5±0.1,于4 ℃条件下10 000 r/min离心5 min,取上清液备用。
(3)净化
用3 mL乙腈、1 mL甲酸水溶液和3 mL乙酸铵缓冲溶液依次活化固相萃取柱;用移液管准确移取(1)中提取的上清液5 mL上样,自然流速过柱,待上清液流过固相萃取柱后,依次用3 mL乙酸铵缓冲溶液和3 mL水淋洗,真空抽干5 min;用2 mL甲酸水溶液洗脱至氮吹杯中,40 ℃条件下用氮气吹干;用2 mL乙腈溶解残渣,0.22 μmPTFE滤膜过滤至样品瓶中,待液相色谱-串联质谱仪测定。
1.4.2 仪器条件
(1)色谱条件
色谱柱为BEH HILIC柱(1.7μm,2.1 mm×100 mm);色谱柱柱温为35 ℃,进样量为2 μL;流动相A为5 mmol/L乙酸铵溶液(含0.2%甲酸),流动相B为乙腈,流速为0.35 mL/min。梯度洗脱条件见表2。(2)质谱条件
离子源及电离方式为电喷雾离子源(ESI),正离子检测模式;雾化气为氮气,流量3.0 L/min;干燥气为空气,流量为10 L/min;加热气为空气,流量为10 L/min;碰撞气为氩气,压力为270 KPa;接口温度为300 ℃;脱溶剂管温度为250 ℃;加热块温度为400 ℃。其它条件见表3。

表3 利巴韦林及内标物的定性、定量离子对及其它质谱条件

表4 相对离子丰度的允许偏差
1.4.3 标准曲线测定液的配制
用移液管分别移取0.01、0.05、0.20、0.50、0.80、1.00 mL标准工作液于6 个10 mL容量瓶中,再向6 个容量瓶中分别加入0.2 mL内标工作液,用乙腈稀释至刻度,配制6 个标准曲线测定液,浓度分别为1.00、5.00、20.00、50.00、80.00、100.00 ng/mL。
1.4.4 定性分析
在上述相同的试验条件下,样品中待测物质与对应浓度标准物质的保留时间偏差在±2.5%之内,且样品色谱图中待测物质的定性离子相对离子丰度相对于相近浓度的标准物质符合表4要求,则可判定该样品中存在利巴韦林。
1.4.5 样品添加回收率和精密度测定
(1)空白样品
选取牛奶样品,按照前处理方法及步骤进行试验,以确定本底中利巴韦林的含量低于检出限,可作为空白试样进行样品添加回收率的测定。
(2)准确度和精密度
利巴韦林检验确定加标水平为①1.00 μg/kg和②10.00 μg/kg,其中①为测定低限、②为线性范围内高浓度水平10 倍测定低限。根据前处理步骤中称样量、稀释及定容步骤换算样液浓度分别为①1.00 ng/mL和②10.0 ng/mL,利巴韦林实际样液浓度分别为①0.96 ng/mL和②9.60 ng/mL。
1.4.6 灵敏度测定
取利巴韦林标准工作液适量,添加到空白牛奶样品中,使牛奶中利巴韦林含量分别为0.20、0.50和1.00 μg/kg,按前处理步骤进行试验后,测定利巴韦林定量离子对的信噪比(S/N)及相应添加浓度,以S/N≥3时的添加浓度为方法检出限。
2 试验结果
2.1 色谱图
空白牛奶样品和牛奶添加样品中利巴韦林和利巴韦林-13C5的定性及定量离子对色谱图见图1-a和1-b所示,牛奶添加样品中利巴韦林和内标物峰型良好,与杂质峰分离度较好,基质干扰小。
2.2 线性关系及范围
标准曲线线性范围为1.00~100.00 ng/mL,以内外标浓度比值作为横坐标,内外标响应峰面积比值作为纵坐标,绘制标准曲线,得到线性方程及r2。如图2所示,r2为0.9971,线性关系良好。
2.3 方法回收率及精密度
空白牛奶添加利巴韦林的回收率及精密度测定结果见表4。在①和②的添加水平上,利巴韦林的回收率范围在82.6%~115%,变异系数分别为3.45%和1.72%,结果符合《实验室质量控制规范 食品理化检测》(GB/T 27404-2008)附录F中关于检测方法确认的技术要求的规定。
2.4 检出限

图1 -a 空白牛奶样品中利巴韦林和利巴韦林-13C5色谱图
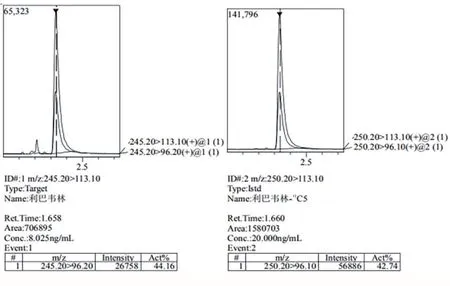
图1 -b 添加浓度为10 μg/kg牛奶样品中利巴韦林和利巴韦林-13C5色谱图
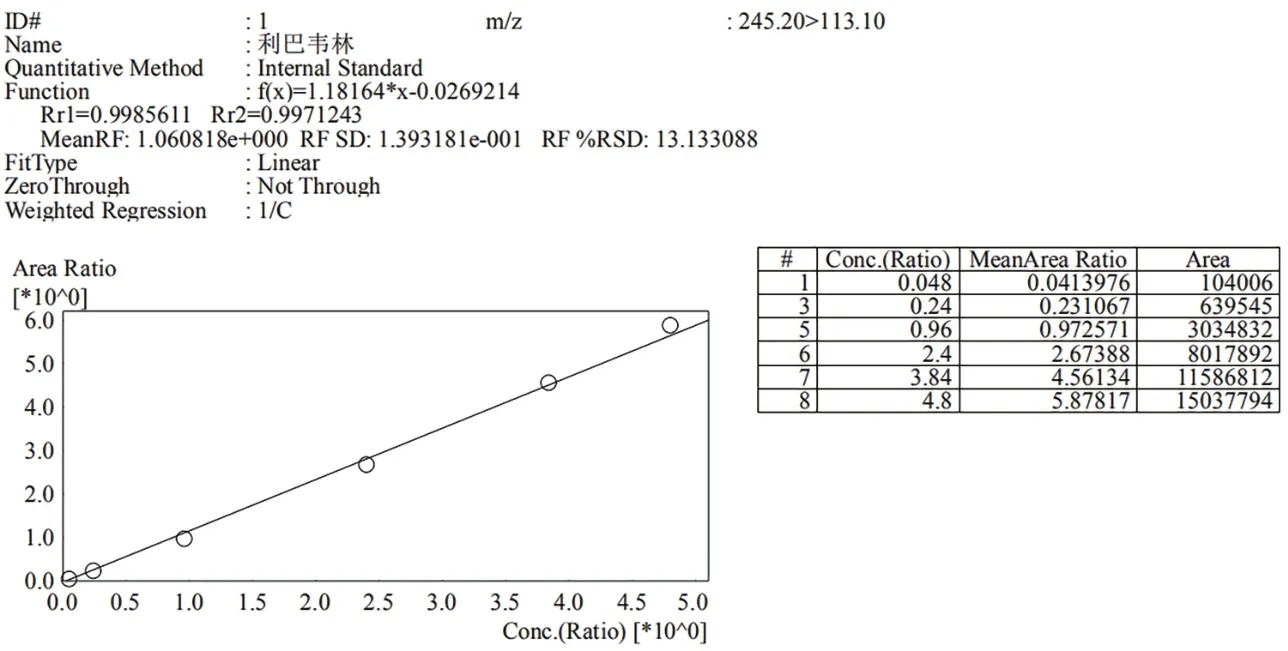
图2 利巴韦林标准曲线图
本方法试验条件下,当空白牛奶样品中利巴韦林的浓度为0.50 μg/kg时,其色谱峰信噪比S/N≥3,此浓度即为检出限。
3 结论及讨论
3.1 试验采用酶解方法将利巴韦林代谢物酶解成利巴韦林原药形式,再用液相色谱-串联质谱法进行仪器分析,从而可以准确测定利巴韦林的残留总量。PBA固相萃取柱对牛奶基质中存在的杂质去除效果较强,利巴韦林检测灵敏度较高。
3.2 利巴韦林的极性较大,在一般常用的反相C18色谱柱上保留作用不强,峰型较差,换为HILIC柱后,利巴韦林有了较好的保留,峰型有了极大改善。
3.3 牛奶中基质较复杂,采用液质方法进行测定时基质干扰较大,仅用外标法定量结果准确度较低,采用利巴韦林同位素作为内标加入试验过程,用内标法定量,可以很大程度消除牛奶基质效应的影响,提高了方法定量准确度。
3.4 通过试验数据可以看出,本实试验法有较好的准确度和精密度,能够满足对牛奶中利巴韦林残留分析的要求。C
表5 利巴韦林不同浓度水平加标回收率及精密度
平行样编号实测样液浓度(ng/mL) 1.091 1.079 1.103 1.003 1.077 1.030 1.064 3.45添加水平 1 2 3 4 5 6 平均值 变异系数(%)①样品浓度1.00 μg/kg(样液浓度0.96 ng/mL) 回收率(%) 114 112 115 104 112 107 111实测样液浓度(ng/mL) 8.284 8.132 7.952 8.204 8.145 7.931 54.208 1.72②样品浓度10.00 μg/kg(样液浓度9.60 ng/mL)回收率(%) 86.3 84.7 82.8 85.5 84.8 82.6 84.5
[3] 郑锌,汤晓艳,周剑,等. 超高效液相色谱-串联质谱法测定鸡血浆中利巴韦林及其主要代谢物[J]. 分析测试学报,2015,34(7):819-823.
[4] 朱永林,邵德佳,蒋天梅,等. 高效液相色谱-串联质谱法测定鸡肝中利巴韦林及其代谢物残留总量[J]. 中国兽药杂志,2008,42(7):22-25.
[5] Homma M,Jayewardene A L,Gambertoglio J,et al. High-performance liquid chromatographic determination of ribavirin in whole blood to assess disposition in erythrocytes[J]. Antimicrob Agents Chemother,1999,43(11):2716-2719.
