采前氯吡脲处理对‘秦美’猕猴桃贮藏期间果实硬度及细胞壁降解的影响
2018-11-29李圆圆罗安伟蔺志颖宋俊奇白俊青方沂蒙
李圆圆,罗安伟*,李 琳,苏 苗,蔺志颖,宋俊奇,白俊青,方沂蒙
(西北农林科技大学食品科学与工程学院,陕西 杨凌 712100)
猕猴桃味道独特鲜美、酸甜可口,成熟后质地柔软、香气宜人,含有丰富的果糖、葡萄糖、柠檬酸、多种人体所需的微量元素及氨基酸,被誉为“VC之王”。近年来,我国猕猴桃产业发展迅速,2015年我国猕猴桃栽培面积达到14万 hm2,鲜果总产量达219万 t,居世界第一;陕西省猕猴桃种植面积近6.67万 hm2,产量达123万 t,均占到世界的1/3[1]。为迎合部分消费者和客商的需求,自20世纪90年代初开始,膨大剂在猕猴桃生产中得到大面积推广和应用[2]。
氯吡脲(1-(2-chloropyridin-4-yl)-3-phenylurea,CPPU)俗名膨大剂,是经过国家批准的植物生长调节剂,能显著促进细胞分裂和细胞增长,在苹果、葡萄、猕猴桃、草莓、枇杷等诸多水果上均表现出极好地促进果实生长、增加单果质量的作用[3]。但研究表明CPPU的使用会降低贮藏期间的果实硬度,促进软化,使耐贮性变差[4-5]。果实硬度下降、质地变软与果实细胞壁组分及其降解酶活力的变化有着密切的关系,研究发现果实软化主要是由细胞中胶层结构改变、细胞壁降解及组分变化而引起的[6],在贮藏过程中构成细胞壁物质的原果胶降解为可溶性果胶和果胶酸,纤维素溶解,细胞壁变薄甚至消失,从而导致果实软化。同时,果实软化与细胞壁降解酶的活力也密切相关,多聚半乳糖醛酸酶(polygalacturonase,PG)、果胶甲酯酶(pectin methylesterase,PME)、纤维素酶(cellulase,Cx)和β-半乳糖苷酶(β-D-galaetosidase,β-Gal)是导致果实成熟软化的主要细胞壁降解酶[7]。不同果实在成熟软化过程中其细胞壁组分的变化和细胞壁降解酶活力的改变有很大的差异[8-10]。在猕猴桃方面,曾照旭[11]发现1-甲基环丙烯处理降低了软枣猕猴桃果实PG活力峰值,而且推迟了果实β-半乳糖醛酸酶活力峰值的出现。李佩艳等[12]发现草酸钾处理‘华特’毛花猕猴桃可抑制果实PG、木聚糖酶和β-Gal的活力。李明霞等[13]发现不同微波功率与时间组合处理可抑制‘皖翠’猕猴桃细胞壁酶降解的速率。国外关于CPPU在猕猴桃方面的应用研究主要集中在果实品质及大小方面,Kim等[14]发现5~10 mg/L CPPU处理能使果实质量加倍,但可溶性固形物、可滴定酸和抗坏血酸含量显著降低。Cruz-Castillo等[15]发现开花早期使用CPPU能显著增大果实。Ainalidou等[16]发现只有经授粉的果实经CPPU处理后质量和大小增加,没有经授粉的果实更软,CPPU处理会导致果实畸形。但目前关于CPPU处理对猕猴桃采后贮藏期间细胞壁代谢方面的研究鲜有报道。
本实验以‘秦美’猕猴桃为试材,通过使用不同质量浓度CPPU对生长期果实进行处理,成熟后采收,测定贮藏期果实硬度、细胞壁降解及其相关酶的活力变化,以探明CPPU对猕猴桃采后硬度及细胞壁降解相关酶活力的影响程度,并比较果实硬度与相关酶活力的关系,为生产中CPPU的使用及猕猴桃贮藏保鲜中抑制果实的后熟软化、延长贮藏期提供参考。
1 材料与方法
1.1 材料与试剂
供试猕猴桃品种为‘秦美’,采自陕西省杨凌区一管理良好的猕猴桃基地果园,果树树龄6 年,树势健壮。
CPPU 四川省兰月科技有限公司;咔唑 北京索莱宝科技有限公司;浓硫酸 成都市科龙化工试剂厂;体积分数95%乙醇溶液 广东光华科技股份有限公司;多聚半乳糖醛酸 上海源叶生物科技有限公司;3,5-二硝基水杨酸、羧甲基纤维素钠 国药集团化学试剂有限公司;4-硝基苯基-β-D-吡喃半乳糖苷、果胶 上海阿拉丁生化科技股份有限公司;所有试剂均为优级纯或化学纯。
1.2 仪器与设备
DK-98-11A电热恒温水浴锅 天津市泰斯特仪器有限公司;HC-3018R高速冷冻离心机 安徽中科中佳科学仪器有限公司;TAXT PLUS/50物性测定仪 英国Stable Micro Systems公司;L5紫外-可见分光光度计上海仪电分析仪器有限公司;电子天平 诸暨市超泽衡器设备有限公司。
1.3 方法
1.3.1 实验设计
于盛花期后28 d分别采用0(对照,清水)、5、10、20 mg/L 4 个质量浓度CPPU水溶液进行蘸果处理,蘸果时间3~5 s;当果实可溶性固形物质量分数达到6.0%~6.5%时采收,预冷24 h后用厚度0.03 mm的聚乙烯袋包装,每袋10 个果实,用橡皮筋扎口后在0~1 ℃、相对湿度90%~95%条件下贮藏备用,每隔15 d取样测果实硬度,并将果实去皮切块于液氮中速冻,—80 ℃冰箱保存用于细胞壁及降解酶活力测定。实验设3 次重复。
1.3.2 指标测定
1.3.2.1 硬度的测定
果肉硬度用物性测定仪测定,最大量程25 kg,P5圆形探头,探头直径为0.5 cm。
1.3.2.2 可溶性果胶和原果胶质量分数的测定
参照曹建康等[17]的方法略加改进,提取可溶性果胶和原果胶后采用咔唑法测定其质量分数。
1.3.2.3 纤维素质量分数的测定
参照王学奎[18]的方法用蒽酮法测定纤维素质量分数。
1.3.2.4 PG活力的测定
参照曹建康等[17]的方法测定PG活力。以每小时每克果蔬组织样品(鲜质量)在37 ℃催化多聚半乳糖醛酸水解生成半乳糖醛酸的质量表示。
1.3.2.5 PME活力的测定
参照Lynguyen等[19]的方法用NaOH滴定法测定PME活力,并略作改动。取猕猴桃果肉5 g,加5 mL提取缓冲液(含6 g/L NaCl溶液、0.6 g/L乙二胺四乙酸溶液、1 g/L聚乙烯吡咯烷酮溶液)后冰浴研磨,静置15 min后离心,上清液为PME提取液。取酶液1 mL,预热3 min后加10 g/L果胶4 mL,记录反应体系在37 ℃恒温30 min时,维持其pH值始终为7.5时所消耗0.1 mol/L NaOH溶液的体积,以该条件下每分钟每克鲜质量样品催化果胶释放羧酸的物质的量为一个酶活力单位。
1.3.2.6 Cx活力的测定
参照曹建康等[17]的方法测定Cx活力。以每小时每克果蔬组织样品(鲜质量)在37 ℃条件下催化羧甲基纤维素水解形成还原糖的质量表示。
1.3.2.7 β-Gal活力的测定
参照Gwanpua等[20]的方法测定β-Gal活力。以每分钟每克鲜样水解释放对硝基苯酚的物质的量表示。
1.4 数据统计与分析
采用Origin 2016软件作图,SPSS 20.0软件进行数据间双变量相关性分析,Duncan检验方法进行差异显著性分析,P<0.05表示差异性显著。
2 结果与分析
2.1 CPPU处理对猕猴桃贮藏期果实硬度的影响
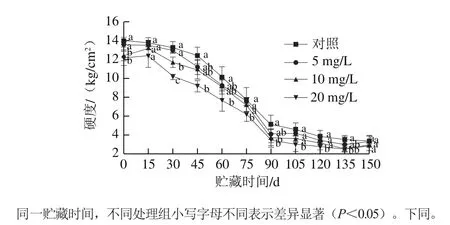
图1 CPPU处理对‘秦美’猕猴桃贮藏期果实硬度的影响Fig.1 Effect of CPPU treatment on fruit firmness of ‘Qinmei’kiwifruit during storage
硬度是指果实抗压力的强弱,果实硬度变化是反映果实贮藏性和衡量贮藏效果的重要指标[21]。如图1所示,果实在采后成熟衰老过程中,硬度呈现一直下降的趋势。使用CPPU处理的果实硬度均低于对照组果实,且与CPPU质量浓度呈剂量效应关系,质量浓度越大,果实硬度越低。采收时10、20 mg/L CPPU处理组果实的硬度显著低于对照组(P<0.05),分别比对照组低11.28%和13.50%。贮藏0~90 d,果实硬度快速下降,对照组和5、10、20 mg/L处理组的硬度分别下降了63.36%、65.56%、70.53%和71.68%,处理组果实硬度下降幅度更大,且CPPU质量浓度越大,果实硬度下降越快;采后贮藏第90~150天,硬度下降趋于平缓,处理组果实硬度均低于对照组,且处理质量浓度越高,果实硬度越低。5 mg/L CPPU处理组果实的硬度虽然也低于对照组,但未达到显著水平(P>0.05)。
2.2 CPPU处理对猕猴桃贮藏期细胞壁组分的影响
2.2.1 CPPU处理对猕猴桃贮藏期原果胶和可溶性果胶质量分数的影响
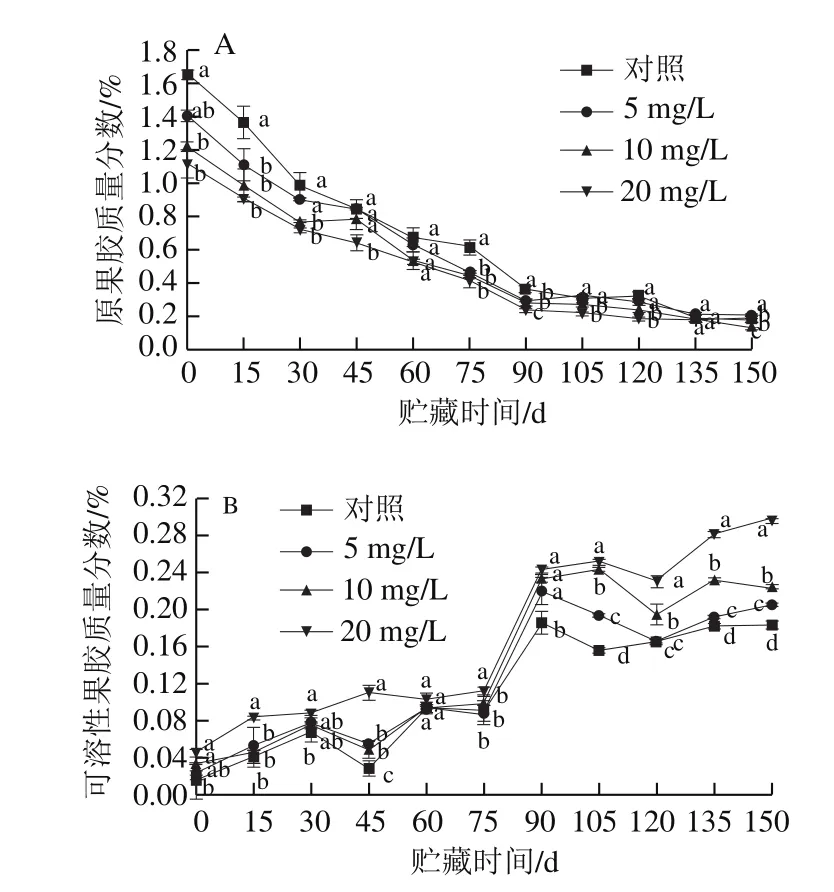
图2 CPPU处理对‘秦美’猕猴桃贮藏期原果胶(A)和可溶性果胶(B)质量分数的影响Fig.2 Effect of CPPU treatment on protopectin (A) and soluble pectin (B) content of ‘Qinmei’ kiwifruit during storage
果胶是构成细胞壁的主要成分,果实在后熟阶段中原果胶在果胶酶的作用下不断被水解为可溶性果胶,果实变软。图2A表明,果实在采后贮藏过程中,原果胶质量分数不断下降,使用CPPU处理的果实原果胶质量分数均低于对照组果实,且处理质量浓度越大,原果胶质量分数越低。贮藏前90 d,原果胶质量分数下降迅速,之后变得缓慢。刚采收时,10、20 mg/L处理组的原果胶质量分数显著低于对照组(P<0.05),分别比对照组低26.02%、32.12%。由图2B可知,可溶性果胶质量分数呈上升趋势,处理组可溶性果胶质量分数始终大于对照组。在采后贮藏第75~90天,可溶性果胶质量分数迅速上升,对照组和5、10、20 mg/L处理组分别增加了105.88%、153.39%、140.43%、118.69%。贮藏第90~150天,10、20 mg/L处理组显著高于对照组(P<0.05)。在贮藏期内,5 mg/L CPPU处理组果实的原果胶质量分数始终低于对照组,可溶性果胶质量分数始终高于对照组,但差异均未达到显著水平(P>0.05)。10、20 mg/L CPPU处理加速了原果胶的降解和可溶性果胶质量分数的升高,加速了果实细胞骨架物质果胶的分解,导致果实硬度下降,软化加速,且CPPU质量浓度越大,软化效应越明显。
2.2.2 CPPU处理对猕猴桃贮藏期纤维素质量分数的影响
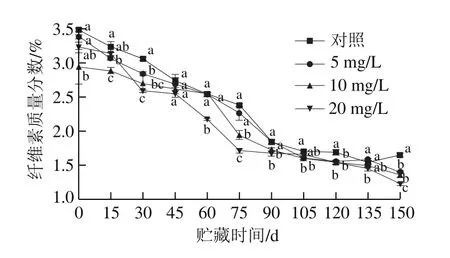
图3 CPPU处理对‘秦美’猕猴桃贮藏期纤维素质量分数的影响Fig.3 Effect of CPPU treatment on cellulose content of ‘Qinmei’kiwifruit during storage
纤维素是构成细胞壁的另一主要成分,也是维持果实硬度的主要物质,在果实后熟阶段因逐渐被水解,而引起果实硬度下降。由图3可知,随着贮藏时间的延长,采后猕猴桃果实纤维素质量分数逐渐降低。在整个贮藏期间,CPPU处理组果实的纤维素质量分数均低于对照组,且CPPU质量浓度越大,纤维素质量分数越低;贮藏前期(前90 d)纤维素降解速率快,后期降解则较为平缓。贮藏至第90天时,对照组和5、10、20 mg/L CPPU处理组纤维素质量分数与初始相比分别降低了46.91%、45.50%、41.61%和48.21%,CPPU处理促进了果实纤维素的降解,5 mg/L处理组与对照组相比未达到显著水平,10、20 mg/L处理组与对照果实相比差异显著(P<0.05)。与对照处理相比,20 mg/L CPPU处理促进了猕猴桃果实在整个贮藏期纤维素的降解,破坏了细胞结构,降低果实硬度,促进了果实的软化。
2.3 CPPU处理对猕猴桃贮藏期细胞壁降解酶活力的影响
2.3.1 CPPU处理对猕猴桃贮藏期PME和PG活力的影响
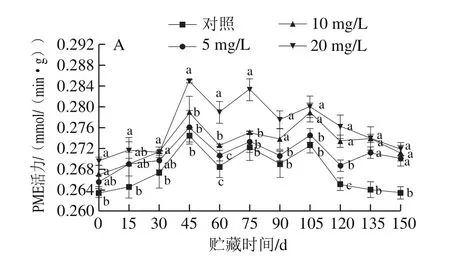
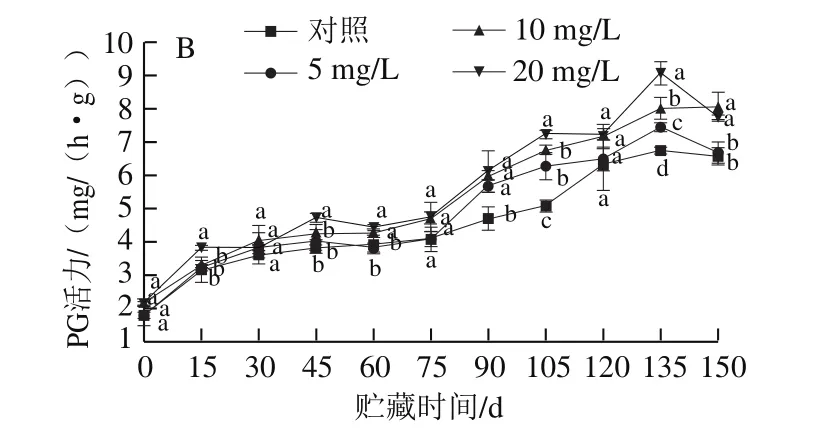
图4 CPPU处理对‘秦美’猕猴桃贮藏期PME(A)和PG(B)活力的影响Fig.4 Effect of CPPU treatment on PME (A) and PG (B) activities of‘Qinmei’ kiwifruit during storage
PME主要使果胶去甲酯化,催化果胶酯酸转化为果胶酸,破坏多聚糖醛酸链间钙的横向联接而导致细胞分离,同时生成适合于PG作用的底物,进而使PG沿多聚半乳糖醛酸主链水解果胶酸,使果胶降解,导致细胞壁解体而使果实软化[22-23]。由图4A可知,PME活力在贮藏前45 d逐渐升高,并达到最大值,45~105 d变化趋缓,之后逐渐下降,CPPU处理组果实PME活力在整个贮藏期间一直高于对照组果实;贮藏第45天,对照组和5、10、20 mg/L CPPU处理组果实PME活力达到峰值,分别为0.274 5、0.276 1、0.278 9 mmol/(min·g)和0.285 0 mmol/(min·g),5、10 mg/L处理组与对照组果实PME活力无显著差异,20 mg/L处理组与对照组相比差异显著(P<0.05)。
PG是以PME作用的产物多聚半乳糖醛酸为反应底物的酶。果实贮藏期间,PG的水解作用使果胶降解,细胞壁解体,最终导致果实软化[22]。由图4B可知,随着贮藏时间的延长,果实PG活力呈先上升后下降的趋势,使用CPPU处理的果实PG活力均比对照组高,且与CPPU质量浓度呈剂量效应关系,质量浓度越大,酶活力越高。贮藏期前75 d,PG活力缓慢增加;贮藏75 d后,活力快速上升,于第135天达最大值,5、10、20 mg/L CPPU处理组分别比对照组高10.44%、18.75%和34.26%,且酶活力显著高于对照组(P<0.05)。
CPPU处理提高了PME和PG的活力,从而加速了原果胶的分解,引起果实硬度下降和软化。
2.3.2 CPPU处理对猕猴桃贮藏期Cx和β-Gal活力的影响
Cx是一类可以降解羧甲基纤维素的酶[24],它能降解构成细胞壁的纤维素,从而破坏细胞结构,导致果实软化。由图5A可知,随着贮藏时间的延长,果实Cx活力呈先上升后下降的趋势,CPPU处理质量浓度越高,Cx活力越高。在贮藏期第75~135天,Cx活力上升速率快,幅度大,且贮藏第135天时酶活力达到最大值,5、10、20 mg/L CPPU处理组分别比对照组高0.413 0、0.472 7、0.784 5 mg/(h·g)。
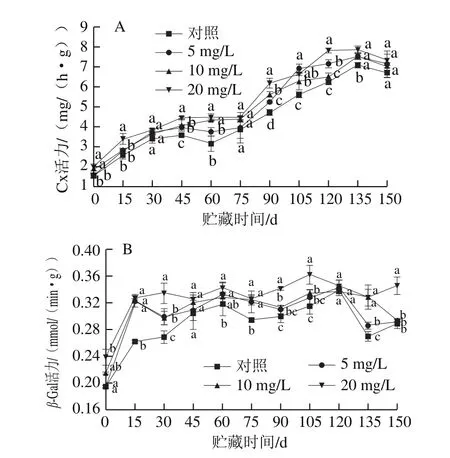
图5 CPPU处理对‘秦美’猕猴桃贮藏期Cx(A)和β-Gal(B)活力的影响Fig.5 Effect of CPPU treatment on Cx (A) and β-Gal (B) activities of ‘Qinmei’ kiwifruit during storage
β-Gal主要是切断细胞壁物质的半乳糖苷键,清除半乳糖残基[25],对水解果胶和半纤维素均有作用。由图5B可知,β-Gal活力在贮藏期间呈现先上升后下降的趋势,且处理组始终高于对照组。处理组β-Gal活力在第15天时达到最大值,之后增加趋于平缓,而对照组峰值出现在第60天,说明CPPU处理加速了β-Gal活力高峰的出现;对照组酶活力高峰值为0.317 7 mmol/(min·g),5、10、20 mg/L CPPU处理组高峰值分别为0.322 1、0.322 2、0.325 6 mmol/(min·g)。
CPPU处理同样升高了Cx和β-Gal的活力,使得细胞壁中纤维素和果胶的分解加速,加快了果实的后熟软化,使果实耐藏性下降,且质量浓度越大,效应越明显。
2.4 果实硬度、细胞壁组分及其降解酶活力之间的相关性
由表1中各指标间的相关系数可知,猕猴桃贮藏过程中果实硬度、细胞壁组分质量分数及其降解酶活力之间有密切相关性。各处理组果实硬度与可溶性果胶质量分数呈极显著负相关(P<0.01),而与原果胶和纤维素质量分数呈极显著正相关(P<0.01);各处理组果实硬度与PG和Cx活力呈极显著负相关(P<0.01),20 mg/L处理组果实硬度与β-Gal活力显著负相关(P<0.05),说明PG和Cx对‘秦美’猕猴桃果实软化的贡献大于PME和β-Gal,且高质量浓度CPPU增强了β-Gal活力与硬度的相关性。由表1还可知,细胞壁组分质量分数与其降解酶活力均呈一定的相关性,各处理组果实可溶性果胶质量分数与PG和Cx活力均呈极显著正相关(P<0.01);各处理组果实原果胶质量分数与PG和Cx活力均呈极显著负相关(P<0.01),对照组和10、20 mg/L处理组果胶质量分数与β-Gal活力显著负相关(P<0.05);纤维素质量分数与PG、Cx活力极显著负相关(P<0.01)或显著负相关(P<0.05),对照组和20 mg/L处理组纤维素质量分数与β-Gal活力显著负相关(P<0.05)。
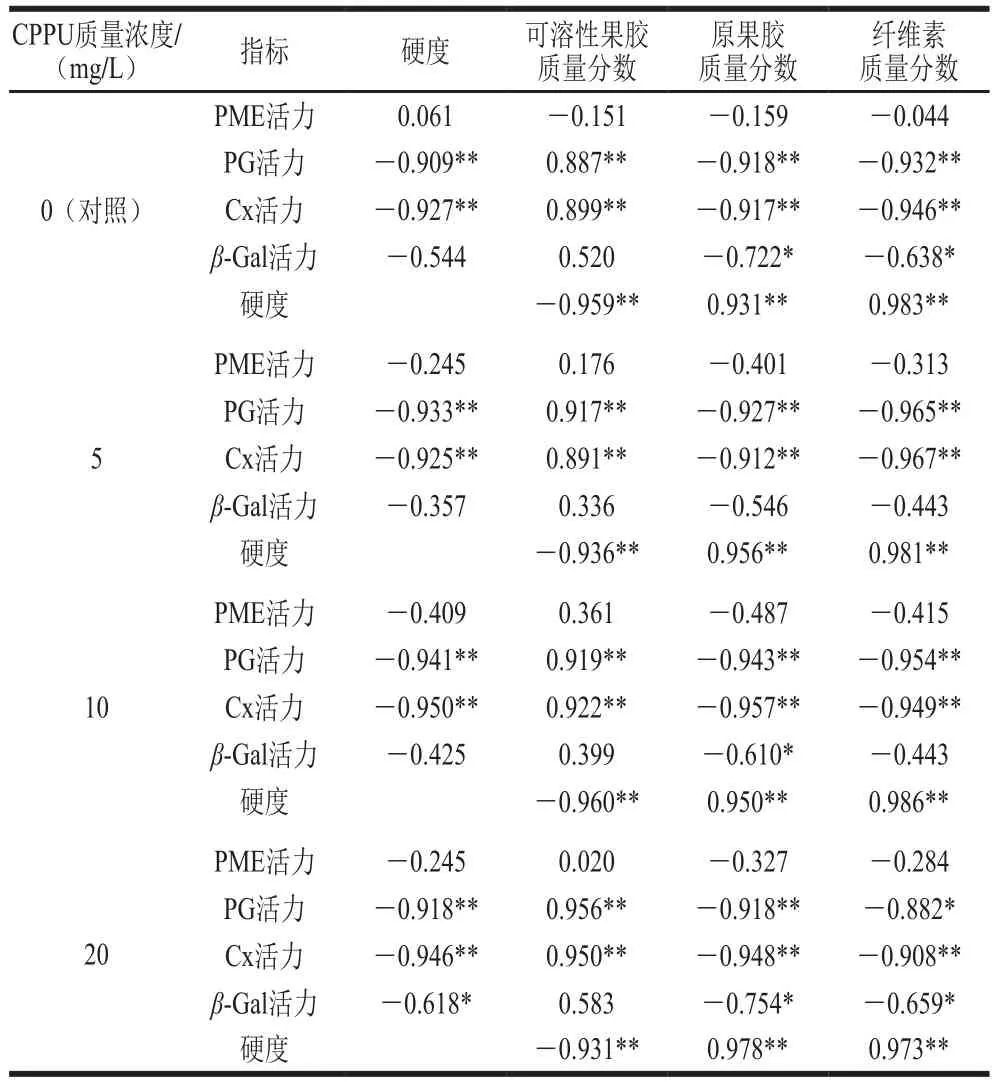
表1 果实硬度、细胞壁组分及其降解酶活力之间的相关性Table1 Correlation analysis of fruit firmness, cell wall components and cell wall degrading enzyme activities
3 讨 论
细胞壁的完整性直接决定了果实的硬度[26],而硬度的下降与细胞壁降解酶活力相关。果胶和纤维素是构成细胞壁的重要物质,果实在成熟期间,果胶和纤维素降解,细胞壁变薄,其支持作用变弱甚至消失,个体细胞逐渐变形、细胞间变得松散,导致果实逐渐变软,硬度下降。本研究结果显示,果实刚采收时硬度很高,果胶物质以原果胶形式为主,随着果实的后熟软化,可溶性果胶质量分数逐渐升高,同时纤维素质量分数也逐渐降低,且随CPPU使用质量浓度的增高,可溶性果胶质量分数越高,纤维素质量分数越低。与对照处理相比,10、20 mg/L CPPU处理加速了原果胶的降解和可溶性果胶质量分数的升高,同时20 mg/L CPPU处理也促进了纤维素的降解。相关性分析表明,各处理组细胞壁物质中原果胶、可溶性果胶和纤维素质量分数与硬度均达极显著的相关水平。
果实质地软化主要是细胞壁降解酶水解细胞壁多糖,使细胞间连接减少,导致细胞离散的缘故[10,27],且这些酶在果实软化的不同阶段起不同的作用[28]。本研究结果显示,各处理组果实硬度与PG和Cx活力呈极显著负相关(P<0.01),PG和Cx对‘秦美’猕猴桃果实软化的贡献大于PME和β-Gal,PME和β-Gal可能在果实软化早期起主要作用;20 mg/L处理组果实的硬度与β-Gal活力呈显著负相关(P<0.05),高质量浓度CPPU在一定程度上能增强β-Gal活力与硬度的相关性。PME、PG活力均随贮藏时间的延长呈先上升后下降趋势,CPPU处理质量浓度越高,酶活力越高,处理组的酶活力始终高于对照组,且PG活力高峰出现时间较PME晚,这与纪淑娟等[29]在蓝莓的研究中结果相似,这可能是由于PME的作用是去除果胶分子链上的半乳糖醛酸羧基上的酯化基团,为PG提供合适的作用底物,进而使PG沿多聚半乳糖醛酸主链水解果胶酸,导致果胶降解,PME并没有直接参与果胶分子的降解过程;Cx活力的上升引起纤维素的解聚从而导致细胞壁解体,CPPU处理质量浓度越大,果实Cx活力越高,硬度下降越快。β-Gal可以降解果胶中的半乳聚糖,使细胞壁组分不稳定[30],导致果实软化。本研究结果表明,经CPPU处理的果实β-Gal活力在贮藏前15 d快速达到最大值,且加速了酶活力高峰出现的时间;由此可推测,CPPU加速了果实的软化,β-Gal可能在果实软化的初期起重要作用,其中20 mg/L处理组果实β-Gal活力的升高与果实硬度的下降显著相关。
同时,在果实后熟衰老过程中,细胞壁物质的降解受各细胞壁降解酶活力的影响也不尽相同。各处理组果实果胶物质和纤维素的质量分数均与PG和Cx活力呈极显著相关(P<0.01),与PME活力无显著相关性;β-Gal活力与可溶性果胶质量分数无显著相关性,但与对照组和10、20 mg/L处理组原果胶质量分数显著相关(P<0.05),具体原因需进一步探究。
猕猴桃生长期CPPU的使用会增强果实PME、PG、Cx和β-Gal的活力,加速贮藏期果实细胞壁中原果胶、纤维素等物质的分解,导致果实软化加快,降低果实耐藏性。为延长猕猴桃的贮藏时间,防止在贮藏和销售过程中果实硬度下降速度过快,生产中不宜使用CPPU,或使用的CPPU质量浓度不宜超过5 mg/L。
