兰坪虫草的缓解运动疲劳功能
2018-11-29张艳艳
孔 娜,虞 泓,张艳艳,葛 锋,3,*
(1.昆明理工大学生命科学与技术学院,云南 昆明 650500;2.云南大学中草药生物资源研究所云百草实验室,云南 昆明 650091;3.昆明市虫草生物资源开发利用工程技术研究中心,云南 昆明 650091)
疲劳是身体在高强度或长时间活动后,产生的一种生理或心理现象,表现为身体困倦、精神倦怠、注意力减退、工作效率下降,经常处于疲劳状态就会发展为病理性损害。通过有针对性的补充外源营养补剂或药物来缓解疲劳的发生,是解决疲劳的有效方法。因此在天然产物中寻找、筛选具有抗疲劳作用的有效成分、探究其作用机制具有重要现实意义[1-4]。
冬虫夏草(Ophiocordyceps sinensis)是名贵中药材,其生物活性物质包括多糖、核苷、麦角固醇和甘露醇等。冬虫夏草具有补肾益肺、抗炎、抗疲劳、抗氧化、抗肿瘤等药理作用[5]。兰坪虫草(Ophiocordyceps lanpingensis,OL)是一种寄生在钩蝠蛾幼虫上的虫草真菌,主要分布于我国滇西北地区,是近几年发现的线虫草属新种[6]。OL与冬虫夏草亲缘关系较近,富含虫草多糖、核苷类、甾醇类、氨基酸等多种活性物质,其主要成分在种类与含量方面与冬虫夏草相似,且易人工培养,具有替代冬虫夏草入药的潜力,研究开发OL具有重要的理论研究和实际应用价值[6]。目前,本实验室已实现OL的规模化培养[7],为深入开展人工培养OL的活性成分以及功能研究提供了支撑。本实验依照《保健食品检测与评价技术规范》中有关抗疲劳功能的测定方案[8],研究了OL菌粉的抗疲劳作用。
1 材料与方法
1.1 动物、材料与试剂
SPF级雄性昆明鼠,质量18~22 g,购于辽宁长生生物技术有限公司,许可证号:SCXK(辽)2010-0001。
OL菌粉 云南云百草生物技术有限公司;西洋参云南向辉药业有限公司;0.5%羧甲基纤维素钠溶液生工生物工程股份有限公司。
血清尿素氮(blood uria nitrogen,BUN)测定试剂盒、血乳酸(blood lactic acid,BLA)测定试剂盒、乳酸脱氢酶测定试剂盒、肌酸激酶测定试剂盒、蒽酮试剂南京建成生物工程有限公司。
1.2 仪器与设备
Auegra x-22R高速低温离心机、LH750血液分析仪美国贝克曼库尔特有限公司;Ultrospec 2100pro紫外分光光度计 美国GE公司;XO-SM100超声微波组合反应装置 南京先欧仪器制造有限公司;HH-4水浴锅常州智博瑞仪器制造有限公司;DHG-9146A电热恒温鼓风干燥箱 上海精宏实验设备有限公司。
1.3 方法
1.3.1 OL有效成分的检测
OL菌粉D-甘露醇含量测定参照文献[9]:采用水提回流离心的方法,提取分离OL菌粉D-甘露糖,用高碘酸钠与甘露醇反应产生黄色物质,在412 nm波长处测定其最大OD值。甘露醇质量浓度在10~50 mg/L之间时,与OD412nm有良好的线性关系,以OD412nm为纵坐标,D-甘露醇质量浓度为横坐标绘制标准曲线,得回归方程为Y=0.010 2X-0.003 1,R2=0.999 6;多糖含量采用苯酚-硫酸法[9-10]测定:以葡萄糖为对照品,取供试品溶液0.2 mL至具塞试管中,加入1 mL体积分数6%重蒸苯酚、5 mL浓硫酸,混匀,室温放置10 min,40 ℃水浴15 min,冷却至室温,摇匀,在490 nm波长处测定吸光度,以吸光度Y为纵坐标,葡聚糖质量X为横坐标绘制标准曲线,得回归方程为Y=0.011 5X-0.003 8,R2=0.999 5,用上述方法测定样品中多糖含量;黄酮含量采用Al(NO3)3-NaNO2-NaOH显色法[11]测定:分别加入芦丁标准溶液1、2、3、4、5 mL于5 支15 mL的刻度试管中,然后加入0.3 mL质量分数0.5%的NaNO2,静置6 min。加入4 mL NaOH溶液,最后用蒸馏水定容至10 mL,在室温条件下反应15 min后,于510 nm波长处测定吸光度,以吸光度为纵坐标,黄酮浓度为横坐标绘制标准曲线,建立回归方程Y=0.001 2X-0.009 8,R2=0.999 6,用上述方法测定样品黄酮含量;腺苷含量通过建立高效液相色谱法[12]测定:采用ACCLAIM C18色谱柱(250 mm×4.6 mm,5 µm);柱温30 ℃;流动相甲醇-水(体积比15∶85);流速1.0 mL/min;紫外检测波长260 nm,制备标准液注入液相色谱仪中,以进样量为纵坐标,峰面积为横坐标绘制腺苷标准曲线:Y=0.021X。制备样品溶液注入高相液相色谱仪中,测定腺苷浓度。
1.3.2 动物分组与灌胃
实验小鼠饲养条件:温度18~22 ℃、相对湿度50%~55%,自然光照,自由饮水。小鼠给予基础饲料饲养一周,小鼠随机分为5 个实验组,每组10 只,分别为OL低剂量组(OLL组,OL灌胃剂量450 mg/(kg·d))、中剂量组(OLM组,OL灌胃剂量900 mg/(kg·d))、高剂量组(OLH组,OL灌胃剂量1 800 mg/(kg·d))以及空白对照组(BC组,灌胃蒸馏水900 mg/(kg·d))、阳性对照组(AG组,西洋参灌胃剂量600 mg/(kg·d)),每周称体质量一次,根据小鼠体质量给予不同剂量的受试物,连续灌胃30 d。称取10 g OL菌粉溶于100 mL质量分数0.5%的羧甲基纤维素钠溶液,4 ℃冰箱保存。连续灌胃30 d。给药期间记录小鼠初始体质量和终末体质量,并每周记录小鼠的摄食量。
1.3.3 负重游泳实验
小鼠负重游泳实验末次给予受试药物30 min后,将鼠尾根部负荷其体质量5%的铅皮,置小鼠于游泳箱(50 cm×50 cm×40 cm)中游泳,水深30 cm,水温25 ℃,记录小鼠自游泳开始至死亡的时间(小鼠鼻孔10 s内不能浮出水面),即小鼠负重游泳时间。
1.3.4 BUN浓度、乳酸脱氢酶等指标的测定
小鼠末次给予受试药物30 min后,将小鼠放于游泳箱中不负重游泳90 min,休息60 min后小鼠摘眼球取血,置于4 ℃冰箱约3 h。血液凝固后,血液样品以3 000 r/min离心10 min分离血清,取血清备用。用试剂盒测定BUN浓度,乳酸脱氢酶、肌酸激酶活力及血糖浓度。
马太太笑道:“易先生你太太不像你说话不算话,上次赢了不是答应请客,到现在还是空头支票,好意思的?想吃你一顿真不容易。”
1.3.5 BLA浓度的测定
小鼠末次给予受试药物30 min后,将小鼠放于游泳箱中不负重游泳10 min,水温(30±1)℃,并于游泳前、后立即休息20 min,然后用毛细管眼球内眦部取血20 μL。用乳酸试剂盒测定BLA浓度,并计算BLA曲线下面积,即BLA曲线下面积=5×(游泳之前BLA浓度+3×游泳后0 min的BLA浓度+2×游泳后休息20 min后的BLA浓度)。
1.3.6 肝和血浆中抗氧化参数的检测
将1.3.4节小鼠脱颈椎处死,摘眼球取血(加抗凝剂),用于血液生化指标检测。取肝脏经生理盐水漂洗后滤纸吸干,取组织块用冰冷的生理盐水匀浆制备体积分数10%组织匀浆,利用抗氧化酶试剂盒测定抗氧化酶活力。
1.3.7 LG含量测定及血液参数指标的检测
小鼠肝糖原(liver glycogen,LG)的含量利用蒽酮试剂测定。末次给予受试物30 min后脱颈椎处死,取肝脏经生理盐水漂洗后滤纸吸干,精确称取肝脏0.1 g于离心管中,加入质量分数5%三氯醋酸8 mL,每管匀浆1 min,匀浆离心得上清液,取上清液1 mL,然后加入体积分数95%的乙醇溶液4 mL,室温下竖立放置过夜。沉淀完全后,3 000 r/min离心15 min获得沉淀物,加入2 mL蒸馏水溶解沉淀物,再加入蒽酮试剂,在所有离心管达到室温后,将其浸入沸水浴15 min后,然后移入冷水浴。将离心管内液体移入比色管,使用分光光度计在620 nm波长处检测吸光度。计算糖原含量并进行统计分析;脱颈椎处死时取血加抗凝剂利用LH750血液分析仪检测血液参数指标。
1.4 数据统计分析
数据处理和统计分析采用Excel和SPSS 20.0软件,各组间数据采用方差分析,按方差程序先进行方差齐性分析检验,方差齐用Duncan方法计算F值比较各组间的差异性,方差不齐用Dunnett’s T3及非参数检验统计学处理比较各组间的差异有无显著性,P<0.05认为差异显著,数据表示为平均值±标准差。
2 结果与分析
2.1 OL对小鼠体质量和摄食量的影响

表1 OL对小鼠体质量的影响(n=10)Table1 Effect of OL on body mass of mice (n= 10)g

表2 OL对小鼠摄食量的影响(n=10)Table2 Effect of OL on food intake of mice (n= 10)g
2.2 OL有效成分含量
通过测定,发现OL的D-甘露醇、黄酮、多糖和腺苷含量分别为(25.65±10.42)、(0.98±0.20)、(46.46±19.76)mg/g和(451.61±125.42)μg/g。已有研究表明,黄酮具有自由基抑制活性,能增加机体的抗疲劳能力[13],多糖是一种广泛存在于天然产物中的大分子物质,具有广泛的药理学活性[14],并具有增强机体抗疲劳的能力[15]。
2.3 OL对小鼠负重游泳时间的影响

图1 OL对小鼠负重游泳时间的影响(n=10)Fig.1 Effect of OL on weight-loading swimming time of mice (n = 10)
运动耐力的提高是抗疲劳能力加强最有力的宏观表现,游泳时间的长短可以反映动物的疲劳程度。如图1所示,OLL、OLM、OLH组和AG组负重游泳时间与对照组比较明显延长(P<0.05),分别延长了47.4%、70.5%、71.7%和68.0%。说明OL能延长小鼠游泳时间,提高小鼠运动耐力,延缓疲劳发生。
2.4 OL对小鼠相关疲劳生化指标的影响
疲劳产生的重要原因是能源物质的消耗和代谢物质的积累[16]。常用的疲劳评价方法主要有两个:运动耐力实验和生化指标检测。在反映疲劳的生化指标中,BUN浓度、BLA浓度、LG含量等的改变具有代表性,也是检测疲劳最常用的指标[17]。BUN作为蛋白质和氨基酸的代谢产物,是评定机体对运动适应能力的重要指标之一,当机体长时间活动不能通过糖和脂肪分解代谢得到足够的能量时,机体蛋白质和氨基酸分解代谢随之增强,血清BUN浓度随运动负荷的增加而增加。

图2 OL对小鼠血液生化指标的影响(n=10)Fig.2 Effect of OL on blood biochemical indices of mice (n = 10)
由图2A可知,OLM组和OLH组BUN浓度与BC组相比显著降低(P<0.05),说明OL能减缓剧烈运动中蛋白质的过量分解,提高机体对剧烈运动的适应能力[18]。LG是重要的能源物质,机体血糖浓度降低时可迅速分解释放入血液中,以维持血糖水平的稳定[19]。实验结果表明,OLH组和AG组LG含量与BC组相比显著升高(P<0.05,P<0.01),说明OL能为机体提供能量来达到抗疲劳的目的。乳酸脱氢酶通常存在于肌细胞中并能释放入血液中,乳酸脱氢酶氧化释放乳酸并改变pH值,导致肌肉损伤。因此,乳酸脱氢酶可以作为检测疲劳的指标[20]。BLA是碳水化合物在厌氧条件下糖酵解的产物,持续运动会导致过量BLA的生成和积累,诱导身体产生疲劳。BLA的积累会导致血液pH值降低,危害各种器官进而导致疲劳[22]。如图2B所示,OLM、OLH、AG组乳酸脱氢酶活力显著低于BC组(P<0.05),能有效抑制运动后BLA的产生,增强小鼠运动耐力。说明适量OL能够调控BLA和乳酸脱氢酶的水平。血清肌酸激酶活力是评价骨骼肌损伤的一个重要指标,过度运动会对肌组织造成一定的损伤,导致肌酸激酶活力升高[21]。如图2C所示,OL能够显著降低游泳小鼠肌酸激酶活力(P<0.05)。

表3 OL对小鼠血液乳酸的影响(n=10)Table3 Effect of OL on blood lactic acid level of mice (n= 10)
如表3所示,OLM、OLH、AG组与BC组比较,小鼠运动前后BLA浓度显著降低(P<0.05)。OLL组也能一定程度上降低小鼠体内BLA浓度,但与BC组相比,无显著性差异。说明适当剂量的OL具有抑制运动过程中BLA浓度升高的作用,对缓解疲劳有一定帮助。
2.5 OL对小鼠肝脏和血液氧化应激参数的影响
剧烈运动过程中,能量高消耗会引起氧化系统和抗氧化系统的失衡,导致活性氧的增加和抗氧化剂的减少,骨骼肌活性氧过剩,最终引起外周疲劳[23-25]。人吸氧量的2%~3%经过新陈代谢会转化为氧自由基。一方面,氧自由基作为信号分子,参与正常的生理过程;另一方面,过量的氧自由基能引起氧化应激、细胞损伤和肌肉疲劳[26]。为维持体内平衡,过量的氧自由基需要抗氧化剂清除,超氧化物歧化酶(superoxide dismutase,SOD)和过氧化氢酶(catalase,CAT)是重要的清除自由基和代谢产物的抗氧化酶。SOD对机体的氧化和抗氧化平衡起着至关重要的作用,它能清除超氧阴离子自由基以保护细胞免受损伤[27]。
由表4可知,在肝脏中,AG组SOD活力极显著高于BC组(P<0.01),OL各剂量组SOD活力显著高于BC组(P<0.05);OLM和AG组能显著提高CAT活力(P<0.05)。同时,在血液中,OL各剂量组均能显著提高SOD活力(P<0.05),OLL组和OLM组能显著提高CAT活力(P<0.05)。说明OL有可能通过提高机体SOD和CAT活力,增加抗氧化能力,进而减少自由基的积累,加速体内脂质过氧化物的及时清除,增强小鼠运动耐力和抗疲劳作用。
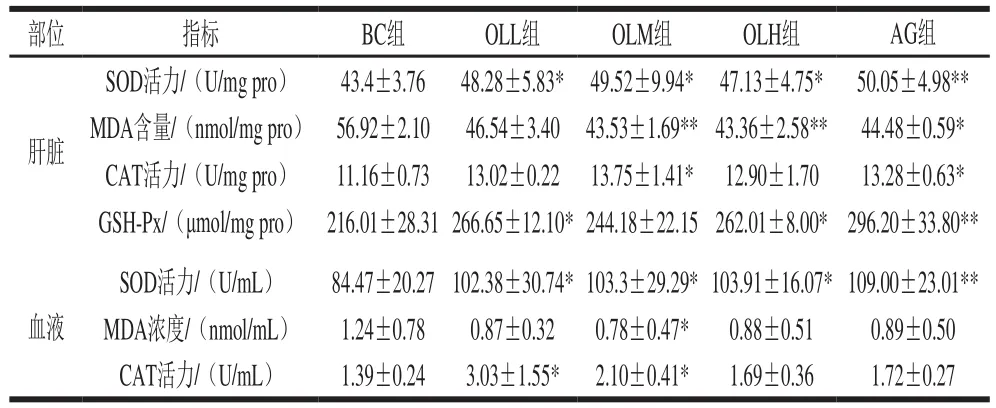
表4 OL对小鼠肝脏和血液抗氧化指标的影响(n=10)Table4 Effect of OL on liver and blood antioxidant indices of mice (n= 10)
丙二醛(malondialdehyde,MDA)是一种脂质过氧化产物,是评估细胞氧化应激的重要指标。机体在代谢过程中产生自由基,自由基能攻击生物膜中的多不饱和脂肪酸,引发脂质过氧化作用,并因此形成脂质过氧化物。通过测定MDA含量可以反映机体脂质过氧化的程度,间接表明细胞损伤的程度[28]。肝脏中,OLM组和OLH组MDA含量极显著低于BC组(P<0.01),AG组MDA含量与BC组比较也有显著性差异(P<0.05)。血液中,OLM组MDA浓度与BC组比较也有显著性差异(P<0.05)。以上研究结果表明,OL可以减弱运动过程中的细胞氧化应激反应,降低脂质过氧化程度,维持细胞正常生理功能,从而体现抗疲劳作用。谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)催化过氧化氢分解的关键酶,广泛存在于机体组织中。它特异性催化GSH对过氧化氢的反应,起到保护细胞膜结构和功能完整的作用[29]。AG组GSH-Px活力显著高于BC组(P<0.01),OLL、OLM组GSH-Px活力与BC组比较也有显著性差异(P<0.05)。本研究中,OL剂量组的CAT、SOD和GSH-Px活力与BC组相比,均有导致生理效应趋好的效果。此结果与冬虫夏草相关报道一致,冬虫夏草具有抑制MDA生成,清除氧自由基、羟基自由基和超氧化物阴离子的作用[30]。抗氧化酶活力的提高能够缓解运动疲劳[31]。综合上述结果,可以认为OL具有较好的抗氧化作用,而口服抗氧化剂已经被证明能够降低氧化应激反应,缓解肌肉疲劳,提高运动能力[32]。因此,OL抗氧化作用可能是其具有抗疲劳功效的机理之一。
2.6 OL对小鼠血液参数的影响
血红蛋白作为疲劳恢复程度的重要指标,是红细胞的主要成分,主要功能是运输氧气和二氧化碳,保证机体氧气供应充足,进而促进机体有氧代谢,提高运动耐力。研究表明运动可以诱发血液单核细胞的变化,如淋巴细胞、单核细胞、白细胞[33]。

表5 OL对小鼠血液相关指标的影响(n=10)Table5 Effect of OL on fatigue-related blood indices of mice (n= 10)
由表5可知,与BC组相比,OL各剂量组血红蛋白质量浓度和红细胞浓度均有所提高,OLL、AG组血红蛋白质量浓度极显著升高(P<0.01)。AG组白细胞和淋巴细胞浓度极显著高于BC组(P<0.01),OLM组白细胞和淋巴细胞浓度与BC组比较也显著升高(P<0.05)。研究表明OL能维持或增加血红蛋白和红细胞浓度,保证机体氧气供应充足,提高有氧代谢能力,缓解疲劳。
3 结 论
OL能够通过增加机体肝糖原储备,减少BUN、BLA等代谢产物的产生和积累,提高机体SOD、GSH-Px、CAT活力,加强对自由基的清除,增加血液红细胞、血红蛋白含量来增加氧气和二氧化碳的运输效率,缓解运动疲劳。而且其功效与已有的具备明确改善机体抗疲劳药效的药物相似。本研究为充分利用OL,将OL开发为抗疲劳的运动营养剂提供了参考。
