GRHPR在肝细胞癌组织和细胞中的表达及意义
2018-11-29潘英连邓青春许丹妮孙华茂曾江正陈不尤卢彦达
潘英连,邓青春,许丹妮,孙华茂,曾江正,陈不尤,卢彦达△
(1.海南医学院第一附属医院肿瘤内科,海口 570102;2.海南医学院第二附属医院妇产科,海口 570102; 3.南通大学医学院附属医院放疗科,江苏南通 226001)
肝细胞癌(HCC)的发病因素很多,除了乙型肝炎病毒(HBV)感染,丙型肝炎病毒(HCV)感染外,还有很多慢性肝脏疾病,如慢性酒精性肝病,非酒精性脂肪肝脏疾病,以及代谢紊乱疾病也是HCC发生与流行的主要因素。其中,代谢综合征和非酒精性脂肪肝病在癌症发生过程中没有肝硬化的表现,引起了人们相当程度的关注[1-3]。目前已经有大量关于代谢产物和代谢途径异常与HCC发生、发展关系的研究。有研究发现,尿中糖代谢物质可以作为HCC的诊断标志物[4-6]。
乙醛酸还原酶/羟基丙酮酸还原酶(GRHPR)的基因位于人类9号染色体着丝点,人和鼠GRHPR基因结构一致,但是剪切位点存在差异性,并且内含子的区域差异性也较大,在肝脏中表达最高[7-8]。在基因调节和蛋白质相互作用的研究中,与GRHPR相关的主要有过氧化物酶体活化受体α(PPARα)。PPARα参与多种代谢途径基因转录调控,调节过氧化物酶体和线粒体脂肪氧化分解,胆汁酸和氨基酸代谢、葡萄糖稳态、生物转化、炎症,龋齿类动物肝癌形成[9]。GENOLET等[10]发现PPARα配体调节龋齿类动物中GRHPR基因表达、肝癌形成,不能调控人类GRHPR的表达。GRHPR具有两种酶活性:羟基丙酸还原酶(HPR)和D-甘油酸脱氢酶(DGDH)活性,两种活性维持平衡状态。NADH/NAD+比例异常是人体代谢异常产生的原因之一[11]。然而生化证据表明GRHPR利用NADPH作为辅酶生成NADP+,为磷酸戊糖途径提供NADP,为人体提供必需的核糖和多个代谢反应所需的供氢体NADPH[12]。由此可见,GRHPR在细胞糖代谢,能量稳态中发挥着重要作用。
GRHPR既然是存在于肝脏的一种酶,并且参与多个代谢途径,因此推测它的异常也可能与肝脏疾病具有相关性。在本研究中发现GRHPR在HCC中严重减少,在某些病例中甚至缺失。这个发现引起了作者极大的兴趣。
1 资料与方法
1.1一般资料
1.1.1细胞株和主要试剂 人类组织来源肝癌细胞SMMC-7721、Huh7、HepG2、Hep3B细胞及人肝细胞系Lo2均购自中国科学院细胞库上海保藏中心。DMEM 培养基、胎牛血清购自美国Gibco 公司。细胞总蛋白抽提试剂盒、β-actin抗体、辣根过氧化物酶标记的山羊抗兔IgG抗体、BCA 蛋白测定试剂盒购自上海碧云天生物技术有限公司,兔抗人GRHPR购自SANTA CRUZ公司。
1.1.2组织来源及患者资料 原发性肝癌石蜡标本120份,选自南通市肿瘤医院,标本均为2003-2006年手术切除标本,病理诊断明确,切缘均大于1 cm,并且有完整的临床病理资料。标本来源患者中,男96例,女24例,中位年龄49.2岁;肝癌直径<5 cm 60例,肝癌直径>5 cm 60例;组织学分化分级:高分化12例,中分化64例,低分化44例;转移病例(包括淋巴结转移、门静脉癌栓和远处转移)19例,无转移病例101例;合并肝硬化98例;HBsAg阳性87例;患者随访1~91个月,中位数41.5个月。肝癌及配对的癌旁组织新鲜标本8份,取自南通市肿瘤医院,用作冰冻切片和蛋白提取,新鲜组织离体后30 min内置于-80 ℃冰箱内保存。所有患者的最终诊断均经两位病理医师复诊确认。
1.2实验方法
1.2.1细胞培养条件 Lo2、SMMC-7721、HuH7、HepG2 和Hep3B细胞分别用DMDM、RPMI 1640完全培养基(含10%胎牛血清、2 mmol/L L-谷氨酰胺、100 U/mL青霉素和100 μg/mL链霉素),5% CO2、饱和湿度、37 ℃培养箱内常规培养传代。收集处于对数生长期的细胞进行实验。各项实验至少重复3次。
1.2.2Western blot法检测正常肝细胞和HCC细胞中GRHPR蛋白的表达 收集足量的SMMC-7721、Huh7、HepG2、Hep3B和Lo2 细胞,以细胞裂解液提取总蛋白,应用BCA蛋白定量法进行蛋白定量,10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转膜,封闭。以兔抗人GRHPR(1∶500) 或β-actin 抗体(1∶500)、辣根过氧化物酶标记的鼠抗兔IgG二抗(1∶1 000)室温孵育1 h,电化学发光法显影并拍照。
1.2.3组织微阵列 将数十个、数百个乃至数千个小的组织片整齐地排列在某一载体上(通常是载玻片)而成的微缩组织切片。
1.2.4免疫组织化学结果判定标准 GRHPR、Ki-67的统计学分析是根据国际半定量Remmele Score方法来进行统计的。统计方法:每个标本组织根据染色强度分为4等(I0为无着色,I1为弱着色,I2为中等着色,I3为强着色),根据阳性细胞百分比分为5等(P0为无着色,P1为≤10%的阳性细胞,P2为>10%~50%的阳性细胞,P3为>50%~80%的阳性细胞,P4为>80%的阳性细胞)。染色结果=染色强度×阳性细胞百分比。每个结果由2位经验丰富的病理学者,在电子显微镜下计数,若2位病理学者之间存在误差(P>0.5)时,则要对该标本重新计数。
1.3统计学处理 运用SPPSS11.0统计软件(Chicago,Ⅲ,USA),受试者工作特征(ROC)曲线分析找到GRHPR阳性的切点。对GRHPR和Ki-67在HCC中的表达与相应的临床病理学特征之间的关系采用χ2检验或Fisher精确概率法分析。HCC中GRHPR和Ki-67表达间的相互关系采用Pearson相关分析。Log-rangk检验生存曲线统计学差异,Kaplan-Meier分析患者的总体生存率曲线和5年生存率曲线。以P<0.05为差异有统计学意义。
2 结 果
2.1GRHPR在HCC中表达 Western blot检测8例人肝癌及癌旁新鲜组织中GRHPR表达,在相对分子质量>35×103可以得到GRHPR的清晰条带,结果显示:GRHPR在HCC中的表达明显低于对应癌旁组织,癌旁组织中均可检测到GRHPR的表达,而对应的癌组织中低表达或缺失表达(图1)。

T:来自于HCC组织;N:来自于对应的癌旁组织;β-actin:内参对照
2.2GRHPR在HCC细胞株和正常肝细胞株中的表达 检测正常肝细胞株Lo2和肝癌细胞株Huh7、HepG2、Hep3B、SMMCC-7721中GRHPR蛋白质表达,Western blot结果显示,GRHPR在肝癌细胞株中有所表达,并且明显低于正常的肝细胞系(P<0.05,图2)。
2.3GRHPR在人肝癌及癌旁组织微阵列中的表达 免疫组织化学检测120例HCC及癌旁组织石蜡切片,结果GRHPR在HCC和癌旁组织中的表达形式,见图3。表达定位于细胞质,细胞核无定位,染色呈棕黄或棕褐色,细胞核蓝色,T+N+:癌和癌旁组织GRHPR均高表达的;T+N-:癌组织高表达而癌旁组织低表达;T-N+:癌组织表达阴性而癌旁组织高表达;T-N-:癌组织和癌旁组织中均呈现低表达。直方图显示在癌组织中GRHPR定量计数偏低的病例较多,而在癌旁组织中结果相反(图4)。箱式图统计结果显示在癌组织及癌旁组织中GRHPR表达平均值分别为1.12±0.19和2.04±0.27(P<0.05,图5)。ROC曲线确定GRHPR表达阳性和阴性切点值为1.53,AUC=0.74(AUC>0.50),诊断试验具有准确性(图6)。

A:GRHPR在不同细胞中的表达;B:灰度值检测

T+N+:在HCC和癌旁组织中均阳性;T+N-:GRHPR在癌中阳性表达而在癌旁中阴性表达;T-N+:GRHPR在癌中阴性而在癌旁阳性表达;T-N-:GRHPR在癌及癌旁中均阴性

A:HCC组织;B:癌旁组织

图5 GRHPR在HCC和癌旁组织表达箱式图

图6 ROC曲线图
2.4GRHPR与HCC临床病理因素的相关性 对进行了免疫组织化学实验的120例HCC患者的石蜡切片标本进行统计,GRHPR根据ROC曲线最左上角切点值1.53,将其分为高表达组和低表达组,分析GRHPR的表达与肝癌患者临床病理特征之间的关系。分析显示HCC组织中GRHPR的表达强度与肝癌患者肿瘤病理分化程度(P=0.003)、肿瘤大小(P=0.015)、甲胎蛋白(P=0.003)、乙型肝炎病毒表面抗原(P=0.010)相关,差异有统计学意义,与患者的性别、年龄、肿瘤结节多少及是否伴有肝硬化状态无关(P>0.05);在癌旁组织中,GRHPR与肿瘤大小相关(P=0.01),与患者的性别、肿瘤结节多少及是否伴有肝硬化状态等无关(P>0.05),见表1。

表1 GRHPR蛋白表达与HCC患者临床病理特征的关系(n)
2.5免疫组织化学检测HCC中GRHPR、Ki-67表达 Ki-67与GRHPR表达结果呈反向趋势的,GRHPR阴性表达(表达强度评分=0.66)的病例中,Ki-67呈强阳性表达(阳性百分比=0.63),而在GRHPR强阳性表达(表达强度评分=3.00)的病例中,Ki-67呈弱阴性表达(阳性百分比=0.06),见图7。
2.6GRHPR、Ki-67二者相关性分析 根据免疫组织化学的染色结果,Pearson相关系数法分析显示120例肝癌组织中,GRHPR和Ki67的表达呈负相关(r=-0.870,P<0.05,图8)。
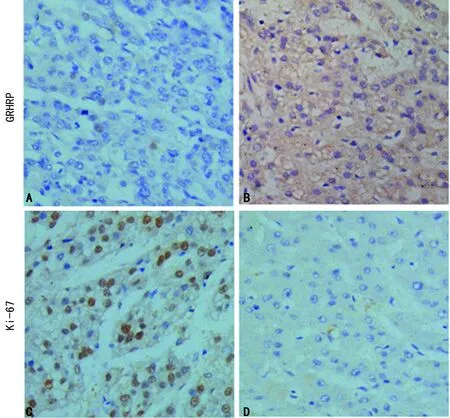
A、B:GRHPR和Ki67在同一例HCC组织中GRHPR阴性表达,而对应Ki67阳性表达;C、D:同一例HCC组织中GRHPR阳性性表达,而对应Ki67阴性表达

图8 Pearson相关系数法分析GRHPR和Ki-67表达在HCC中的相关性
2.7GRHPR在HCC患者中生存率的评价 将GRHPR按T+N+,T+N-,T-N+,T-N-分组,经Kaplan-Meier法分析得到HCC患者5年无病生存率:T+N+组生存期为59.8个月(SE 5.7;95%CI:48.6~70.9),T-N+组49.4个月(SE 4.0;95%CI:41.4~57.4),T+N-组27.3个月(SE 9.0;95%CI:9.6~44.0),T+N-组10.1个月(SE 3.2;95%CI:5.9~14.3;P<0.01)。总体生存率T+N+组生存期中位数66.8个月(SE 6.2;95%CI:54.6~79.0),T-N+组56.4个月(SE 4.9;95%CI:47.0~66.0),T+N-组25.0(SE 7.8;95%CI:9.6~40.3),T-N-组10.0个月(SE 2.1;95%CI:5.9~14.3),T-N-患者5年无病生存率及总体生存率的显著降低(P<0.01),见图9。
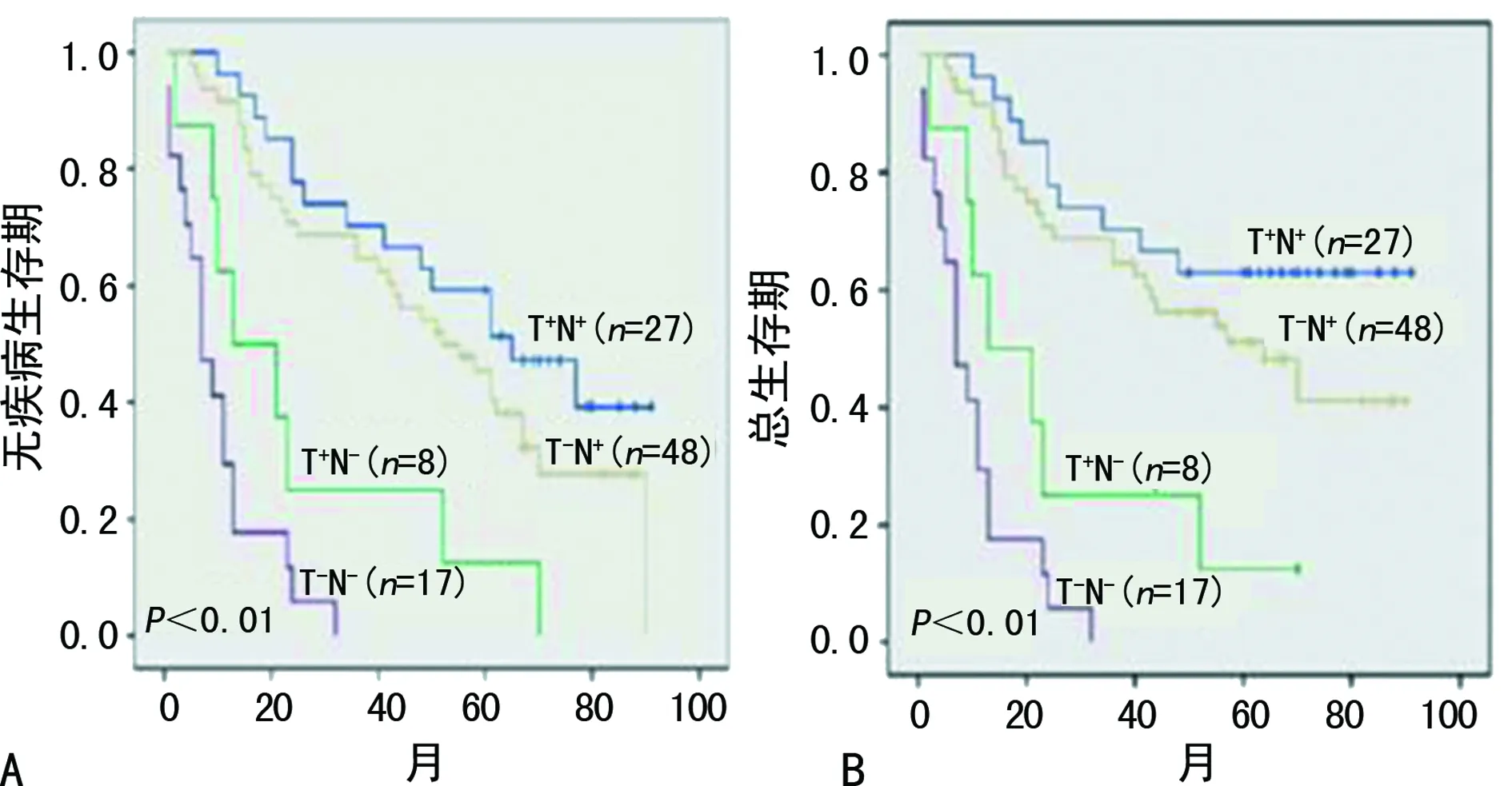
HCC和癌旁组织中GRHPR均阳性表达的T+N+组获得较高的生存率;GRHPR均阴性表达T-N-组的患者生存率低
3 讨 论
最初的研究发现,GRHPR在HCC中和肝癌细胞株中表达较少或缺失。这个发现提示,GRHPR在HCC中表达下降可能不仅仅是一种独立的表面现象,于是引起了作者进一步关注。进一步发现GRHPR在增殖的细胞中表达下降,并且发现GRHPR与HCC预后有关。
为了探讨GRHPR与HCC之间的联系,首先,通过Western blot检测8例HCC及相应癌旁组织中GRHPR表达,发现癌组织中GRHPR表达低于癌旁组织,在肝癌细胞株中也获得一致结论,HCC细胞株GRHPR表达相对于正常细胞株表达少,说明GRHPR在HCC与相邻的“正常”组织表达存在差异,在肿瘤发生、发展中逐渐表达下降或者缺失。然后采用免疫组织化学方法检测了120例HCC患者癌及癌旁组织中GRHPR的表达,同样也得到GRHPR在HCC组织中表达低于相邻癌旁组织的结论,根据GRHPR在HCC和癌旁表达情况,将患者主要分4个亚类,分别为T+N+、T+N-、T-N+、T-N-,总体频数分布结果显示,在HCC中,GRHPR表达强度评分总体偏低,然而在癌旁组织中,GRHPR表达强度评分总体偏高。临床病理相关分析显示,在HCC中,GRHPR阳性表达与癌的分化级别,转移与否,癌灶大小,乙型肝炎病毒表面抗原具有相关性,差异有统计学意义。Ki-67是判断肿瘤侵袭力和肿瘤预后的有效指标。进一步分析GRHPR表达强度评分与Ki-67表达强度评分呈负相关性,说明GRHPR在HCC中与Ki-67不同,而是肿瘤发展中的一个保护性因素。根据随访结果,100例患者中(失访20例)分4个亚类,即T+N+、T+N-、T-N+、T-N+。从生存时间分析结果显示:T+N+亚类获得较好的预后,生存期中位数59.8个月,SE 5.7,95%CI:46.6~70.9;T-N+亚类生存期中位数49.4个月(SE 4.0,95%CI:41.4~57.4;T+N-亚类生存期中位数27.3个月(SE 9.0,95%CI:9.6~44.0);T-N-亚类生存期中位数10.1个月(SE 3.2,95%CI:5.9~14.3)。总之,GRHPR在HCC中缺失,并与HCC致癌过程相关,可能影响肝癌细胞生长和迁移等生物学行为。
近年研究已经证实代谢性疾病与恶性肿瘤存在共性的机制。在近几年,随着人们生活结构改变,代谢性疾病随之增加,例如非酒精性肝炎、2型糖尿病已经被证实与HCC致病有关[13-15]。本结果显示,无论GRHPR在癌组织中是否阳性表达,GRHPR在癌旁组织中阳性表达都能获得较高的生存期。这就表明GRHPR在相对“正常”肝脏组织是十分重要的代谢酶,并且在异常癌组织是患者预后因子之一。这些发现得到了进一步的关注,GRHPR是一种具有两种活性的酶,即促使HPR活性和DGDH活性。并且,两种活性维持平衡状态。因为GRHPR将乙醛酸还原为羟乙酸盐酶活性异常是导致2型高尿酸血症的原因。那么,HCC发生、发展可能与2型原发性高尿酸血症一样是因为GRHPR的HPR活性异常,也可能GRHPR的D-甘油酸脱氢酶活性发生改变参与肝癌进展中。由于目前本研究是回溯性的研究,有关肝癌发生与代谢性疾病相关的机制有待将来进一步探讨。
综上所述,本文是初步研究GRHPR在HCC中的作用,GRHRP在癌组织中的表达减少,在HCC细胞株中表达量相对正常细胞株表达减少,提示GRHPR在HCC中的表达与“正常”组织具有差异性,提示GRHPR对HCC可能具有诊断价值。分析GRHPR与核增殖指标相关性发现GRHPR与肿瘤的恶性程度和增殖活性呈负相关,提示GRHRP是肝癌的发生、发展的保护性因素。
