PM2.5致大鼠肺损伤模型中肺巨噬细胞NLRP3炎性小体活化研究
2018-11-29顾娜张桂贤史鹏程谭珵刘伟伟赵秀梅刘洪斌田瑛泽胡志洁
顾娜,张桂贤 ,史鹏程,谭珵,刘伟伟,赵秀梅 ,刘洪斌△,田瑛泽,胡志洁
大气细颗粒物(PM2.5)严重影响人类生命健康,尤其是与呼吸系统及心血管系统疾病发病率和死亡率直接相关[1-2]。PM2.5因直径微小,重力作用小,可沉积于细支气管和肺泡内并被肺泡内巨噬细胞吞噬。肺泡巨噬细胞(AM)是肺泡腔内常驻的免疫细胞,吞噬、免疫和分泌作用都十分活跃,是肺组织免疫系统的第一道天然屏障。空气中的尘粒(包括PM2.5)、细菌等异物进入肺泡和肺间质后多被巨噬细胞吞噬而形成尘细胞,吞噬异物的尘细胞,有的从肺泡腔经呼吸道黏液流动和纤毛运动被咳出,有的进入肺淋巴管随淋巴液进入肺淋巴结内。当肺泡巨噬细胞被过度激活后可释放多种炎症因子及炎症介质,造成炎症的级联瀑布反应,最终可导致肺损伤的发生[3]。核苷酸结合寡聚化结构域样受体蛋白3(nucleotide-binding oligomerization domain receptor protein 3,NLRP3)炎性小体是目前研究较为成熟的炎性复合体家族成员之一,是机体固有免疫的一部分,激活后参与免疫调节及抵抗外来病原体(例如细菌、病毒)的过程。NLRP3炎性小体过度激活参与许多肺部疾病[慢性阻塞性肺疾病(COPD)、哮喘等]的发病过程[4]。关于PM2.5的体内实验大多集中于支气管和肺泡上皮细胞,其对肺泡巨噬细胞内细胞因子的影响也仅局限于体外实验。本研究通过体内相关实验观察肺巨噬细胞内NLRP3炎性小体活化通路与PM2.5致肺损伤的关系,为今后的临床治疗和新药研发提供理论依据。
1 材料与方法
1.1 材料
1.1.1 试剂 磷酸盐缓冲液(PBS,北京中杉金桥生物技术有限公司);RPMI 1640培养基(GIBCO);小牛血清(杭州四季青生物工程材料有限公司);乙酸、无水乙醇(天津市化学试剂供销公司);二甲苯、中性树胶(国药集团);苏木素(Sigma);NLRP3兔多克隆抗体(Abcam);F4/80抗体(Santa Cruz);浓缩型正常山羊血清、荧光(FITC)标记羊抗小鼠IgG、荧光(Cy3)标记羊抗兔IgG(武汉博士德生物工程有限公司);DAPI(碧云天生物技术);抗荧光淬灭封片剂(SouthernBiotech);白细胞介素(IL)-18、IL-1β及半胱天冬酶-1(Caspase-1)的酶联免疫吸附测定(ELISA)试剂盒(南京建成生物工程研究所)。
1.1.2 仪器与设备 超声波清洗器(昆山市超声仪器有限公司);离心机(LD5-2B,北京京立离心机有限公司);多功能酶标仪infinite M200(瑞士TECAN公司);CO2培养箱(REVCO);显微镜(奥林巴斯BX53型生物显微镜);24孔板(美国COSTAR)。
1.2 方法
1.2.1 PM2.5的采集和处理 采样地点为南开大学理化楼楼顶,采样时间为2014年11月19日—2015年2月6日。PM2.5采用中流量采样器(TH-150C,天虹,中国)载带石英滤膜进行采样,设计流量100 L/min,每张滤膜连续采样22 h(即当日09:00—次日07:00),雨雪天停止采样。采样后将载有颗粒物的滤膜剪裁成3 cm×1 cm大小,浸入去离子蒸馏水中超声3次,每次振荡40 min洗脱颗粒物,震荡液经六层纱布过滤,滤液即为PM2.5混悬液,混悬液经冷冻真空干燥,低温冰箱保存备用。临用前称取处理好的PM2.5,用生理盐水配成所需浓度后超声振荡15 min,混匀并高压灭菌,4℃保存备用,液体1周内用完,临用前再次超声振荡使颗粒物充分混匀。
1.2.2 实验动物及造模 选用SPF级健康雄性大鼠32只,体质量250 g左右,购自中国人民解放军军事医学科学院卫生学环境医学研究所动物实验中心,许可证号:SCXK-(军)2014-0001。将动物按体质量随机分为4组,分别为对照组、低剂量组(5 mg/kg)、中剂量组(10 mg/kg)、高剂量组(15 mg/kg),每组8只动物。分组后将动物按1 mL/kg体质量腹腔注射戊巴比妥钠麻醉,取仰卧位固定,3~5 min待呼吸平稳后,消毒颈部皮肤,去毛、再消毒后,在颈部中线下段切开皮肤,用血管钳钝性分离皮下组织和肌肉,暴露气管(长约1 cm),在两气管软骨环之间刺入针头,经气管缓慢注入PM2.5悬液(体积为2 mL/kg体质量),注入后立即将大鼠直立并旋转,使颗粒物尽量均匀分布,待呼吸平稳后为预防感染在切口处滴注青霉素然后缝合切口;对照组气管滴注相应体积的生理盐水。灌注术后动物自由饮食、饮水,造模后3 d处死动物。
1.2.3 大鼠肺灌洗及肺巨噬细胞吞噬功能测定 造模结束后断头放血处死大鼠,暴露气管并剪一斜口,插入带有聚乙烯管的肺灌洗针头,结扎固定。缓慢注入PBS并缓慢抽出灌洗液,边操作边轻轻按摩胸部以增加灌洗液的洗出量。每只大鼠灌洗4次,记录每只大鼠灌洗液总量。将提取的灌洗液经4℃、1 000 r/min离心10 min,下层细胞沉淀用含10%小牛血清的RPMI 1640液调整细胞浓度至2×106/mL,取1 mL加入24孔板中,置37℃、含5%CO2培养箱孵育2 h,用PBS冲洗掉未黏附的细胞。每孔加入1 mL 0.1%的中性红溶液孵育15 min,弃去孔中溶液并冲洗未被吞噬的中性红,每孔加入1 mL现配的细胞裂解液(1∶1混合的乙酸和无水乙醇)静置过夜,在550 nm波长下用酶标仪比色,记录各孔光密度(OD)值,计算抑制率。抑制率=(1-实验组OD值/对照组OD值)×100%。
1.2.4 肺组织HE染色及病理学评分 末次染毒结束后断头放血处死大鼠,解剖取相应肺脏,10%的中性福尔马林固定、梯度脱水、正丁醇透明、石蜡包埋,间断连续切片(5µm厚),HE染色、脱水、透明、封片,做常规的病理学检查并进行肺组织损伤评分。评分标准如下:(1)肺间质水肿。(2)肺泡水肿。(3)炎细胞浸润。(4)肺泡出血。(5)肺泡结构完整性破坏。每项标准按无、轻、中、重分别标记为0、1、2、3分,然后累计总分为肺组织的病理评分[5]。
1.2.5 免疫组化检测NLRP3表达 将肺组织标本切片脱蜡和水化,微波抗原修复,3%的H2O2孵育30 min阻断内源性过氧化物酶,TBST洗涤5次,每次3 min。血清封闭,一抗NLRP3(1∶100)孵育过夜,TBST洗涤5次,每次3 min。滴加对应的山羊抗兔二抗(1∶5 000),室温孵育1 h,TBST洗涤5次,每次3 min。应用DAB溶液显色,PBS冲洗,苏木素复染、脱水、二甲苯透明,中性胶封片晾干,显微镜下观察肺组织内NLRP3蛋白的表达量。细胞胞浆有棕黄色颗粒为阳性,不着色者为阴性。每个标本随机读取10个不重叠高倍(×400)视野,各视野得分的平均值作为最终得分;使用Image Pro Plus(IPP)Version 6.0图像分析软件,对选取视野内免疫组化阳性信号进行光强度及面积分析,计算对照组与实验组NLRP3表达的积分光密度(IOD)值[6]。
1.2.6 免疫荧光双染色检测NLRP3表达 将肺组织标本切片脱蜡,微波抗原修复,血清封闭以减少非特异性染色,一抗F4/80(1∶100)孵育过夜,TBST洗涤5次,每次3 min。加入荧光(FITC)标记羊抗小鼠IgG(1∶100),室温孵育1 h,TBST洗涤5次,每次3 min。血清封闭,一抗NLRP3(1∶100)孵育过夜,TBST洗涤5次,每次3 min。加入荧光(Cy3)标记羊抗兔IgG(1∶100),室温孵育1 h,TBST洗涤5次,每次3 min。PBS充分漂洗后避光进行DAPI染色,TBST洗涤5次,每次3 min。绿色荧光标记的是FITC阳性肺巨噬细胞,而红色荧光标记的是Cy3阳性的NLRP3蛋白。用含抗荧光淬灭剂的封片液封片,然后在荧光显微镜下观察采集图像并计算对照组与实验组IOD值[7]。
1.2.7 肺组织IL-18、IL-1β及Caspase-1的表达检测 取肺组织在4℃预冷的PBS中漂洗,无菌纱布拭干,称质量,无菌注射器抽取9倍肺质量的预冷PBS,眼科剪剪碎并用玻璃匀浆管匀浆,上下转动8次左右,移入离心管内,4℃、3 000 r/min离心15 min,取上清,分装并于-80℃保存备用。按ELISA试剂盒说明书测定肺组织内IL-18、IL-1β及Caspase-1的表达情况,同时在酶标包被板设标准品孔、空白孔以及待测样品孔。反应终止后,450 nm波长依序测量各孔的OD值,计算样品浓度[8]。
1.3 统计学方法 利用SPSS 17.0统计软件进行数据处理,计量资料以均数±标准差(±s)表示,多组间比较采用单因素方差分析(ANOVA),组间多重比较采用LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 大鼠肺巨噬细胞吞噬功能测定 不同剂量的PM2.5对大鼠肺巨噬细胞的吞噬功能均有不同程度的抑制,且随PM2.5剂量增加,抑制率逐渐增高(低、中、高剂量组抑制率分别为17.07%、31.70%、38.90%,P<0.05),见表1。
2.2 肺组织HE染色及病理学评分 与对照组相比,实验组大鼠肺组织HE染色主要表现为不同程度的肺间质肺炎,肺泡出血、水肿,以淋巴细胞为主的炎细胞浸润,肺泡间隔明显增宽,部分肺泡壁断裂、缺损,尤以高剂量组最为明显。而且低、中、高剂量组大鼠的肺组织病理学评分均明显高于对照组(P<0.05),见图1、表1。

Fig.1 Comparison of the pathological results between different rat lung groups(HE staining,×100)图1 大鼠肺组织病理结果比较(HE染色,×100)
2.3 免疫组化检测 大鼠肺组织内NLRP3在对照组少量表达,而低、中、高剂量组大鼠肺组织内NLRP3表达均高于对照组,差异有统计学意义(P<0.05),见图2、表1。
2.4 免疫荧光双染色 对照组肺巨噬细胞和NLRP3的荧光强度均较弱,而随着PM2.5染毒剂量的增加,肺巨噬细胞和NLRP3的荧光强度均增强(红色与绿色荧光融合为橘黄色),差异有统计学意义(P<0.05),见图3、4。
2.5 肺组织IL-18、IL-1β及Caspase-1的表达 与对照组相比,低、中、高剂量组大鼠肺组织内IL-18、IL-1β及Caspase-1的表达均明显上调,差异有统计学意义(P<0.05),见图5。
Tab.1 The effects of PM2.5 on phagocytic function of macrophages in BALF,histopathological scores and cumulative light density(IOD)表1 PM2.5对大鼠BALF内巨噬细胞吞噬功能、肺组织病理评分及IOD的影响 (n=8,±s)
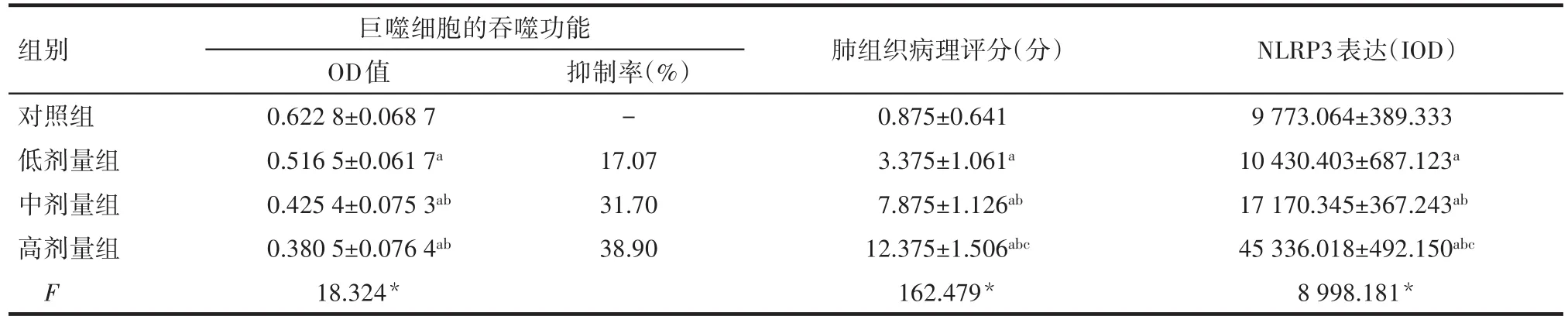
Tab.1 The effects of PM2.5 on phagocytic function of macrophages in BALF,histopathological scores and cumulative light density(IOD)表1 PM2.5对大鼠BALF内巨噬细胞吞噬功能、肺组织病理评分及IOD的影响 (n=8,±s)
*P<0.05;a与对照组比较,b与低剂量组比较,c与中剂量组比较,P<0.05
组别对照组低剂量组中剂量组高剂量组F巨噬细胞的吞噬功能OD值0.622 8±0.068 7 0.516 5±0.061 7a 0.425 4±0.075 3ab 0.380 5±0.076 4ab 18.324*抑制率(%)-17.07 31.70 38.90肺组织病理评分(分)0.875±0.641 3.375±1.061a 7.875±1.126ab 12.375±1.506abc 162.479*NLRP3表达(IOD)9 773.064±389.333 10 430.403±687.123a 17 170.345±367.243ab 45 336.018±492.150abc 8 998.181*

Fig.2 The expression of NLRP3 in rat lung by IHC stainning method(×400)图2 大鼠肺组织NLRP3表达(免疫组化染色,×400)
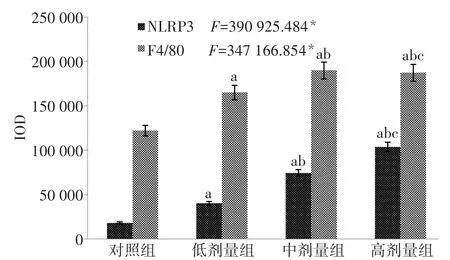
Fig.3 Expressions of NLRP3 in rat alveolar macrophages(F4/80)in four groups图3 各组大鼠肺巨噬细胞(F4/80)内NLRP3的表达

Fig.5 Expressions of IL-18,IL-1β and Caspase-1 in rat lung in four groups图5 各组大鼠肺组织内IL-18、IL-1β及Caspase-1的表达
3 讨论
PM2.5是指直径≤2.5µm的大气细颗粒物,较易吸附空气中的有毒有害物质(如重金属、挥发性有机化合物和多环芳烃等),并且在大气中的滞留时间长、传送距离远[9-10]。因其既可较长时间在空气中停留,又可直接到达肺泡通过气血交换入肺入血,故对肺损伤较大。
AM是由单核细胞分化而来,广泛分布于肺泡以及支气管肺泡上皮表面,是呼吸系统固有免疫的第一道防线,在支气管和肺泡局部的固有免疫防御及过度免疫导致的炎症损害等方面发挥重要的作用[11]。正常状况下PM2.5进入肺泡后,AM立即发挥吞噬、免疫和分泌作用,对其及时进行清除。但当PM2.5浓度超过一定量后,会引起一系列生理、生化指标的变化,甚至发生肺损伤,本实验HE染色结果证实,大鼠气管滴注PM2.5染毒后肺损伤明显(间质性肺炎、支气管周围炎),表现为肺泡腔增厚,肺泡间隔增宽、断裂,并伴有以淋巴细胞为主的炎细胞浸润;其次,有研究发现,PM2.5可引起Nc/Nga小鼠BALF内巨噬细胞数量明显增加且IL-1β表达上调,从而出现过敏反应[12]。本研究也发现,大鼠气管滴注PM2.5后BALF内巨噬细胞吞噬功能下降。
近期研究发现,PM2.5可通过上调NLRP3炎性小体诱导小鼠肺部炎症反应[13],但上调的NLRP3蛋白的细胞定位尚不明确。因此,一方面笔者采用免疫组织化学染色法分析大鼠肺组织内NLRP3表达情况,结果发现,大鼠气管滴注PM2.5造模后肺组织内NLRP3表达均有不同程度的上调;另一方面采用FITC标记肺泡巨噬细胞,Cy3标记NLRP3蛋白,结果发现,大鼠经PM2.5染毒后肺泡巨噬细胞内NLRP3表达均有不同程度的上调,并随PM2.5的剂量升高而表达上调。这表明,PM2.5引起的大鼠肺损伤与肺泡巨噬细胞内NLRP3炎性小体活化密切相关。
NLRP3炎性小体为NLRP3与接头蛋白ASC和效应蛋白Caspase-1组装形成一种分子质量约为700 ku的大分子多蛋白复合体,可激活Caspase-1(即IL-1β转化酶),进而促进促炎细胞因子IL-18和IL-1β的剪切成熟和分泌,引起系列炎症反应。因IL-18和IL-1β处于免疫反应的上游,能刺激多种炎性介质的产生,如其生成过多可引起一系列炎症性疾病[14-15]。因此,对NLRP3炎性小体及其下游信号通路IL-18和IL-1β进行深入的研究,可对相关的炎症性疾病的防治提供新的策略和临床应用的理论依据。本实验利用ELISA法检测肺组织匀浆内IL-18、IL-1β和Caspase-1的表达情况,结果发现,各实验组大鼠肺组织内IL-18、IL-1β及Caspase-1的表达均明显上调。这表明,PM2.5引起的肺损伤是由于肺巨噬细胞内NLRP3炎性小体活化,进而引起IL-1β和IL-18的活性释放而造成的。
目前,PM2.5肺损伤的发病机制尚不明确。本实验通过气管滴注PM2.5制作大鼠肺损伤模型,利用肺组织病理评分、免疫组化、免疫荧光双染色及ELISA法检测发现大鼠肺损伤与肺巨噬细胞内NLRP3炎性小体活化密切相关。接下来,验证该通路引起的固有免疫反应是笔者研究的重点。
(图4见插页)
