慢病毒介导的microRNA-155过表达对肝癌细胞HepG2增殖的影响
2018-11-29牛连杰张雅敏武兆国
牛连杰,张雅敏,武兆国
肝细胞癌(HCC)是第六大致命恶性肿瘤,在全球癌症相关死亡中位居死亡率第三位[1]。microRNAs(miRNAs)是在真核生物中发现的一类内源性的具有调控功能的短链非编码RNA,可通过降解mRNA或抑制mRNA翻译,调控众多基因的表达,在胚胎的发生、组织器官发育、细胞生长分化与凋亡、疾病发生和发展等生命活动中起重要作用[2]。miRNAs与肝癌密切相关,特定miRNA在肝癌发生、发展中的作用正成为肝癌研究的新热点,miRNAs有望成为肝癌治疗的新靶点[3]。本研究通过在HepG2细胞中过表达miR-155,检测miR-155对肝癌细胞系HepG2增殖的影响。
1 资料与方法
1.1 主要试剂及仪器 人肝癌细胞系HepG2由南开大学器官移植重点实验室保存;胎牛血清、低糖培养基(Gibco公司);Trizol及Lipo2000试剂(Invitrogen公司),带荧光标记和嘌呤霉素筛选的miR-155 hRNA质粒及阴性对照质粒(复能基因,广州);引物合成由天津华大生物公司完成;反转录试剂盒及实时定量PCR用SYBR Green染料(全式金生物公司,北京),PTEN抗体(万类生物,沈阳),CyclinD1和CyclinA1+A2(Abcam公司,美国),CCK-8试剂(博士得生物公司,武汉)。Real-time PCR仪:LightCycler®480(罗氏公司,瑞士),荧光显微镜(奥林巴斯公司,日本),CO2培养箱(赛默飞公司,美国)。
1.2 方法
1.2.1 质粒的提取和病毒包装 质粒的提取:成熟质粒转化50µL的DH5α感受态细胞,菌液摇床过夜(12~16 h),按照无内毒素质粒提取试剂盒说明书(康为世纪,北京)提取质粒。慢病毒的包装及病毒滴度测定按照文献[4]方法进行。
1.2.2 HepG2的分组及转染 试验分为3组:空白对照组(N组)即未做任何处理;干扰组(过表达miRNA-155,H组),即上调HepG2细胞中的miR-155;阴性对照组(negative control,NC组),即转染空病毒。将对数生长期的HepG2细胞按照上述分组转染,24 h后换液,48 h后换新鲜培养基,加1 g/L的嘌呤霉素,每24 h更换新鲜培养基,直至未做任何处理的细胞全部死亡,荧光显微镜观察转染效率。
1.2.3 qRT-PCR检测转染后HepG2细胞miR-155和PTEN mRNA表达 分组及操作如1.2.2所述,两个6孔板同时操作。慢病毒转染72 h后收集细胞,采用qRT-PCR检测miR-155及PTEN的表达水平,判断转染效果。miR-155和PTEN引物序列见表1。以各自的下游引物作为逆转录特异性引物,均由天津华大生物公司合成。按说明书配制PCR体系。反应条件:95℃预变性10 min;95℃变性10 s,60℃退火、延伸60 s,共40个循环。每个样本均检测4次,采用2-ΔΔCt方法计算miRNA-155和PTEN相对表达量。
1.2.4 Western blot检测细胞周期相关蛋白的表达 提取细胞总蛋白,10%SDS-PAG电泳,320 mA、90 min冰浴转膜,5%脱脂奶粉室温封闭1 h,加入一抗于4℃冰箱过夜,二抗室温孵育1 h,显影曝光观察相对表达情况。

Tab.1 Sequence of each gene primer表1 各基因引物序列
1.2.5 CCK-8法检测细胞增殖情况 收集各组细胞,待细胞生长状态良好,以每孔2×107/L的密度接种于96孔板,培养0、12、24、48和72 h后分别进行CCK-8检测。加入10 µL CCK-8试剂,继续在37℃、5%CO2条件下培养2 h,检测波长在450 nm处吸光度(OD)值,每组设4个复孔。
1.3 统计学方法 采用SPSS 24.0统计学软件。符合正态分布的计量资料以均数±标准差(±s)表示,多组间比较采用单因素方差分析,组间多重比较应用LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 病毒滴度测定 miR-155-hRNA-LV和NEGGFP-LV均为2×109TU/mL。
2.2 转染效率及miR-155、靶基因PTEN相对表达量 荧光显微镜下观察转染效率,H组和NC组两者均大于90%,见图1。H组miR-155表达量明显高于NC组及N组,靶基因PTEN的表达量低于NC组及N组(均P<0.05),见表1。
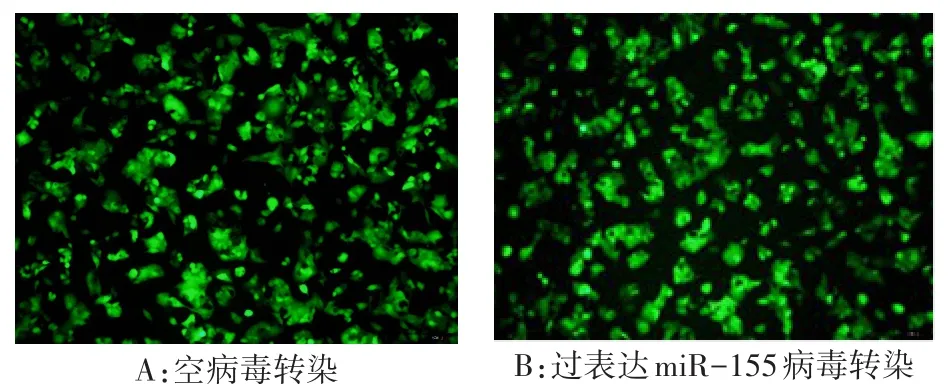
Fig.1 Results of fluorescence microscopy of virus infected HepG2 cells(×100)图1 荧光显微镜观察病毒感染HepG2细胞转染效率(×100)
2.3 Western blot检测结果 H组PTEN的表达量明显低于NC组和N组,而CyclinD1、CyclingA1+A2的表达量明显高于NC组和N组(均P<0.05),见图2、表3。
Tab.2 Relative expression levels of microRNA-155 and PTEN after transfection表2 转染后各组microRNA-155和PTEN相对表达量(n=4,±s)

Tab.2 Relative expression levels of microRNA-155 and PTEN after transfection表2 转染后各组microRNA-155和PTEN相对表达量(n=4,±s)
**P<0.01:a与N组比较,b与NC组比较,均P<0.05
组别N组NC组H组F miR-155 1.030±0.065 1.011±0.022 1.583±0.035ab 161.400**PTEN 0.993±0.011 0.986±0.023 0.653±0.029ab 226.600**
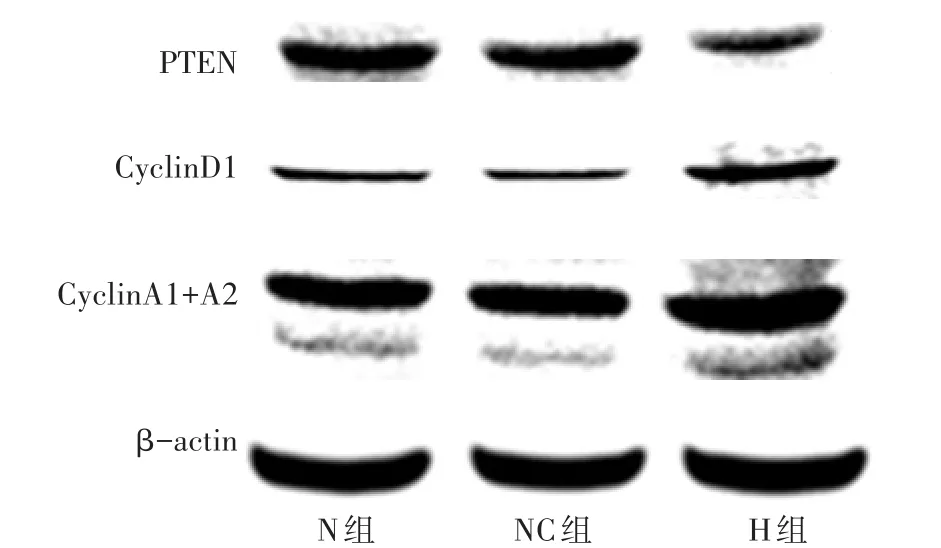
Fig.2 Results of PTEN,CyclinD1,and CyclingA1+A2 detected by Western blot assay in three groups图2 各组Western blot检测PTEN、CyclinD1、CyclingA1+A2结果
Tab.3 Relative gray scale of Western blot assay in three groups表3 各组蛋白Western blot相对灰度值 (n=3,±s)
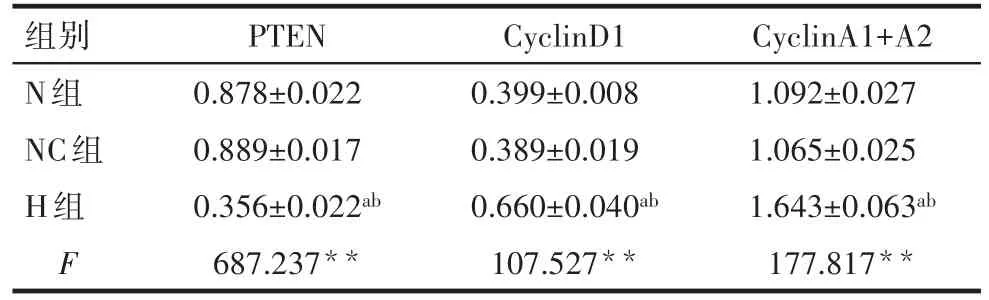
Tab.3 Relative gray scale of Western blot assay in three groups表3 各组蛋白Western blot相对灰度值 (n=3,±s)
**P<0.01:a与N组比较,b与NC组比较,均P<0.05
组别N组NC组H组F PTEN 0.878±0.022 0.889±0.017 0.356±0.022ab 687.237**CyclinD1 0.399±0.008 0.389±0.019 0.660±0.040ab 107.527**CyclinA1+A2 1.092±0.027 1.065±0.025 1.643±0.063ab 177.817**
2.4 各组CCK-8增殖实验测定结果 3组12 h时OD值开始出现差异,24、48、72 h时H组OD值均大于NC组和N组(P<0.05),见表4。
3 讨论
miRNAs与肝癌密切相关,研究特定miRNAs在肝癌发生、发展中的作用正成为肝癌研究新热点[5]。miR-155作为miRNAs家族一员,是一种多功能microRNA。大量研究证实,miR-155在免疫应答、自身免疫性疾病和心血管系统疾病等免疫炎症性疾病,以及各种肿瘤(胶质母细胞瘤、白血病、前列腺癌、乳腺癌、肺癌、胃癌、结肠癌和肝癌)中发挥重要作用[6]。miR-155可在翻译水平靶向调控MyD88的表达,从而抑制免疫炎症反应[7]。目前,miR-155可通过阻止上皮间质转化(EMT)过程和ERK1信号通路,从而减弱肝星状细胞的活化[8]。另有研究显示,miR-155通过靶向ARID2介导的Akt磷酸化通路促进肝癌肿瘤生长,并可能作为一种新的肝癌预后生物标志物和治疗靶点[9]。因此,miR-155在疾病发生、发展过程中的作用以及具体机制可能具有多样性。
目前,有关建立稳定过表达的miR-155的肝癌细胞系的相关研究较少。本研究利用慢病毒载体构建稳定过表达miR-155的HepG2细胞,从不同水平检测细胞增殖水平的变化。本实验成功地构建了miR-155慢病毒表达载体。qRT-PCR结果表明,miR-155可抑制PTEN基因的表达而促进了细胞增殖;Western blot结果表明H组PTEN的表达量明显低于NC组和N组,而CyclinD1、CyclinA1+A2的表达量明显高于NC组和N组,CCK-8检测结果表明12 h时3组OD值开始出现差异,24 h后H组OD值均大于NC组和N组,表明从基因水平、蛋白水平和细胞水平变化均证实了miR-155具有显著促进肝癌细胞增殖的作用。因此,笔者认为miRNA-155在调控肝癌细胞增殖中发挥重要作用,miR-155表达上调使PTEN基因的表达下调,但CyclinD1、CyclinA1+A2的表达增加说明miR-155对细胞生物学水平的调控不止一种信号通路,但具体的作用机制和信号通路有待进一步研究。
综上所述,miR-155与肝癌发生、发展密切相关,miR-155具有癌基因样功能,可能是肝癌相关miRNA编码基因。miR-155也许能够成为患者早期诊断、治疗方案选择的分子标志物。这为临床研究miR-155信号通路抑制剂提供了理论和实验依据。
Tab.4 Comparison of relative OD by CCK-8 assay between three groups表4 各组CCK-8检测OD值比较 (n=3,OD值,±s)
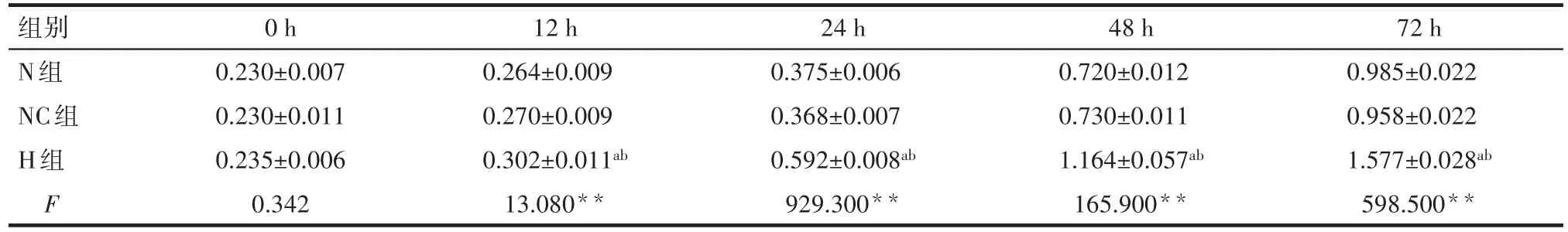
Tab.4 Comparison of relative OD by CCK-8 assay between three groups表4 各组CCK-8检测OD值比较 (n=3,OD值,±s)
*P<0.05,**P<0.01:a与N组比较,b与NC组比较,均P<0.05
组别N组NC组H组F 72 h 0.985±0.022 0.958±0.022 1.577±0.028ab 598.500**0 h 0.230±0.007 0.230±0.011 0.235±0.006 0.342 12 h 0.264±0.009 0.270±0.009 0.302±0.011ab 13.080**24 h 0.375±0.006 0.368±0.007 0.592±0.008ab 929.300**48 h 0.720±0.012 0.730±0.011 1.164±0.057ab 165.900**
