植物类过敏反应介导的抗病研究进展
2018-11-28李磊,贡豪,李韬
李 磊, 贡 豪, 李 韬
扬州大学农学院, 江苏省作物遗传生理重点实验室/植物功能基因组学教育部重点实验室; 江苏省作物基因组学与分子育种重点实验室, 江苏省粮食作物现代产业技术协同创新中心, 扬州 225009
植物抵御病原菌以及环境胁迫的机制可分为两种类型:一类可归为机械/物理抗性:即以角质、蜡质、木质素等物理结构相关成分组成的阻挡病原菌入侵的形态障碍机制;另一类称之为生理/化学抗性:即植物感知外界环境后通过增强呼吸作用、产生抑菌物质、促进细胞死亡等过敏性反应(hypersensitive reaction,HR)相关的生理生化反应来抵御病原菌入侵的机制[1]。植物过敏反应是植物-病原物不亲和互作后发生的一种细胞快速坏死的典型抗病反应,是植物的一种抗病机制,伴随细胞的程序性死亡。过敏反应是细胞程序性死亡(programmed cell death,PCD)的主要形式,是一种受基因控制的、主动的、有序的细胞死亡过程,可以激发邻近组织的防卫反应和植株的系统获得性抗性[2]。而类过敏反应(hypersensitive reaction-like,HRL)是指植株在没有病原物侵染也未遭受外界胁迫的条件下自发形成的类似过敏反应症状,往往表现为植物的局部(如叶片、叶鞘、枝梗、谷壳等)或整株上均匀布满坏死病斑或者萎黄病斑。研究类过敏反应发生机制以及相关基因对培育广谱抗病品种、提高作物的适应性和稳产性具有重要意义,本文对类过敏反应及类过敏反应介导的抗病性的三个阶段(活性氧迸发、信号分子的传递以及抗病系统的激活)的相关研究进展进行了综述,以期为植物抗病研究提供参考。
1 植物类过敏反应
植物的类过敏性反应通常与植物的广谱抗病性相关联,广谱抗性(broad-spectrum resistance)指的是对同一病原菌的不同生理小种或不同病原菌都具有抗性。目前作物中定位和利用的抗病基因绝大部分为小种特异性(race-specific)抗病基因,该类抗性只对个别或少部分小种有效,其抗性很容易因新的毒性小种的出现而丧失[3]。因此,广谱持久抗性基因的挖掘和利用是减少作物病害最有效、经济和环保的途径,而广谱抗病基因的挖掘是作物抗病育种和抗病性改良的重要任务,已成为国内外植物遗传育种学家以及植物病理学家研究的热点。目前在拟南芥、水稻、玉米等植物中已有超过100个类过敏材料的基因被克隆[4],但在小麦中未见相关基因克隆的报道,仅有Dlm1、Dlm2[5]两个类过敏缺陷突变体以及lm[6]、lm1、lm2[7]和Ndhrl1[8]4个类过敏基因初步定位的报道。很多类过敏材料表现出对病原菌的抗性,这一过程常常伴随着细胞的过敏性坏死以及抗病信号的传递,如活性氧(reactive oxygen species,ROS)的迸发,乙烯、水杨酸、茉莉酸等激素信号的增强,植物防卫反应相关基因的激活,系统获得抗性途径的激活,胼胝质的积累,以及细胞壁蛋白的氧化交联等共同的特点。
2 植物类过敏反应引发的抗病性
综合前人的研究结果,我们可以将植物类过敏反应引发的抗病性大体分为:活性氧的迸发、激素信号的激活以及防卫系统的激活3个主要阶段(图1)。值得注意的是:起始阶段与第二阶段之间有时并无明显的界限,活性氧的迸发与EDS1的表达之间存在相互促进的反馈调节机制。此外,各激素信号之间存在普遍的互作与交叉。
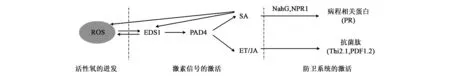
图1 植物类过敏反应介导抗病的3个阶段Fig.1 Three stages of Hrl-mediated broad-spectrum resistance.
2.1 活性氧的迸发
活性氧是一类化学性质活泼、氧化能力强的含氧化合物的总称,包括过氧化氢、超氧化物、羟自由基和一氧化氮等,是光合作用和呼吸作用等生理代谢活动中产生的副产物。动物中,线粒体是产生活性氧的主要细胞器,而植物细胞中叶绿体产生的活性氧是线粒体的20倍,此外,植物细胞中的内质网以及过氧化物酶体也可产生少量的活性氧[9]。正常情况下植物细胞内活性氧的产生和清除是平衡的。病原菌的入侵能导致植物体活性氧的迸发,使植物受到氧化胁迫,进一步导致细胞死亡,这是过敏性反应的重要特征,也是植物的早期防卫反应之一。
很多类过敏突变体中均观察到了活性氧的迸发。玉米Les22(lesionmimic22)基因编码一个尿卟啉原Ⅲ脱羧酶,显性类病斑突变体Les22中,尿卟啉原脱羧酶活性显著降低,导致尿卟啉原Ⅲ过量积累,在光照条件下尿卟啉原Ⅲ促使植株产生过量的活性氧,从而引发类过敏表型[10]。拟南芥显性RCD1(radical-induced cell death 1)突变体中,臭氧和过氧化物的积累导致类过敏反应表型的产生[11];野生型拟南芥LSD1(lesions simulating disease resistance 1)编码的锌指蛋白能与3个过氧化氢酶互作,提高过氧化氢酶活性,其类病变突变体lsd1中过氧化氢酶活性的降低使得过氧化氢大量积累,导致细胞程序性死亡[12]。烟草中通过转基因抑制过氧化氢酶的表达,促进了过氧化氢的积累,导致转基因植株产生类过敏反应的坏死斑[13]。这些研究表明活性氧的迸发与类过敏反应表型密切相关,目前已知植物过敏反应中活性氧迸发的调控途径主要有EDS1(enhanced disease susceptibility 1)途径和NDR1(nonrace-specific disease resistance)途径[2]。野生型拟南芥对携带avrB、avrRpm1、avrRpt2和avrPph3中任意一个无毒基因的番茄假单胞菌均具有抗性,而突变体ndr1-1却表现出类过敏反应并对其感病。进一步的研究表明NDR1 是一个具有非小种专化性的诱导防御反应的抗性基因,NDR1在CC-NB-LRR 类R蛋白的调节下参与细胞活性氧的产生[14]。EDS1编码一个类脂肪酶蛋白,是一种重要的防卫基因。EDS1在以TIR-NB-LRR(toll-interleukin-1 receptor nucleotide binding-leucine-rich repeat)类R蛋白(resistance proteins)为主介导的ETI(effectors-triggered immunity)及不涉及R蛋白的PTI(PAMP-triggered immunity)中均发挥重要作用,主要调控细胞内氧爆发和水杨酸(salicylic,SA)的积累并抑制JA/ET(jasmonic acid/ethylene)通路。EDS1通过与另外两个类脂肪酶蛋白PAD4(phytoalexin deficient 4)和SAG101(senescence-associated gene 101)的互作促进SA的积累进而抑制过氧化氢降解酶的活性,进一步促进叶绿体中过氧化氢的积累,导致活性氧过量[15,16]。
2.2 激素信号的激活
植物激素广泛参与了植物对病害的抵抗。在植物类过敏反应过程中,随着活性氧含量的提升和NDR1、PAD4、EDS1以及CPR5(constitutive expressor of pathogenesis-related genes 5)等基因的响应,一系列激素信号途径被激活。水杨酸(salicylic acid,SA)、茉莉酸(jasmonic acid,JA)、乙烯(ethylene,ET)途径相关的程序性细胞死亡以及相关防卫反应在类过敏反应中扮演了十分重要的角色。
2.2.1水杨酸信号途径 水杨酸主要是以水杨酸甲酯(MeSA)的形式在韧皮部完成长距离运输,当MeSA被运输到远端组织后,与水杨酸结合蛋白2(SABP2)形成复合体,并在SABP2的催化作用下生成SA[17]。SA参与许多R基因特异的植物系统性抗病反应,是一种能激活植物抗病防卫反应的重要内源信号分子,可以介导植物局部过敏反应,导致植物细胞死亡。类过敏细胞中EDS1调控了活性氧的迸发,随后,活性氧扩散至旁邻细胞,反过来触发EDS1-PAD4-SA增强环,放大旁邻细胞的SA信号。这说明ROS信号和SA信号之间存在一种循环的反馈回应机制,可以放大防卫信号的传导。拟南芥中组成型表达相关发病机理的基因(constitutive expressor of pathogenesis-related genes, CPR)在激素响应过程中扮演了重要角色。拟南芥cpr5隐性突变体植株矮小、叶片光滑、表皮毛分叉减少、内源SA含量升高。研究表明CPR5是一个多效性基因,对梨枯病原体和寄生性病原菌卵菌具有抗性[18],在细胞增殖、细胞衰老和死亡、信号分子的响应[19],以及膜蛋白的编辑等方面具重要的调节作用[20,21]。拟南芥中CPR30负向调控其抗病反应,EDS1、PAD4和NDR1对CPR30调控的防御反应具有重要的调节作用,而NPR1与这一调控机制没有直接关联。水杨酸在cpr30突变体内大量积累,进一步的研究表明:cpr30突变体中,水杨酸参与了PR1基因的表达而不参与PR2基因的表达调控[22]。除CPR基因外,还有很多类型的基因参与水杨酸信号的调控[23]:第一类基因直接编码参与水杨酸合成途径的酶。SA可以被苯丙氨酸解氨酶PAL合成,也可被异分支酸合成酶合成,如SID2能将分支酸转化为异分支酸,促进水杨酸的合成;第二类基因与水杨酸的积累相关,但并不直接参与SA合成,如ACD6(accelerated cell death 6),拟南芥ACD6编码一个含有跨膜结构域的锚定蛋白,参与了细胞死亡过程,并与番茄假单胞菌抗性相关,但具体作用机制暂不明晰;第三类基因在水杨酸下游起作用,如NPR1,拟南芥NPR1负责水杨酸的信号转导。NPR1蛋白以低聚体形态分散在细胞质中,难以进入细胞核,而感知水杨酸信号后分解成蛋白单体并进入细胞核进而激活PR基因表达。对拟南芥突变体npr1的研究发现,NPR1基因的启动子含有一个WRKY蛋白的结合位点——W-box序列,WRKY蛋白结合W-box序列后激活NPR1表达,而突变体中W-box序列的变异阻止了WRKY蛋白的结合,抑制了NPR1基因的表达,进而抑制植物产生SAR[24]。
2.2.2乙烯信号途径 乙烯是一种广为人知的植物激素,它影响植物各器官的生长、发育、衰老等过程,同时在调节植物HR中具有重要作用。外施乙烯能够显著增加喜树碱诱导的番茄过氧化氢和类过敏反应的产生[25];乙烯浓度增大能够显著增加月季花的类过敏反应;由浸泡引起的水稻根系表皮中检测到乙烯的合成;对乙烯不敏感的番茄能抑制由活体营养病原菌感染引起的类过敏反应。拟南芥内质网膜上的乙烯信号受体家族(ETR1、ETR2、ERS1、ERS2和EIN4)负责感知乙烯信号。这些乙烯受体主要包含GAF(cGMP phosphodiesterases/adenylyl cyclases/Fh1A)结构域、蛋白激酶结构域以及负责与乙烯结合的N端,可分为两个亚家族:ETR1和ERS1是亚家族Ⅰ的主要成员,包含GAF结构域和组氨酸激酶结构域,具有组氨酸激酶的活性;而ETR2、ERS2和EIN4属于亚家族Ⅱ成员,包含N端类似信号肽的疏水跨膜片段,以及C端退化的组氨酸激酶结构域,具有丝/苏激酶的活性。对单个拟南芥乙烯受体功能缺失突变体及其组合的研究发现:任意单个受体基因功能缺失突变体的表型均与野生型相似;两个乙烯受体基因的功能缺失突变体部分表现出对乙烯的反应,但对外源乙烯处理仍有响应;只有三个或以上受体功能的缺失才表现出对乙烯的持续反应[26,27]。这说明乙烯受体负调控下游乙烯信号转导,且不同乙烯受体之间的功能存在冗余。乙烯信号途径的负调控因子RTE1(reversion to ethylene sensitivity 1)是一类保守的膜结合蛋白,过表达RTE1的拟南芥表现出对乙烯处理不敏感,RTE1调控ETR1的功能是通过调节ETR1的N端结构域并改变受体的活性状态来实现的[28~30]。这些结果表明乙烯受体ETR1与RTE1的互作调控了乙烯信号通路[31,32]。此外,CTR1(constitutive triple response 1) 与乙烯受体互作形成的ETR-CTR复合体,是乙烯受体下游的另一个负调控因子。拟南芥CTR1基因的功能缺失突变体对乙烯不敏感,但ctr1仍然能够对乙烯产生部分响应[33],表明拟南芥中乙烯信号的转导部分依赖于CTR1。EIN2(ethylene insensitive 2)是乙烯信号转导的核心组分,是已知的第一个乙烯信号的正调控因子。在拟南芥中,ein2功能缺失突变体表现出对乙烯完全不敏感的表型[34],说明EIN2在乙烯信号途径中扮演着极为重要的角色。
2.2.3茉莉酸信号传导途径 茉莉酸是植物防卫反应的重要信号分子,可以通过诱导植物特异基因的表达来发挥植物的抗逆抗病功能。研究表明,由O3诱导的拟南芥过敏性细胞死亡后几小时内即可检测到JA的存在,并且用外源茉莉酸甲酯处理可抑制由O3诱导的细胞死亡,而对JA不敏感的突变型jar1受O3诱导后HR细胞死亡未受到影响[35]。COI1基因编码的F-box蛋白是SCF(Skp1/Cullin/F-box)E3泛素连接酶复合体的核心组分,能识别泛素化底物。泛素连接酶是一个多蛋白组成的复合体,CUL1(Cullin1)、RBX1(ring-box1)、ASK1(Arabidopsisskp1 homolog1)等与COI1相互作用共同组装成完整的SCFCOI1E3泛素连接酶[36]。MYC2又称之为JIN1、JAI1(jasmonate insensitive 1)是bHLH基因家族的主要成员。MYC2是JA信号途径的核心转录因子,主要参与调控了主根生长、针对虫害的应答反应等过程[37]。进一步研究发现,MYC2还可作为转录抑制因子,负调控植物激素介导的对病原菌的应答以及光形态建成等方面[38]。JA信号通路主要由激素分子、E3泛素连接酶、阻抑蛋白和转录因子等几部分组成。一般情况下,植物体内茉莉酸水平较低,茉莉酸负调控因子JAZ(jasmonate zim domain)蛋白与茉莉酸转录因了MYC2结合,关闭JA应答基因的表达,抑制JA的信号传导;当植物体受到胁迫刺激时,活性氧的积累能促进茉莉酸含量上升,JA与异亮氨酸Ile生成复合物JA-Ile,该复合物与受体COI1(coronatine insensitive 1)能够结合形成SCFCOI1-JAZ共受体复合物,促使茉莉酸负调控因子JAZ蛋白的泛素化和降解,最终释放出茉莉酸转录因子MYC2,促进JA的合成[36]。
2.3 防卫系统的激活
随着植物激素信号系统的激活,一系列下游防卫基因的表达被激活。目前研究较多的主要有SA信号响应的病程相关蛋白途径以及ET/JA信号响应的抗菌肽途径。
2.3.1SA信号响应的病程相关蛋白途径 当植物遭受病原菌侵染后,体内水杨酸含量的提高及其信号的传导在植物的局部抗性以及获得性系统抗病性(system acquired resistance,SAR)过程中扮演了极其重要的角色。在类过敏性反应中,ROS信号和SA信号形成的回环效应同样能够诱导植物的获得性系统抗病性[39]。SAR可以持续几周甚至几个月的时间内来有效抵抗多种病原物的侵染,包括病毒、细菌、真菌以及卵菌[40]。在长期的植物-病原菌共同进化过程中,植物形成了应对病原菌入侵的激素信号传导系统来激活抗病反应过程,而病原菌也演化出了阻断植物激素信号传导的策略。水杨酸羟化酶(salicylate hydroxylase,NahG)扮演了重要角色。来源于细菌的NahG可将水杨酸转化为无生物活性的儿茶酚。在植物中,转NahG基因的植株不能积累SA,也就不能由SA诱导植株产生SAR。对拟南芥突变体lsd6、lsd7、cpr22、acd6和acd11的转基因研究均表明NahG抑制了突变体中SA的积累和类过敏反应[41]。SA信号通路中另一个重要的调控基因是转录因子NPR1(non-expressor of pathogenesis-related genes 1)。正常情况下NPR1通过二硫键形成寡聚体的形式存在于细胞质当中,当植物受到外界胁迫后,细胞内SA大量积累,在SA能催化NPR1寡聚体二硫键的断裂,使得NPR1寡聚体裂变为NPR1单体。随后,NPR1单体通过核质转运进入到细胞核内[42],结合并活化碱性亮氨酸拉链转录因子家族的TGA蛋白[43]。最后,活化的TGA蛋白结合到病程相关基因(pathogenesis-related genes,PR)启动区的as-1cis调控元件上启动PR基因的表达[44]。病程相关蛋白是植物遭受外界胁迫时被诱导表达的一类数量庞大的蛋白质,依据蛋白结构和功能的不同,PR蛋白可分为17个家族,包括几丁质酶、葡聚糖酶、渗调素、抗菌肽等。PR3、PR4、PR8和PR11编码几丁质酶(chitinase),催化水解真菌细胞壁的几丁质组分。PR2编码β-1,3-葡聚糖酶(β-1,3-glucanase),催化水解真菌细胞壁的β-1,3-葡聚糖组分。PR5编码一个类甜蛋白(thaumatin-like),具有葡聚糖酶活性,能降解真菌细胞壁的组分 β-1,3-葡聚糖。PR6编码蛋白酶抑制剂(proteinase inhibitors,简称PIN),与蛋白酶结合抑制蛋白酶活性,具有多种生物化学功能。PR10编码类核糖核酸酶(ribonuclease-like),具有核酸酶活性能抑制真菌的生长,在植物的胁迫响应中以及发育过程中具有极为重要的作用。PR15编码草酸氧化酶(oxalate oxidase),能将草酸降解为二氧化碳和过氧化氢,并增强植物抗性[45]。SA还能诱导其他一些病程相关蛋白如几丁质酶、过氧化物酶以及抗真菌蛋白等。
2.3.2ET/JA信号响应的抗菌肽途径 SA诱导了植物病程相关蛋白的表达,而ET/JA信号主要调控植物抗菌肽的表达。拟南芥中Thi2.1(thionin)和PDF1.2(plant defensin 1.2)是ET/JA信号中的标志基因,这两个基因特异地受JA或ET的诱导,可作为区分依赖于SA抗病信号传导途径和ET/JA抗病信号传导途径的标记基因。硫堇蛋白(Thionins)及细胞防御素是一类广泛存在于植物细胞中并对细菌、真菌等病原微生物具有抑制或杀灭作用的小分子量多肽。拟南芥中Thionin基因Thi2.1和Thi2.2受乙烯和茉莉酸的诱导表达,但对水杨酸不敏感[46]。目前已有来自15个物种的100多个Thionins基因被鉴定,Thionins基因编码一类45~47个左右氨基酸残基的多肽。依据半胱氨酸及二硫键的多少可以将这些Thionins蛋白分为两类:一类含8个半胱氨酸及其形成的4对二硫键,另一类包含6个半胱氨酸及其形成的3对二硫键[47,48]。绝大多数Thionins蛋白均折叠成“L”状结构,两个反向平行的α螺旋相互缠绕形成了“L”结构的长臂,而单链折叠成的反向平行的β转角构成了“L”结构的短臂,二硫键进一步稳固该空间结构。疏水氨基酸残基聚集在“L”长臂的外表面,而亲水残基聚集在内表面或“L”结构拐角处的外表面[49,50]。植物Thionins通过影响致病菌细胞膜的通透性而具有抗菌活性。Thionins与靶细胞的膜上特异分子结合互作。很多类型的硫堇蛋白均能破坏细胞磷脂双分子层,作用1 h后即可检测到细菌细胞膜的裂解[51]。进一步研究发现Thionins与细胞膜结合后影响靶细胞内离子平衡,进而导致细胞裂解[52]。此外,Thionins还可通过改变一些代谢酶的氧化还原状态影响硫醇的次级信号转导过程,并放大Thionins对细胞的毒性效应,进而促进细胞死亡[53,54]。对一些JA或ET信号不敏感突变体的研究发现:磷酸化的乙烯响应因子(ethylene response factor 104,ERF104)能与PDF1.2(plant defensin 1.2,植物防御素)基因启动子区域的GCC盒结合,激活PDF1.2a和1.2b的表达[55]。此外,磷酸化的ERF6比ERF104更加稳定,进一步激活包括PDF1.1、PDF1.2a、PDF1.2b等多个防卫基因的表达[56]。植物防御素(plant defensin)与硫堇蛋白的大小相近,由约45~54个氨基酸残基组成,也具有6个或8个以二硫键相连的半胱氨酸,根据防御素二硫键位置的不同可分为α防御素、β防御素、θ防御素3类。植物防御素被认为是Thionins的一类,被命名为γ-thionin[57]。但是随后的工作表明植物防御素具有独特的三维结构,其典型特征是仅具有1个α螺旋,另含1个反向平行的β折叠片。防御素的半胱氨酸连接特征为:α螺旋片段上的两个半胱氨酸(CXXXC) 按先后顺序依次与β片层C未端上的两个半胱氨酸(CXC)相连形成两个二硫键,这种特征结构被称为cysteine-stabilized-α-helix motif[58]。防御素具有α淀粉酶活性,能够抑制菌丝生长,具有广谱抗真菌或细菌的特点,是植物防卫系统的重要组成部分。与硫堇蛋白不同的是:防御素对动植物细胞不具有伤害性,在植物病害防治技术中具有较高的安全性。
3 展望
综上所述,大多数类过敏反应材料都表现出HR相似的表型,广泛发生于植物生长发育以及抵御生物胁迫和非生物胁迫的各个阶段,参与调节的激素信号纷繁复杂,通过对类过敏反应材料的研究,大量类过敏相关基因被克隆,人们对其介导植物抗病机制的主要途径已有一定的认识。
活性氧的迸发发生在很多类过敏性反应材料中,它通过EDS1/PAD4途径调控植物的水杨酸信号,然而,SA不仅能直接地反馈调节活性氧,而且可以通过EDS1间接地调控活性氧。此外,植物激素调控是一个复杂的系统,不同激素之间存在互作效应与交叉调控。很多研究表明SA信号与JA信号是相互拮抗的,但也有少量研究表明SA和JA之间存在协同互作。SA和JA/ET之间也存在协同调控,ET能促进SA信号的传导。在类过敏反应介导的抗病过程中,JA和ET通常是相互协同作用的。这些研究表明植物激素调控的复杂性,植物的抗病系统是由一系列的调控网络构成的,人们对植物类过敏反应介导植物抗病性的主线已有较为清晰的认识,但对这一调控网络的认识还有待进一步深入。
对植物类病变坏死表型的形成机制进行更加深入与全面的研究,从而加深对植物抗病防御体系和细胞程序性死亡机理的理解,将极大地丰富植物分子病理学与分子生物学的内涵,并为选育抗逆能力强的作物品种提供理论依据。同时,由于多数类过敏材料本身的农艺性状欠佳,直接推广应用有一定困难。一方面筛选出农艺性状好的类过敏材料对抗病育种具有重要意义,另一方面如何改良已有农艺性状欠佳的类过敏反应材料,达到利用其广谱抗病性的目的,对新时期的绿色农业具有重要价值。
