羊肉掺假鉴别快速荧光定量PCR芯片制备及应用研究
2018-11-28李婷婷张桂兰王之莹陈爱亮
李婷婷, 张桂兰, 王之莹, 陈爱亮
中国农业科学院农业质量标准与检测技术研究所, 北京 100081
随着社会经济水平的提高,我国居民饮食结构发生了重大的变化,火锅、羊肉串等备受喜爱。然而,目前羊肉制品掺假现象愈发严重[1,2],常见的掺假肉类主要包括猪肉、鸡肉、鸭肉等,有的甚至还会掺入鼠肉[3,4]。这种欺诈行为严重损害了消费者权益,同时对社会发展带来了消极影响。
目前,研究人员已经开发出多种肉品掺假检测技术[5],主要包括以蛋白质为基础的酶联免疫吸附[6,7]、色谱质谱技术[8~11],以代谢物为基础的红外光谱技术[12]和以核酸为基础的PCR检测技术[13~17]等。其中,应用最多的为基于荧光定量PCR的检测技术,但是现有技术所需时间较长,无法满足现场快速鉴别的要求。同时,以羊肉串掺假为例,其掺假的肉类品种可能有猪肉、鸡肉、鸭肉、甚至老鼠肉等,如果逐个对可能的掺假物种进行PCR检测,则存在操作繁琐、分析时间长等问题。
近年来,芯片式快速荧光定量PCR技术的发展为羊肉掺假鉴别等核酸检测提供了一种快速、多重的荧光定量PCR检测方法,其是一种将芯片技术与荧光定量PCR技术相结合的高新生物技术[18~20]。传统的微芯片技术是运用微电机系统(micro-electro-mechanical system,MEMS)技术,通过制作微管道等空间结构及微加热等控制结构,实现芯片上的快速PCR扩增[21],而本研究通过将引物、反应所需试剂预先冻干固定到芯片上,只需将模板滴加至微孔内即可进行扩增,同时利用微芯片实时荧光定量PCR仪实现通过荧光信号检测PCR产物。该技术也可应用于农业(植物病原菌检测、转基因鉴别)、畜牧(牛类病害鉴别、鱼类和家禽病原菌检测)、食品安全(病原菌鉴别、微生物腐败鉴别)、生命科学和医疗(人类疾病鉴别、人类基因检测)等领域。
1 材料与方法
1.1 材料与试剂
羊肉、猪肉、鸭肉、鸡肉均购自北京市农贸市场,鼠肉由中国农业科学院饲料研究所提供。
二甲基亚砜(dimethyl sulfoxide,DMSO)、牛血清白蛋白(bovine serum albumin,BSA)、海藻糖等均购自北京雁栖湾生物技术有限公司。
1.2 实验仪器
7500荧光定量PCR仪(美国ABI公司);AriaDNA-10便携式微芯片实时荧光定量PCR仪(LUMEX分析仪器公司);NanoDrop 2000c超微量分光光度计(美国Thermo Scientific公司);冷冻干燥机(北京博医康实验仪器有限公司);5424离心机(德国Eppendorf公司);MS 3涡旋仪(德国IKA公司);KAPA SYBR©FAST Universal Kits(北京百诺威生物科技有限公司);TIANamp Genomic DNA Kit(北京天根生化科技有限公司)。
1.3 样品制备
用电子天平称取羊肉、猪肉、鸡肉、鸭肉、鼠肉各20 mg,用于提取引物特异性实验所用模板。再按照不同重量百分比(表1)分别称取不同肌肉组织进行混合,作为模拟掺假样品(每份样品为20 mg),总掺假比例为0~80%。
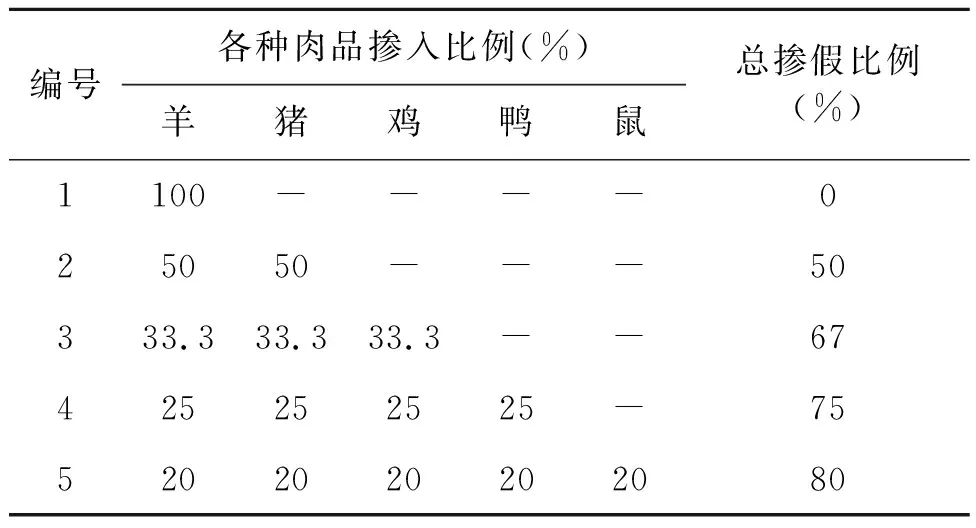
表1 研究所用模拟掺假样品Table 1 Simulated samples used in this study.
注:“-”表示该样品不含此成分。
1.4 DNA的提取及检测
按照TIANamp Genomic DNA Kit说明书提取制备好的样品的基因组DNA。采用超微量分光光度计对提取的DNA进行浓度及纯度检测。其浓度为10~20 ng/μL,且纯度较高(A260/A280为1.8~1.9,A260/A230>2.0),因此可用于后续PCR扩增。
1.5 引物特异性实验
研究所用引物均由北京生工生物技术有限公司合成,具体序列见表2。为了确定引物特异性,在ABI7500仪器上分别用羊源、猪源、鸡源、鸭源与鼠源成分的特异性引物对5种肉的基因组DNA进行扩增。反应体系(20 μL):2×PCR Mix 10 μL,10 mol/L正、反向引物各0.4 μL,模板 2 μL,剩余用无菌去离子水补齐;反应程序:95℃ 5 min;95℃ 3 s,60℃ 32 s,共40个循环;72℃ 2 min。添加熔解曲线。通过扩增Ct值(每个反应管内的荧光信号到达设定的阈值时所经历的循环数)来判断引物的特异性,Ct<35为有效扩增,Ct≥35为无效扩增。
1.6 芯片式PCR
1.6.1芯片的制备 本研究的空芯片微阵列设计为5×6阵列,每个位点包含冻干固定的一对引物(表3)及反应所需试剂。反应体系(20 μL):2×PCR Mix 10 μL,10 mol/L正、反向引物各0.4 μL,剩余体积用无菌去离子水补齐,同时将5 μL 0.5 g/mL DMSO、1.65~1.95 mg保护剂BSA、0.6~1.2 mg赋型剂海藻糖与20 μL反应体系进行混合。随后取2 μL混合溶液滴加到芯片上,采用冻干机进行冻干(-40℃,冷冻2 h),置于4℃备用。

表2 本研究所用引物Table 2 Primers used in this study.

表3 芯片中引物的位置(5×6)Table 3 The positions of primers in the chip (5×6).
1.6.2芯片式PCR反应 将2 μL模拟掺假样品1、2、3、4、5的基因组DNA分别滴加到芯片的第1、2、3、4、5列的反应池内,第6列为阴性对照,即不含任何模板。然后用640 μL矿物油将液体覆盖,以免高温蒸发,此方法无需繁琐的配制体系与操作步骤,简单快速。反应程序:95℃ 5 min;95℃ 3 s,60℃ 32 s,共40个循环;72℃ 2 min。添加熔解曲线。
1.7 ABI7500荧光定量PCR
在ABI7500仪器上分别用羊源、猪源、鸭源、鸡源与鼠源性成分的特异性引物对5种模拟掺假样品的基因组DNA进行扩增,反应体系(20 μL):2×PCR Mix 10 μL,10 mol/L 正、反向引物各0.4 μL,模板2 μL,剩余体积用水补齐即可。反应程序与芯片式PCR相同。
2 结果与分析
2.1 引物特异性实验
引物的特异性是动物源性成分核酸检测技术的关键,本研究利用筛选出的羊源、猪源、鸭源、鸡源与鼠源性成分的特异性引物对5种肉的基因组DNA进行扩增,结果如图1所示。
以羊源性引物为例(图1A),用羊源性引物进行扩增时,除了羊源DNA出现扩增且所对应的熔解曲线均为单峰外,其他物种模板均无扩增且熔解曲线为平滑的一条直线,说明羊源性引物的特异性较好。猪源、鸡源、鸭源与鼠源性引物与羊的结果一致,表明5对引物特异性好,可用于后续实验。

图1 引物特异性实验Fig.1 The specificity of primers.A~E依次为羊源、猪源、鸡源、鸭源、鼠源性成分的特异性引物分别对5种肉的基因组DNA扩增后的结果。
2.2 自制多重PCR芯片检测模拟羊肉掺假样品结果
本研究利用自制的羊肉掺假鉴别多重PCR芯片以及AriaDNA-10便携式微芯片实时荧光定量PCR仪对5种模拟掺假样品进行检测,各靶标的扩增Ct值见表4,扩增曲线见图2。
根据5种模拟掺假样品的成分配比可知,每个样品中均含有羊源性成分,因此,采用羊源性引物对5种模拟掺假样品进行扩增时,共5条扩增曲线(图2A)。同理,猪源、鸡源、鸭源与鼠源性引物的位置分别出现4条、3条、2条与1条扩增曲线,结果与已知样品中所含成分保持一致。由于在实际应用中若掺假比例太低,则获利微薄,因此,本研究将最低掺假比例设为20%,未对含量更低的样品进行检测。从图2可以看出,利用自制的PCR芯片对5种模拟掺假样品进行检测,均可检测到相应的动物源性成分,定性检测准确率为100%,同时,扩增曲线表明自制的PCR芯片具有较好的扩增效率,而且随着动物源性成分含量的降低,相应的Ct值逐渐增大。

表4 模拟羊肉掺假样品的扩增Ct值(Lumex)Table 4 The Ct values of simulated adulterated mutton samples(Lumex).
2.3 ABI7500荧光定量PCR验证及结果比对
采用ABI7500仪器对5种模拟掺假样品进行检测,从而验证AriaDNA-10便携式微芯片实时荧光定量PCR仪的性能。各靶标的扩增Ct值见表5,扩增曲线见图3。
结合芯片式PCR和ABI7500荧光定量PCR的结果可知,本研究所建立的扩增体系中,在AriaDNA-10仪器上用芯片进行扩增时,其扩增曲线不如ABI7500仪器显示的曲线平滑,同时,从Ct值可以看出,采用ABI7500仪器进行扩增的Ct值均小于采用芯片进行扩增的Ct值,可能原因是芯片上的扩增体系相对较少,导致达到阈值的时间偏后,因此,采用芯片进行扩增时效率偏低。但是总体来说,2种PCR检测方法的结果一致,2种方法均能准确的检测出5种成分,且随着动物源性成分含量的减少,相应的Ct值会逐渐增加。需要注意的是,本研究无法通过Ct值进行定量检测,只能进行定性检测,即确定含有哪种成分的掺假。

图2 Lumex仪器对不同样品进行扩增的曲线图Fig.2 The fluorescent amplification curves of the different samples by Lumex.A~E依次为羊源、猪源、鸡源、鸭源和鼠源性成分的特异性引物对5种模拟掺假样品扩增后的结果。

表5 模拟羊肉掺假样品扩增Ct值(ABI7500)Table 5 The Ct values of simulated adulterated mutton samples(ABI7500).
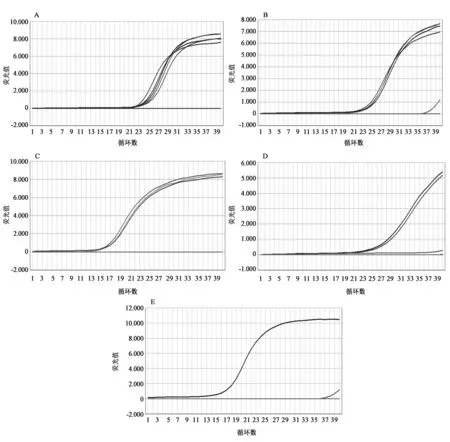
图3 ABI7500对不同样品进行扩增的曲线图Fig.3 The fluorescent amplification curves of the different samples by ABI7500.A~E依次为羊源、猪源、鸡源、鸭源和鼠源性成分的特异性引物对5种模拟掺假样品扩增后的结果。
3 讨论
本研究建立了基于芯片的快速荧光定量PCR检测方法,与传统的荧光定量PCR相比, PCR芯片一般由5×4或更多的反应池组成,可实现样品多指标的检测;由于芯片式PCR预先将反应所需试剂和引物冻干保存,只需将提取的DNA模板滴加到芯片上即可进行扩增,简化了检测步骤、缩短了检测时间。通过与ABI7500荧光定量PCR结果进行对比,发现两者的结果具有一致性,均可准确的检测出5种成分,且Ct值均随着动物源性成分比例的减少而升高。
目前,已有很多关于利用PCR技术检测肉制品中掺假成分的报道[27~29]。Prusakova等[30]采用多重PCR扩增法,可同时鉴别肉类产品中5种常见的掺假肉类,每种肉类的检测灵敏度可达30 pg。Dalsecco等[31]采用荧光定量PCR的方法,可以检测10种不同的动物源性成分;利用该方法对46种实验肉品混合物进行了评价,结果显示所有品种均鉴定正确,检测灵敏度为1%;同时对14种商业的肉类产品进行分析,结果表明14个样品中有6个含有鸡肉原料,由此可知,该方法对肉类产品的分析是有效和可靠的。普通PCR虽然操作简单、成本较低,但是对产物进行电泳检测所需时间较长,而传统的荧光定量PCR一般需要2 h才能完成,不适用于现场检测。本研究所建立的芯片式荧光定量PCR扩增法,由于所需样本体积小(只需2 μL),PCR升降温反应速度快,可缩短至30 min完成扩增及数据收集,操作简单,实验周期短。该芯片的研制及快速检测方法的建立将有效的简化羊肉制品掺假检测的步骤、缩短检测时间,同时所用芯片检测仪器Lumex体积较小,携带方便,为现场检测提供了技术支撑。
本研究虽然可以在30 min内完成扩增及数据收集,但是要建立一种快速检测体系,DNA提取也需快速进行,目前虽然已经有相关的快速提取DNA试剂盒,但大多数为磁珠法,需要进行细胞裂解、去除蛋白质等步骤,操作繁琐,而PCR技术是一项非常灵敏的分子检测技术,扩增效率高,只需痕量DNA即可检测。因此,本课题组开发了一种粗提DNA技术[32],在5 min内即可提取DNA进行扩增,进一步缩短了检测时间,为羊肉制品安全监测、掺假监管提供了理想的技术手段及方法。未来,如何将DNA提取、特异片段扩增和数据收集整合为一体化的检测方法仍需进一步探索。
