5 类致泻性大肠埃希氏菌多重荧光PCR检测方法的建立
2018-11-28胡安妥张彩霞
胡安妥,王 娉,张彩霞,3,蔡 阳,4,陈 颖,*
(1.中国检验检疫科学研究院农产品安全研究中心,北京 100176;2.南京财经大学食品科学与工程学院,江苏 南京 210023;3.武汉轻工大学食品科学与工程学院,湖北 武汉 430070;4.吉林出入境检验检疫局,吉林 长春 130062)
大肠埃希氏菌(Escherichia coli)通常被称为大肠杆菌,为人和动物肠道中的正常栖居菌。在相当长的一段时间内,大肠杆菌被认为是非致病菌[1-2]。直到20世纪中期,人们才认识到一些特殊血清型的大肠杆菌对人和动物具有病原性[3]。通常将能引起腹泻症状的特殊血清型的大肠埃希氏菌称为致泻性大肠埃希氏菌(diarrheagenic E. coli,DEC)。根据其流行病学特征、发病机制及临床特征等,可将致泻性大肠埃希氏菌分为肠致病性大肠埃希氏菌(enteropathogenic E. coli,EPEC)、肠出血性大肠埃希氏菌(enterohemorrhagic E. coli,EHEC)、肠产毒大肠埃希氏菌(enterotoxigenic E. coli,ETEC)、肠侵袭性大肠埃希氏菌(enteroinvasive E. coli,EIEC)、肠聚集性大肠埃希氏菌(enteroaggregative E. coli,EAEC)以及弥散黏附性大肠杆菌(diffuse adherent E. coli,DAEC)[4-5]。
致泻大肠埃希氏菌所产生的致病物质主要包括定居因子、黏附素、外毒素以及肠毒素等[6-7],不同类型的致泻大肠埃希氏菌的侵袭部位以及产生的致病物质均有差别,可经食物和饮用水在人群中广泛传播,造成严重疫情[8-9]。对致泻大肠埃希氏菌检测与甄别方法为选择性分离、生化鉴定、血清学鉴定等[10],实验周期较长,且一般实验室很难拥有完备的大肠杆菌诊断血清。聚合酶链式反应(polymerase chain reaction,PCR)技术由于其灵敏度高、可靠性强等优点被广泛应用于病原体的检测,目前已有研究采用单重PCR、多重PCR以及实时荧光PCR等技术对致泻大肠埃希氏菌进行检测,以达到检测其毒力基因、不同DEC致病型别区分以及DEC同其他食源性致病菌区分的目的。因荧光PCR技术同时具有自动化程度高、可同时进行多重反应,具有实时性和准确性等优点,利用该技术进行病原体的检测成为研究热点之一。本研究以5 种致泻大肠埃希氏菌为研究对象,对同一样本采用A、B 2 个荧光PCR反应体系鉴别EPEC、EHEC、EIEC、ETEC以及EAEC 5种致泻大肠埃希氏菌,可为致泻大肠埃希氏菌区分和鉴别提供参考,也对该菌的控制预防及流行监控有着十分重要的作用。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
实验菌株共计143 株,其中包括非致泻大肠杆菌71 株、EPEC 7 株、EHEC 8 株、EIEC 6 株、ETEC 2 株、EAEC 11 株、DAEC 2 株、沙门菌6 株、克罗诺杆菌6 株、蜡样杆菌6 株、单核细胞性李斯特菌6 株、金黄色葡萄球菌6 株、志贺菌6 株,均为本实验室保存。
1.1.2 引物及探针
根据GenBank上查找的各毒力基因的序列设计引物及探针。引物及探针由生工生物工程(上海)股份有限公司合成,信息见表1。
1.1.3 试剂
Ex Taq酶、10×buffer、dNTPs、pMD19-T vector载体宝生物工程(大连)有限公司;TOP10大肠杆菌感受态细胞 天根生化科技北京(有限)公司;质粒小提试剂盒、氨苄西林 生工生物工程(上海)股份有限公司;PCR产物纯化试剂盒 美国Promega公司;X-gal及IPTG美国Bio-Rad公司;Master Mix buffer 美国Applied Biosystems公司;LB琼脂培养基、LB肉汤培养基 北京陆桥技术股份有限公司。
1.2 仪器与设备
5804R离心机 德国Rppendorf公司;Veriti 96-Well Thermal Cycler梯度PCR仪、7500 fast real-time PCR system实时定量PCR仪 美国ABI公司;DYY-6C电泳仪北京六一仪器厂;4000MP 凝胶成像仪 德国Gene Genius公司;DU640核酸蛋白分析仪 德国Beckman公司。
1.3 方法
1.3.1 重组质粒的制备
参考王娉等[16]的方法,制备eae、stx1、stx2、ipaH、estla、estlb、elt、uidA、aggR、astA 11 组基因的重组质粒,并调整各重组质粒质量浓度至20 µg/mL。
1.3.2 单重实时荧光PCR扩增
分别以11 组基因的重组质粒为模板,进行实时荧光PCR扩增,验证eae、stx1、stx2、ipah、estla、estlb、elt、uidA、aggR、astA等基因探针及引物有效性。PCR反应体系和条件如下:Master Mix Buffer 12.5 µL、上下游引物各1 µL、探针0.5 µL、模板2 µL,ddH2O补足至25 µL。50 ℃预热2 min,95 ℃预变性10 min;然后40 个循环为95 ℃变性15 s,60 ℃退火1 min。
1.3.3 多重实时荧光PCR方法的建立
本研究共采用A、B 2 个PCR反应体系,分别对5 种致泻埃希氏菌进行检测,A体系可用于EPEC、EHEC、EIEC检测和大肠埃希氏菌种属鉴定,B体系可用于ETEC和EAEC检测。致病型别的判定标准如表2所示。
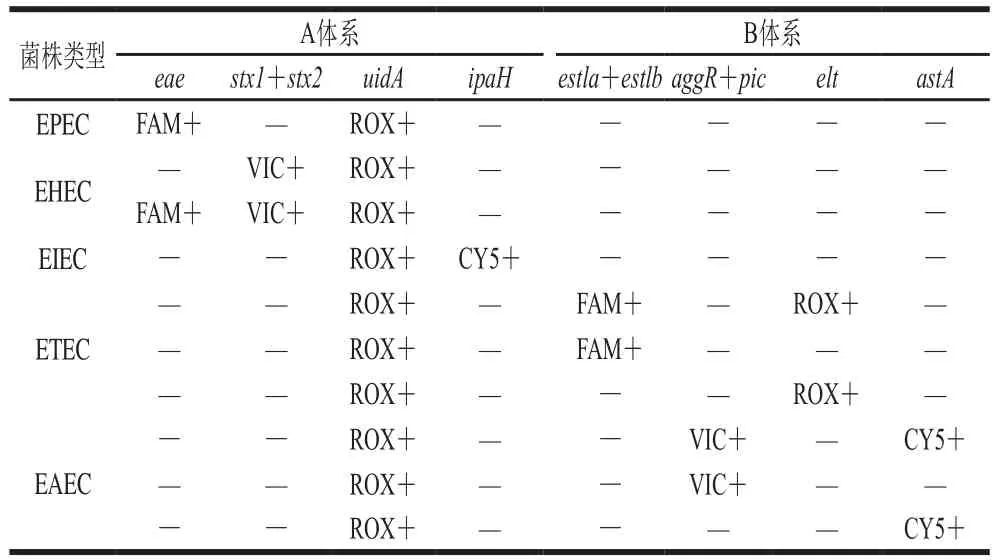
表2 5 类致泻埃希氏菌致病型别的判定标准Table 2 Criteria for determination of 5 pathogenic types of DEC
A、B 2 个反应体系采用25 µL扩增体系,A反应扩增使用的DNA模板为eae、stx1、stx2、uidA、ipaH 5 个构建好的重组质粒DNA按体积比1∶1∶1∶1∶1混合;B反应扩增使用的DNA模板为estla、estlb、aggR、pic、elt、astA 6 个构建好的重组质粒DNA按体积比1∶1∶1∶1∶1∶1混合。固定探针与引物体积比为1∶2,探针5 个梯度浓度设置为0.01、0.04、0.08、0.12、0.15 μmol/L,通过正交试验筛选引物、探针的可行浓度配比,在正交试验结果基础上进行体系的微调,确定探针及引物浓度的最优组合,并以优化好的反应体系摸索多重荧光PCR的最佳反应条件。
1.3.4 灵敏度检测
将A、B体系中使用的混合模板用10 倍倍比稀释法稀释,使用优化好的反应体系及条件,分别进行实时荧光PCR扩增,样品Ct值小于等于30为阳性,判定为可以检出,Ct值大于35为阴性,判定为不可检出,Ct值介于30~35之间为可疑样本,重复实验,Ct值仍小于35,且曲线有明显的对数增长期,则判定为可以检出,否则判定为不可检出[17-18]。
1.3.5 特异性检测
煮沸法提取金黄色葡萄球菌、志贺菌、沙门菌、单核细胞性李斯特菌、蜡样芽孢杆菌、克罗诺杆菌6 种常见食源性致病菌基因组DNA,调整质量浓度至20 µg/mL,采用25 µL扩增体系,含DNA模板2 µL,进行各菌种特异性基因验证[19-20]及本研究中11 组基因的单重荧光PCR验证,以保证DNA模板质量,并排除检测结果假阴性可能,之后使用本研究建立的实时荧光PCR方法进行扩增,验证该方法的特异性。
1.3.6 分离菌株的检测
将本室保存的107 株大肠埃希氏菌用作待检菌株,使用本研究建立的实时荧光PCR方法进行扩增,评价该方法的准确性及适用性。
2 结果与分析
2.1 单重实时荧光PCR验证结果
分别以获得的11 组基因的重组质粒DNA为模板,在单重实时荧光反应体系及条件下扩增相应的目的基因,11 组基因均能被相应探针和引物特异性扩增出具有明显对数增长期的S型曲线,扩增荧光值在100 000~1 750 000之间。
2.2 多重实时荧光PCR体系及条件优化结果
优化多重实时荧光PCR反应各引物及探针浓度、退火温度、循环次数等参数后,最终确定体系组成如表3所示。
PCR反应参数为:50 ℃加热2 min,95 ℃预变性10 min,循环95 ℃变性15 s,适温退火1 min,共40 个循环。如图1所示,A体系可用于检测eae、stx1、stx2、uidA、ipaH基因,B体系可用于检测estla、estlb、aggR、pic、elt、astA基因。

表3 多重荧光PCR体系组成Table 3 Components of multiplex real-time PCR systems

图1 最优体系及反应条件下A、B反应体系荧光PCR扩增结果Fig. 1 Real-time PCR amplification results with systems A and B under optimal reaction system and conditions
2.3 灵敏度检测结果
A体系所用混合模板中单个质粒DNA质量浓度为4 μg/mL,通过计算得出质粒DNA拷贝数浓度为1.32×1012copies/mL,10 倍倍比稀释后,使得质粒DNA质量浓度达到4×10-1~4×10-9μg/mL(对应质粒DNA拷贝数浓度为1.32×1011~1.32×103copies/mL);B体系所用混合模板中单个质粒DNA质量浓度为3.3 μg/mL,通过计算得出质粒DNA拷贝数浓度为1.1×1012copies/mL,10 倍倍比稀释后,使得质粒DNA质量浓度达到3.3×10-1~3.3×10-9μg/mL(对应质粒DNA拷贝数浓度为1.1×1011~1.1×103copies/mL)。A体系中当质粒DNA质量浓度达到4×10-6μg/mL(对应质粒DNA拷贝数浓度为1.32×106copies/mL)时,重复实验,曲线并无明显的对数增长期,判定为不能检出,当质粒DNA质量浓度达到4×10-5μg/mL(对应质粒DNA拷贝数浓度为1.32×107copies/mL)时,重复实验,扩增曲线有明显的对数增长期,判定为可以检出(图2A);B体系中当质粒DNA质量浓度达到3.3×10-6μg/mL(对应质粒DNA拷贝数浓度为1.1×106copies/mL)时重复实验,曲线并无明显的对数增长期,判定为不能检出,当质粒DNA质量浓度达到3.3×10-5μg/mL(对应质粒DNA拷贝数浓度为1.1×107copies/mL)时,重复实验,扩增曲线有明显的对数增长期,判定为可以检出(图2B)。每个实时荧光PCR反应体系中模板加入量为2 μL,则A体系每个反应管中的拷贝数为2.6×104,提示每个反应管中有2.6×104个拷贝的目的基因时即可被检出;B体系每个反应管中的拷贝数为2.2×104,提示每个反应管中有2.2×104个拷贝的目的基因时即可被检出。


图2 最佳体系及条件下A体系和B体系各质粒DNA系列稀释扩增曲线Fig. 2 Amplification curves of plasmid DNA in systems A and B under optimal reaction system and conditions
2.4 特异性检测结果

表4 特异性检测结果Table 4 Results of specificity test
如表4所示,6 种常见食源性致病菌各自特异性基因检测结果均为阳性,且用建立的多重实时荧光PCR方法对6 种常见食源性致病菌进行检测,检测结果为金黄色葡萄球菌、沙门菌、单核细胞性李斯特菌、克罗诺杆菌以及蜡样芽孢杆菌在A、B体系中均无扩增曲线,志贺菌在A体系中扩增出ipaH基因曲线,B体系中无扩增曲线,与11 种基因的单重荧光PCR检测结果一致,可保证检测结果不是假阴性。
2.5 分离菌株检测结果

表5 107 株分离菌株荧光PCR检测结果Table 5 Real-time PCR detection of 107 isolated strains
用建立的多重实时荧光PCR方法对本实验室保存的107 株大肠埃希氏菌进行检测,如表5所示。7 株EPEC菌株均在A体系中扩增出uidA以及eae基因曲线,B体系中无扩增曲线,菌株判定结果均为EPEC;8 株EHEC菌株均在A体系中扩增出stx1+stx2、eae以及uidA基因曲线,菌株判定结果均为EHEC;6 株EIEC菌株均在A体系中扩增出uidA以及ipaH基因曲线,B体系中无扩增曲线,菌株判定结果均为EIEC;2 株ETEC菌株在A体系中扩增出uidA基因曲线,在B体系中扩增出astA、elt以及estla+estlb基因曲线,菌株判定结果为ETEC;11 株EAEC菌株被分为2 种基因型,9 株菌株在A体系中扩增出uidA基因曲线,在B体系中扩增出astA基因曲线,2 株菌株在A体系中扩增出uidA基因曲线,在B体系中扩增出astA以及aggR+pic基因曲线,菌株判定结果均为EAEC。71 株非致泻大肠埃希氏菌在A体系中扩增出uidA基因曲线,在B体系中无扩增曲线,菌株判定结果均为大肠埃希氏菌(表5)。107 株菌株的荧光PCR判定结果与库内菌株血清型信息一致,与本室前期进行的单重PCR检测结果也完全一致,与此相比,荧光PCR方法在判定其致病型别上效率较高。
3 讨论与结论
致泻大肠埃希氏菌传统的检测方法如分离培养、生化鉴定以及血清学鉴定等,耗时耗力,而且不能有效地区分致泻大肠埃希氏菌和非致泻大肠埃希氏菌,因此,在传统的检测方法基础上,有必要进行大肠埃希菌的毒力基因检测,以避免漏检及提高其检出率[21]。
目前已有利用PCR技术检测毒力基因达到区分大肠埃希氏菌致病型别的相关研究,其研究方法一般为单重普通PCR、多重普通PCR以及多重荧光PCR。单重PCR方法通过检测大肠埃希氏菌中保守基因片段,虽特异性强、稳定性好,但只针对某类菌的检测和鉴定,无法区分不同致病型别的大肠埃希氏菌。多重普通PCR方法多用于某一类或几类致泻大肠埃希氏菌的鉴定和检测,以及不同致病型别致泻大肠埃希氏菌的区分,王涛等[22]使用多重PCR方法检测肠出血性大肠埃希菌O157:H7,确立了stx1、stx2、eaeA和hlyA 4 组毒力基因为筛查基因,检测灵敏度达到1.33×104CFU/μL,但不能覆盖所有致病型别大肠埃希氏菌的检测;赵爱兰等[23]使用多重PCR方法鉴定5 类致泻性大肠埃希菌和志贺菌,确立8 组基因为筛查基因建立了多重PCR方法,达到了致泻大肠埃希氏菌的检测和鉴定的目的,但普通PCR扩增结果需进行凝胶电泳进行检测,较为费时费力。多重实时荧光PCR方法目前则多用于大肠埃希氏菌同沙门菌、志贺菌等的区分或某类大肠埃希氏菌的鉴定,如金玉娟等[24]利用多重实时荧光PCR方法检测3 种致泻性大肠埃希菌和志贺菌,同样不能覆盖所有致病型别致泻埃希氏菌的检测。本研究选取5 种致泻大肠埃希氏菌11 组基因为靶基因设计引物和探针,建立多重实时荧光PCR方法,用于5 种致泻埃希氏菌的检测和致病型别的判定,对每种致泻大肠埃希氏菌采用2~4重荧光PCR检测,判定其致病性别,较之上述方法,该法具有更高的针对性、检测准确度以及区分力,且操作简便,省时省力,整个检测可在2 h内完成。
使用本方法进行大肠埃希氏菌检测时,有几类情况需要注意,有研究显示只有95%大肠埃希氏菌可检出uidA基因,存在不能检出的个例[25];另外,毒力基因可在细菌间转移,实际检测过程中可能存在一株菌中同时含有源自不同致病型别大肠埃希氏菌毒力基因的可能性。本研究在进行ETEC菌株的检测过程中,扩增出estla+estlb、uidA以及elt基因的同时,还扩增出了astA基因,有文献报道astA基因可在细菌间转移[26],当与其他毒力基因检测结果同时阳性时,则astA基因不作为型别判定依据。此外,由于EIEC菌株和志贺菌所引起的临床腹泻症状十分相似,且在实际检测中也发现EIEC菌株和志贺菌均可检出ipaH基因[27-29],uidA基因为大肠埃希氏菌特异性基因[30],EIEC可检出而志贺菌不能检出,所以本研究采用uidA基因及ipaH基因共同检测EIEC,可根据检测结果区分EIEC与志贺菌[31]。
综上所诉,本研究建立致泻大肠埃希氏菌多重荧光PCR检测方法,采用2 个体系对5 类致泻大肠埃希氏菌进行检测和鉴定,检测灵敏度可达到2.2×104~2.6×104copies/反应,34 株致泻埃希氏菌菌株和71 株非致泻埃希氏菌菌株验证结果同本实验室单重普通PCR验证结果基本相同,说明该方法具有较高的准确度,实验过程中对致泻大肠埃希氏菌和其他食源性致病菌进行检测,只有致泻大肠埃希氏菌与志贺菌能够产生扩增曲线,而其他食源性致病菌不能产生扩增曲线,说明该方法具有较好的特异性,可为食品生产销售或质量监控过程中的快速检测和大批量检测提供技术手段。
