程序性死亡因子配体1(PD-L1)在乳腺癌中的表达及其与临床病理参数的关系和预后分析
2018-11-28邱志敏王美鑑付爱荣王雅琦董涵之傅颖媛
邱志敏 王美鑑 付爱荣 王雅琦 董涵之 傅颖媛
乳腺癌是1个重要的全球卫生问题,在女性恶性肿瘤中高居首位。目前随着肿瘤综合治疗的深入开展,乳腺癌的诊疗越来越规范,患者生存期逐渐延长,尽管乳腺癌治疗已经获得非常成功,但是随着随访时间的延长发现10年内仍有50%的乳腺癌出现远处转移。针对激素受体阳性型乳腺癌可以给予内分泌药物维持治疗,针对HER-2过表达型可以给予靶向治疗,但是针对三阴性乳腺癌后续却缺乏更多有效的治疗手段,导致此类患者死亡率较高。因此迫切的需要在三阴性乳腺癌患者中寻找更多的可以有效预测疗效的生物标志物以及更多的治疗方法。有研究表明在三阴性乳腺癌患者肿瘤组织及肿瘤浸润性淋巴细胞中可见程序性死亡配体-1(programmed death ligand-1,PD-L1)的高表达[1]。程序性死亡配体-1(PD-L1)是PD-1的配体之一,是免疫检查点的一部分,对预防自身免疫至关重要[2]。PD-1/PD-L1信号通路的激活可以导致肿瘤逃脱T淋巴细胞的免疫监视从而出现免疫逃逸,而通过阻断PD-1/PD-L1信号通路可以使肿瘤细胞重新被T淋巴细胞免疫监视,从而达到杀灭肿瘤细胞的作用。本研究旨在系统比较三阴性乳腺癌、非三阴性乳腺癌及癌旁组织的PD-L1表达以及与临床病理参数的相关性,同时探讨PD-L1的表达与不同分子分型乳腺癌的生存关系及预后分析,为乳腺癌患者特别是三阴性乳腺癌患者的免疫检查点治疗提供可靠的理论依据。
1 材料与方法
1.1 一般资料
组织切片为经术后病理确诊为乳腺浸润性导管癌癌组织110例及同期术后癌旁组织30例。收集其完整的病理资料及临床资料。年龄为30~86岁,中位年龄48岁。N0期51例,N1期31例,N2期10例,N3期18例。M0期99例,M1期11例。行改良根治术99例,行保乳手术11例。Ⅰ期21例,Ⅱ期56例,Ⅲ期22例,Ⅳ期11例。ER阴性71例,阳性39例。PR阴性74例,阳性36例。三阴性乳腺癌50例,HER-2过表达型、LuminalB型、LuminalA型各20例。
1.2 材料与试剂
来自Abcam公司的兔抗人PD-L1单克隆抗体(克隆号28-8),来自Dako公司的DAB染色剂及Dako EnVision TM检测系统,PBS缓冲液、EDTA修复液、苏木精染液、柠檬酸缓冲液均来自广州安必平公司。
1.3 免疫组化方法
将蜡块进行常规切片,二甲苯、酒精脱蜡,水化及高压锅抗原修复,滴加相应抗体,阴性对照片上滴加PBS缓冲液,滴加已配好的DAB显色液显色,苏木精染液复染,封片,酒精脱水,二甲苯透明,中性树胶进行封片,最后在显微镜下进行阅片。根据阳性细胞占所在组织所有细胞的比例及阳性细胞染色深浅来进行计分判断。按显色细胞数占百分比:显色的阳性细胞所占百分比<5%计0分,5%~25%计1分,26%~50%计2分,51%~75%计3分,>75%计4分;按阳性细胞显色深浅计分:无阳性细胞显色为0分,1+即浅黄色为1分,2+即棕色为2分,3+即深褐色为3分。根据阳性细胞所占百分比分数及阳性细胞显色深浅分数相乘。>1为阳性,≤1则为阴性。
1.4 统计学方法
应用SPSS 19.0统计软件进行统计分析,PD-L1表达与临床病理参数相关性采用Spearman等级相关统计分析,累计生存率的比较采用Kaplarn-Meei检验,单因素分析比较采用Logistic回归分析,多元回归分析采用多因素COX回归模型进行统计分析,所有的检测都是双侧的,P<0.05表示差异具有统计学意义。
2 结果
2.1 PD-L1在乳腺癌中的表达结果
三阴性乳腺癌PD-L1阳性表达36%,HER-2过表达型乳腺癌PD-L1阳性表达25%,luminalB型乳腺癌PD-L1阳性表达20%,luminalA型乳腺癌及癌旁组织PD-L1阳性表达0(图1)。免疫组化染色结果显示:27例乳腺癌患者PD-L1阳性表达,镜下可见深浅不同的着色(深褐色至浅黄色);PD-L1阴性镜下则未见明显着色。
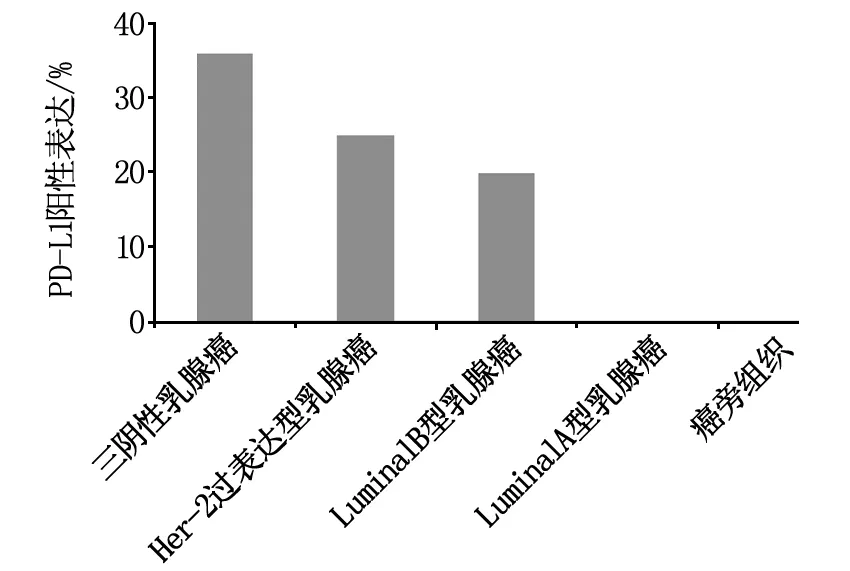
图1 PD-L1在乳腺癌癌组织及癌旁组织中的表达结果
2.2 PD-L1表达与乳腺癌临床病理特征的相关性分析
单因素分析提示:PD-L1表达与阳性淋巴结、TNM分期呈正相关,与ER、PR受体呈负相关。行改良根治术的患者PD-L1表达率远远高于行保乳手术的乳腺癌患者,具有统计学差异。PD-L1表达在三阴性乳腺癌中较非三阴性乳腺癌中高,且有统计学意义(表1)。多因素分析提示:PD-L1表达与阳性淋巴结个数及TNM分期相关(表2)。
2.3 各临床病理特征与临床预后关系相关性分析
单因素分析提示:总生存期与阳性淋巴结个数、肿瘤大小、TNM分期、PD-L1表达率呈负相关,与ER、PR状态呈正相关;总生存期与分子分型相关,其中三阴性乳腺癌及luminal B型乳腺癌中PD-L1表达阳性与预后差相关,且有统计学意义(表3)。多因素分析提示:PD-L1表达是影响乳腺癌临床预后的唯一预测因素(表4)。
2.4 PD-L1表达与乳腺癌患者总生存期的关系
多因素分析提示:乳腺癌患者中PD-L1表达是影响患者临床预后的独立危险因素。

表1 PD-L1在乳腺癌中的表达与其临床病理特征的相关性单因素分析/例

表2 PD-L1表达与乳腺癌临床病理特征的相关性多因素分析
3 讨论
乳腺癌是女性最常见的恶性肿瘤,其发病率在世界各地迥然不同。我国乳腺癌发病率在北京、上海等发达城市高发[3]。对于激素受体阴性及HER-2阴性的患者给予手术及放化疗之后缺乏有效的维持治疗手段,而且三阴性乳腺癌发病年龄较轻、侵袭性高、分化差、内脏转移多、预后极差,目前临床上缺乏有效的特异性治疗手段。但是考虑这种类型的乳腺癌被证明是免疫原性肿瘤,所以系统免疫疗法利用患者自身的免疫系统直接消灭和靶向肿瘤细胞已作为三阴性乳腺癌(triple negative breast cancer,TNBC)有效的治疗手段[4]。
PD-1/PD-L1信号通路是目前免疫靶向治疗的热点话题,被越来越多的研究者所关注,它是一对协同刺激分子,其在T淋巴细胞的激活过程中起着负性调节作用。目前PD-L1在许多恶性肿瘤中均有表达,如非小细胞肺癌、尿路上皮癌、软组织肉瘤、乳腺癌、恶性黑色素瘤、肠癌等大部分实体瘤中均有表达。在已经报道不同的研究中PD-L1在恶性肿瘤中的表达差异较大(1.7%~58%)[5-8]。本研究乳腺癌PD-L1阳性表达率为24.5%,在三阴性乳腺癌PD-L1阳性表达率高达36%。
Sang等[6]发现乳腺癌中PD-L1表达与高组织学分级、阴性淋巴结、病理分期早、高肿瘤浸润细胞数目、激素受体阴性表达、HER-2阳性表达、表皮生长因子受体、P53及高增殖表达呈正相关。QIN等[7]发现在乳腺癌中PD-L1高表达与大负荷肿瘤、较高的组织分级、转移性淋巴结及激素受体表达阴性呈正相关。Muenst等[8]发现乳腺癌PD-L1表达与年龄、肿瘤大小、原发肿瘤的分类、肿瘤分级、淋巴结转移状态、激素状态及肿瘤增殖情况等相关。Li等[9]研究发现高PD-L1表达和增加的FOXP3+Treg浸润均与高组织学级别、阴性ER有关,还有PR状态和侵略性的肿瘤亚型,尤其是基底样的亚型相关。本研究发现PD-L1高表达与阳性淋巴结、TNM分期呈正相关,与雌激素受体、孕激素受体呈负相关;与分子分型相关,特别是三阴性乳腺癌表达高于非三阴性乳腺癌;与手术方式相关,改良根治术患者PD-L1表达明显高于保乳手术患者。

表3 影响乳腺癌总生存率的临床病理特征单因素分析
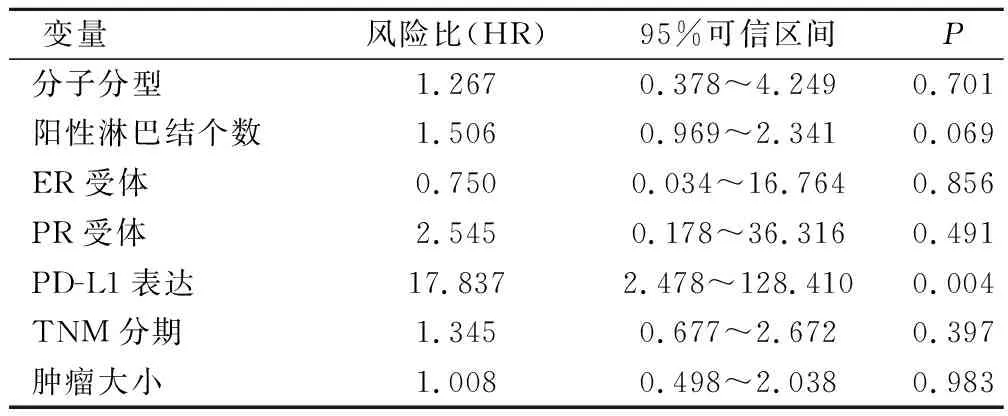
表4 影响乳腺癌总生存率的多因素分析
Sang等[6]研究发现PD-L1是乳腺癌独立的预后预测因子。Muenst等[8]研究发现PD-L1的表达与总生存期呈负相关,是总生存期独立不良预后因素。Li等[9]研究发现PD-L1和FOXP3+Treg的高表达与更差的预后相关,这两个标记物都是降低患者总体生存的独立预测因子。Baptista等[10]研究发现乳腺癌中PD-L1的表达与乳腺癌患者的总体生存率有显著的相关性。Pan等[11]研究中发现间质肿瘤浸润淋巴细胞中PD-L1高表达能显著提高总生存期和无进展生存。本研究发现对总生存期有影响的阳性淋巴结个数、肿瘤大小、TNM分期、ER、PR、分子分型、PD-L1表达等因素纳入COX多因素分析,结果发现PD-L1的表达是影响乳腺癌临床预后的唯一预测预后因子;亚组分析提示在三阴性乳腺癌及luminal B型乳腺癌中PD-L1表达阳性与不良的总生存相关。
PD-1/PD-L1信号通路的激活可以使肿瘤细胞逃脱T淋巴细胞的监视而导致免疫逃逸,从而使肿瘤细胞活跃终使机体患有肿瘤或者使肿瘤出现复发及转移,而通过阻断该通路可以使T淋巴细胞重新监视肿瘤细胞继而杀灭肿瘤细胞。PD-L1高表达患者能更好地进行有效的免疫治疗,本研究证实了在乳腺癌中特别是三阴性乳腺癌PD-L1高表达,这为乳腺癌特别是三阴性乳腺癌的免疫治疗研究,提供1个有效的实验依据。
