超声引导下微波消融治疗复发性肝细胞肝癌严重并发症探讨*
2018-11-26俞小炯
张 浩 许 建 俞小炯 龚 军 周 瑶
(四川省医学科学院·四川省人民医院·电子科技大学附属医院肝胆胰外科,四川 成都 610072)
自1994年Seki等[1]首次报告超声引导下经皮穿刺将微波天线置入瘤体内治疗小肝癌获得成功以来,经皮微波消融治疗(Percutaneous Microwave Ablation,PMWA)通过对微波仪和天线的不断改进创新得到快速发展。肝细胞肝癌(Hepatocellular Carcinoma,HCC)是好发于肝脏最常见的恶性肿瘤之一,手术切除是首选治疗方案。但因为术后复发率高,很多患者术后需要二次治疗。PMWA作为一种经皮微创治疗手段,现已常规应用于肝脏肿瘤的治疗[2-3],特别是对直径3cm以下肝脏占位,疗效与手术相当[4],而对复发性肝癌的治疗研究[5],现也已逐步开展中。但因为复发肝癌患者病情相对复杂,相关合并症较多,相关研究较少,应用PMWA治疗复发HCC的术后并发症研究就更少。本研究回顾性分析2014~2016年期间我科收治的128例行微波消融治疗的肝癌复发患者术后严重并发症情况,以总结相关临床经验。
1 资料与方法
1.1 一般资料 回顾性分析2014年1月~2016年12月期间在我院诊断为HCC的患者资料,筛选出HCC术后复发并行PMWA的患者。纳入标准:①HCC诊断标准参照美国肝病研究学会(AASLD)指南[6]。②单个肿瘤≤5cm,或多个肿瘤(个数≤5个,单个≤5cm)且直径总和≤8cm。③不伴有大血管癌栓(门静脉主干及主要分支、肝静脉、下腔静脉等)。④患者有手术意愿,能够配合手术。⑤术前超声检查确认有穿刺路径。⑥血小板计数≥40×109/L,血浆凝血酶原时间(Prothrombin time,PT)≤18s。 ⑦无其他合并肿瘤。⑧无影响全麻手术进行的其他疾病。结果一共纳入128例患者,其中男性96例(75.00%),女性32例(25.00%),平均年龄(51.52±9.67)岁。95例患者感染乙肝/丙肝,81例患者甲胎蛋白(alpha-fetal protein,AFP)≥400ng/ml,肝硬化患者93例,肝功Child A级82例,B级37例,C级9例。肿块平均直径(3.02±1.85)cm。98例(72.66%)为单发病灶,26例(20.31%))为两个病灶,14例(7.03%)为3个以上病灶。
1.2 治疗仪器 使用南京康友KY-2000型微波消融治疗仪,微波频率为2450MHz,输出功率1~100 W;微波辐射电极系硬质内水冷针式,外径1.8mm(14F),长18~20mm;彩超为美国GE-LOQIQ S8型。
1.3 治疗方法 全组病例术前均确诊复发,并行增强CT/MRI确定复发位置、体积和个数;术前一天,在超声造影下确定最佳进针部位和途径;术中行静吸复合全麻,尖刀切皮2mm后,消融针在彩超引导下穿刺,避开大血管、胆道及附近重要器官组织,根据病灶位置和直径选择不同功率(80~100 W)和作用时间(6~12 min)进行消融,术中超声动态观察病灶固化效果。治疗目标:完全毁损肿瘤以及外周0.5 cm以上肝组织。对直径>3cm病灶,采用多点位,外周向中央消融方式;对多发病灶,进行多部位穿刺微波消融。消融结束后,常规退针同时,毁损针道,拔针,术区覆盖无菌纱布。
1.4 术后处理及随访 术后常规予保肝止血对症处理,复查相关生化指标;术后1个月复查增强CT或MRI或超声造影。术后并发症按照Goldberg[7]定义:严重并发症为并发症出现以后,不接受治疗,可能会危及生命,导致实质性的损害或残疾,护理等级提高或延长住院1周以上,而其他并发症被认为是一般并发症。消融效果判定:原病灶区域被消融区域完全覆盖,边缘清晰,无增强者为完全消融(complete ablation,CA);消融区域边缘模糊、内部有增强、彩色多普勒检查局部显示有血流信号者为不完全消融。对消融不完全或其他部位复发患者,予以再次消融治疗。术后随访采用门诊随访及定期电话随访方式,2年内每3个月门诊复查1次增强CT或MRI及甲胎蛋白等以判断治疗效果;2年后每6个月复查1次。
1.5 统计学分析 应用SPSS 17.0 统计软件进行分析,计数资料采用χ2检验,非正态分布计量资料用Z检验,组间两两比较采用2分割法,检验水准:a′=0.0125,以P<0.0125为差异有统计学意义。
2 结果
2.1 治疗情况及结果 全组128例患者164个病灶,共实施183次消融治疗。其中112例136个病灶为完全消融,不完全消融病例均二期行完全消融满意。在128例患者中,有41例为介入术后患者,介入次数在1~3次不等;17例有二次肝切除术病史;6例为二次肝切除联合介入术患者;其余64例未行其他特殊治疗。
2.2 并发症及处理 术后一般并发症,如发热、疼痛、恶心呕吐、高血压等,均予以对症治疗后,1~3d左右即缓解;而对高血压和血糖紊乱等,针对原发疾病进行相应治疗后缓解;对无症状胸腔积液7例,均保守治疗后好转。严重并发症包括:有症状的胸腔积液2例,肝功能不全3例,肝脏出血2例,肝脓肿1例,种植转移1例;胆道损伤并发胆漏、肝衰导致死亡1例,一共10例,见表1。
2.2.1 术后并发胸腔积液9例,4例患者病灶在Ⅶ段,2例患者病灶位于Ⅷ段,2例病灶位于Ⅶ~Ⅷ段之间,1例患者病灶位于II段边缘。9例患者中,2例术后第3d左右出现胸闷、气紧等症状,彩超提示右侧胸腔大量积液,在彩超引导下右侧胸腔穿刺置管引流,3d左右复查彩超无明显积液后拔除引流管;其余7例无症状胸腔积液患者均为术后常规复查胸片时,提示右侧(6例)或左侧(1例)胸腔积液,予以口服利尿剂等对症支持后缓解。
2.2.2 3例肝功不全患者均为肝功Child C级,2例为多发病灶,术后出现胆红素升高、部分凝血活酶时间延长、腹水,均予以积极保肝退黄治疗,肝功能缓慢恢复,病程延长至术后3周到2个月不等。2例肝脏出血患者为乙肝后肝硬化门脉高压患者,均为单发病例,1例肝功Child B级,PT 15.3s;1例C级,PT 16.1s,术后因失血性休克,腹腔穿刺抽出不凝血,积极再次手术止血,后痊愈出院。

表1 10例HCC复发患者PMWA术后严重并发症Table 1 HCC patients with severe complications after PMWA
2.2.3 1例肝脓肿患者既往有糖尿病病史,术后1个月诉反复高热来院,复查增强CT提示右肝消融区域直径5cm炎性包块,考虑肝脓肿形成,遂彩超定位穿刺置管引流后缓解,引流1个月后,引流管无脓液流出,复查CT脓肿缩小,无明显脓腔后拔管;术后2个月复查CT,脓肿完全消失。
2.2.4 1例种植转移患者术后第6个月诉右季肋区疼痛,复查增强CT提示腹腔内局部种植转移;1例死亡患者病灶位于第一肝门,直径3.5cm,消融时肝门胆管损伤,出现胆漏,后反复炎症狭窄、胆管炎,胆汁性肝硬化并发肝衰,术后13个月死于多器官功能衰竭。
2.3 影响PMWA术后严重并发症的单因素分析 结果表明,PMWA治疗复发肝细胞肝癌术后严重并发症与肿瘤直径、肿瘤数目和实施年度分布有关(均P<0.05),与患者年龄、性别、Child分级、是否肝硬化、AFP高低、是否乙肝/丙肝、病灶部位、既往治疗史无关(均P>0.05),见表2;同时也与消融时间长短(Z=-0.754,P=0.223)及反复消融次数无关(Z=-1.022,P=0.825)。对实施年度进一步两两比较,2014年度vs 2015年度:2=1.300,P=0.254;2014年度 vs 2016年度:2=5.074,P=0.024;2015年度 vs 2016年度:2=0.501,P=0.479,按照3组间两两比较的检验水准,各年度间两两比较无统计学差异。
3 讨论
本组患者术后严重并发症发生率为7.81%(10/128例),病死率为0.78%(1/128例),比文献报道的PMWA术后严重并发症发生率和病死率高(分别为2%~5.2%和0.3%~0.5%)[8-12],但仍远低于HCC开腹手术后的并发症发生率(20%~50%)[13-14]。总体上,消融术后严重并发症的发生可能与肿瘤直径[9,12]和肿瘤数目[9,15]有关。Iida等[16]也认为,肿瘤大小及多次反复消融是肝脓肿形成的重要危险因素。特别伴有糖尿病等基础免疫力低下的患者,围手术期应用抗生素,可能对肝脓肿的预防有一定帮助[17];而较大的肿瘤体积和肝功能Child B或C级是发生消融术后肝衰的危险因素[12]。本组3例患者术后并发肝功能不全,瘤体直径总和分别是4、5和6.5cm,且均为Child C级患者,术中为达到完全消融效果,消融体积较大,导致术后肝功能不全。因此,术前准确把握消融指针,术中适当控制消融体积,必要时行二期消融等措施,或可对预防此类并发症有一定帮助。
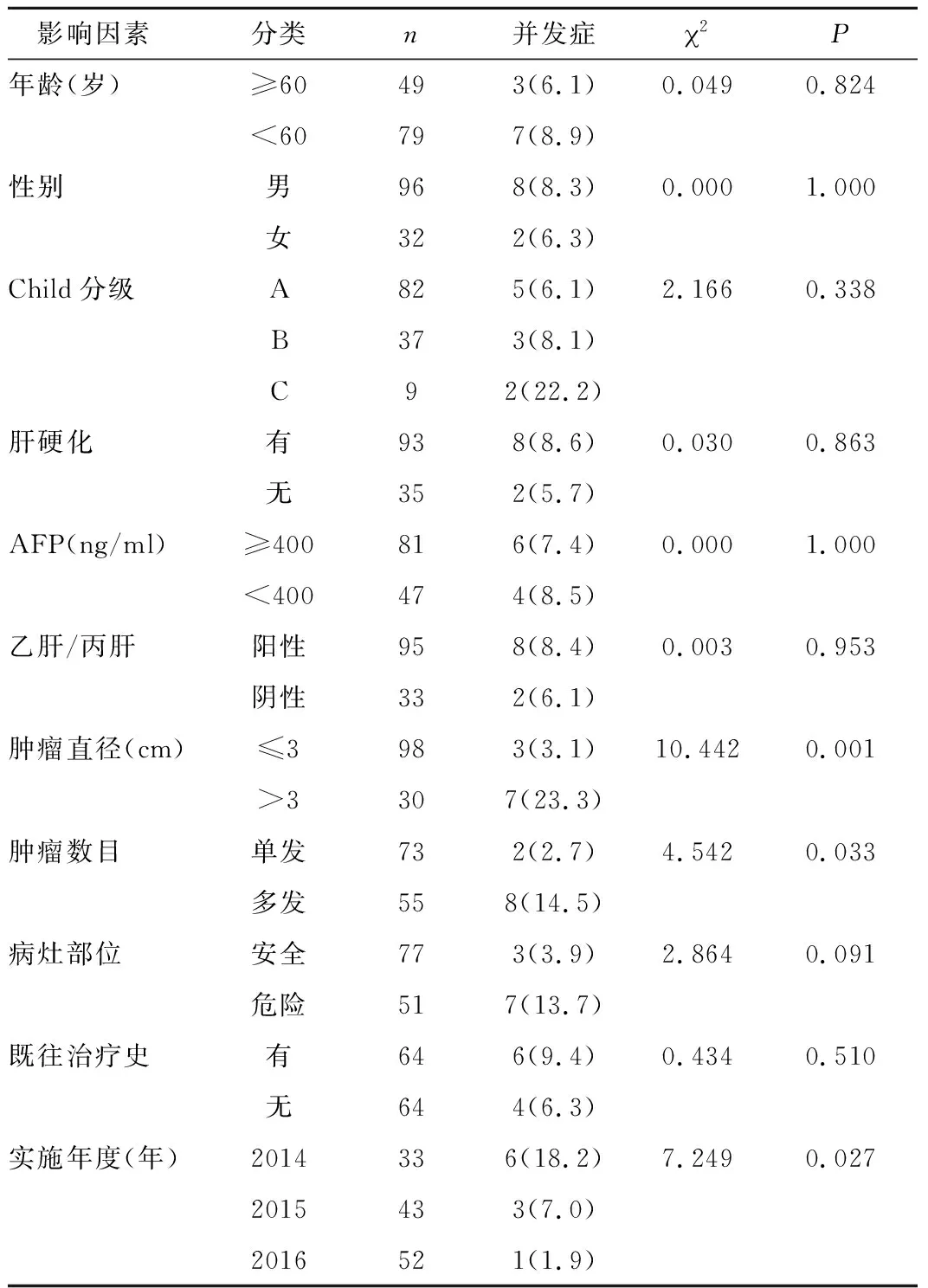
表2 影响PMWA术后严重并发症因素[n×(10-2)]Table 2 The related factors of serious complications after PMWA
PMWA术后出血是少见而严重的并发症,甚至可能危及患者生命。本组2例(1.56%)患者出现术后出血,与Mulier S[11]等报道2%相当,术中探查发现是穿刺孔活动性出血,考虑与术中反复穿刺及针道消融不完全有关。因此,术中减少进针次数,针道完全消融和术后密切随访是预防和控制此类风险的主要措施[8,11]。而一般认为,无症状胸腔积液不是严重并发症[15,18]。但值得注意的是,本组9例术后发生胸腔积液的患者中,8例患者病灶位于右肝边缘,靠近膈肌位置,提示类似位置的消融治疗可能会刺激膈肌,造成胸腔积液的产生。因此,对此类患者必要时可以行人工腹水以减少膈肌的热损伤。
关于PMWA术后种植转移,Liwaghi[19]和Mulier[11]均认为与病灶位于肝表面及术前穿刺活检病史有关。本组有1例发生术后种植转移,也与反复穿刺取样有关。对于HCC术后复发患者,病理结果已经不是必须。因此术前和家属积极沟通,尽量避免或减少病灶穿刺取样,同时术中对针道完全消融,包括皮下组织,可能会对减少种植转移有一定意义。
有研究表明,肝门附近的肿瘤患者PMWA术后并发症发生率明显高于肝实质肿瘤患者,同时肝门部位肿瘤PMWA治疗后的复发率也较高[20-21],因此对这种部位的消融治疗就需要更加慎重。Wakamatsu等[22]回顾性研究了170例行消融治疗的HCC患者资料,发现15例出现消融相关Glisson系统并发症,总体生存时间降低,是影响预后的独立危险因素。本组1例死亡患者即是肝门部HCC复发,消融导致肝门胆管损伤,炎症狭窄,最终引致肝硬化并发多器官功能死亡。因此,肝门处HCC的消融治疗,宜在腹腔镜下或开腹消融为宜,术中行胆总管内置管,生理盐水快速冲洗等胆道降温措施进行[23],或可一定程度上避免此类并发症发生。
还有研究发现,早期PMWA治疗年份也是发生严重并发症的危险因素[24]。本研究也证实,PMWA治疗年份越早,严重并发症发生率越高,虽然进一步统计分析没有相关统计学意义。但对才开展PMWA治疗的单位,需要更加重视,或可采用以下措施[8,21,23]来预防和控制PMWA术后严重并发症的发生:①由经验丰富的介入医师,从肝脏实质内较小占位开始。②术前严格把握手术适应证,控制血糖、血压等伴发疾病。③术中减少进针穿刺次数(必要时无须活检)。④对位于肝脏膈面或脏面部位病灶,采用人工胸水或腹水。⑤对于第一肝门病灶采用胆道降温等措施。⑥退针时完全消融针道至皮下组织[24]。
4 结论
消融治疗是一种安全有效的治疗HCC 方法,是近年来临床治疗原发性肝癌的重要手段[8,25],其局部肿瘤的治疗率和远期生存率,与再次开腹手术比较没有差异,但术后并发症发生率更低和住院时间更短[26]。同时PMWA作为一种微创治疗方式,对多病灶、肝功能分级差、巴塞罗那分期晚的患者,更有优势[27],更加适合HCC术后复发患者。但严重并发症的发生,影响到患者的身体健康,甚至危及生命。因此,只要术者术前严格把握消融指针,术中采取积极有效的预防措施,PMWA可以成为HCC术后复发患者治疗的首选方式。
