肺结核患者肺组织微生物组特征研究
2018-11-21王宇轩王冲董宇杰杜伟丽宋婧刘子臣李琨刘树库车南颖
王宇轩 王冲 董宇杰 杜伟丽 宋婧 刘子臣 李琨 刘树库 车南颖
微生物组是指某一特定环境内全部微生物的总和。目前普遍认为,人体内有很多共生微生物菌群,其基因组含量总和是人类基因组总和的100倍,这些菌群无法通过传统的培养方法进行鉴定,但与人类的健康与疾病息息相关。新一代高通量测序(next generation sequencing,NGS)技术通过对环境中16S rRNA进行测序,几乎能检测到环境中所有的微生物,这使特定生物样品中微生物组的研究成为现实。有研究通过NGS技术表明,肺部存在微生物,证明肺部不是无菌的,并且这些微生物分布特征与肺部的健康与疾病状态有着一定的关联[1-3]。已经有研究表明,一些慢性肺部疾病如慢性阻塞性肺疾病,其疾病的发生发展与肺部微生物的改变有很大关系[4-6]。当前对于肺结核患者的肺部微生物组特征的研究非常有限,已有研究主要使用不同患者的痰或支气管灌洗液等新鲜标本来研究肺部微生物组,但这些标本的获取都是通过气管与支气管,无法研究同一患者不同部位的微生物组差异,这就难以反映肺部微生物组最真实的分布及变化。目前,从福尔马林固定石蜡包埋(formalin-fixed and paraffin-embedded,FFPE)的组织标本中提取DNA的技术已经非常成熟,可以使用测序方法检测到抗酸杆菌的DNA[7]。FFPE组织标本具有可以长期保存和可重复检测的优点,这使其能广泛应用在临床病理诊断的项目中,如结核分枝杆菌(MTB)的检测和肿瘤基因突变。笔者采用激光显微切割技术,按照肺结核病理组织分类将同一患者的FFPE组织切片分为坏死区、肉芽肿区和无病变正常肺区,采用NGS技术对配对样品进行测序,探索肺部不同病变区和正常区的微生物组特征,以期为临床诊断提供一定依据。
材料和方法
1.组织标本:选取2016—2017年首都医科大学附属北京胸科医院10例临床及病理确诊为肺结核患者的FFPE手术治疗标本。对10例患者的FFPE标本进行切片、捞片、苏木素-伊红染色(hematoxyli-neosin staining,HE),在显微镜下观察并选取典型的结核病灶。坏死区域选取标准:镜下观为红染无结构的颗粒状物;肉芽肿区域选取标准:镜下观为类上皮细胞、郎汉斯巨细胞、淋巴细胞和成纤维细胞;无病变正常肺区域(简称“正常肺区”)选取标准:镜下观肺泡间隔纤细,肺泡壁上90%以上为Ⅱ型肺泡上皮细胞。
2.显微切割:使用LEICA RM2135(德国Leica公司)切片机将每个FFPE组织切8~12张4 μm厚的样品切片至LEICA HI1220(德国Leica公司)摊片机中,捞取置LEICA Membrane Slides(德国Leica公司)专用载玻片上。使用LEICA AUTO STAINER XL(德国Leica公司)全自动染色仪进行HE染色,染色后不封片。将染色后的玻片置于LEICA LMD7000(德国Leica公司)激光显微切割仪上,根据上述提到的镜下形态及组织大小,切割所需组织,使用离心管收集组织片。
3.DNA提取:提取通过显微切割收集的不同区域的组织片中的DNA。在装有组织片的离心管中加入250 μl DNA裂解液后,放入TIB核酸提纯仪[泰普生物科学(中国)有限公司]中并选择DNA程序30 min。按照TIB DNA-FFPE-RY[泰普生物科学(中国)有限公司]核酸提取试剂说明进行提取。最终,用50 μl洗脱缓冲液将提取到的DNA洗脱至1.5 ml离心管中。
4.PCR扩增及质量控制:使用地球微生物组计划推荐的16S rRNA V4区域通用引物(515F-GCTCCAGCMGCCGTAA,806R-GGACTACHV-GGGTWTCTAAT)进行PCR,扩增16S rRNA基因。引物由生工生物工程(上海)股份有限公司合成。PCR扩增试剂盒和PCR仪分别采用2×KAPA HiFi HotStart Ready Mix(美国Kapa Biosystems公司)和BIO-RAD C1000 Touch(美国Bio-Rad公司)。PCR扩增条件:94 ℃ 5 min;94 ℃ 30 s,45 ℃ 30 s,65 ℃ 30 s,5个循环;94 ℃ 30 s,50 ℃ 30 s,65 ℃ 30 s,10个循环;94 ℃ 30 s,55 ℃ 30 s,65 ℃ 30 s,25个循环;72 ℃ 5 min。使用2%琼脂糖凝胶电泳对扩增产物进行质量检测,选出扩增条带为500 bp左右的样本,采用AMPure XP Beads(美国Beckman Coulter公司)磁珠纯化PCR扩增产物。
5.测序及原始数据处理:采用Illumina HiSeq PE250(美国Illumina公司)测序仪对不同区域的组织DNA进行高通量测序。采用QIIME 1.8.0对原始数据进行过滤、拼接,得到的有效数据做OTU(operational taxonomic units)聚类和物种注释分析。根据GREENGENE数据库,对OTU的代表序列做物种注释,得到对应的物种信息和物种的相对丰度分布情况。应用goods_coverage表示测序深度能否覆盖样品中全部微生物;Chao 1指数和Shannon指数表示样品物种多样性。
6.统计学分析:使用原始数据,在Rv 3.5软件中计算出微生物组属水平的Bray-Curtis距离用于主坐标分析(principal co-ordinates analysis,PCoA),并利用非参数多元方差分析进行组间差异分析。通过SIMCA-P对物种相对丰度做偏最小二乘法判别分析(partial least squares discrimination analysis,PLS-DA)得到变量投影重要性(variable important projection,VIP)值,采用SPSS 21.0软件对物种相对丰度进行配对样品非参数Wilcoxon秩和检验确定组间有差异的菌种,以P<0.05为差异有统计学意义。利用Rv 3.5软件,将门水平和属水平的物种信息绘制成韦恩图。在GraphPad Prism 5软件中,将不同组织区域的物种相对丰度绘制箱型图和折线图。
结 果
1.样本信息及物种多样性:10例患者石蜡样品切片依次按照坏死区、肉芽肿区、正常肺区进行显微切割,得到30份配对样本,其中27份测序成功,3份因样品微生物DNA含量较低而导致测序失败,最终得到8例患者(24份)完整的配对样品结果,2例患者(3份)非配对样品结果。所有样品的goods_coverage均>99.9%,说明所获得的高通量序列能覆盖样本中几乎所有的微生物。Chao 1和Shannon指数坏死区分别为359.18±77.88和4.19±0.39;肉芽肿区分别为298.83±40.23和3.73±0.39;正常肺区分别为257.16±48.37和3.59±0.48。将基于属水平的Bray-Curtis距离的β多样性结果做PCoA排序分析(图1),结果表明除正常肺区样品外,病灶区域即坏死区和肉芽肿区样品聚集到一起,说明正常肺区和病灶区的微生物群落组成有差异。

图中各点距离代表不同样本间微生物组特征差异,PCoA1为最大解释数据变化的主坐标成分,PCoA2为解释余下的变化度中占比例最大的主坐标成分图1 肺结核患者病理组织石蜡样品切片不同病理组织分类区域主成分分析
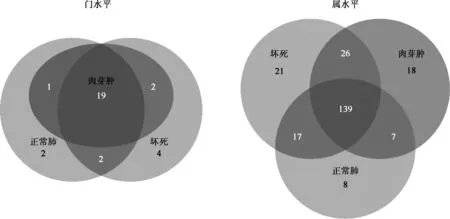
图2 肺结核患者肺部各区域门水平及属水平微生物分布韦恩图
2.门水平微生物组特征:在门水平上,肺部微生物成功注释到的有30种,其中坏死区27种,肉芽肿区21种,正常肺区23种,3种区域共有的细菌有19种(图2)。肺结核患者肺部微生物主要含有Proteobacteria、Actinobacteria、Firmicutes、TM7和Bacteroidetes(表1)。Adonis分析显示坏死区与肉芽肿区(F=1.39,P=0.261),坏死区与正常肺区(F=1.33,P=0.271),以及肉芽肿区与正常肺区(F=1.118,P=0.323)之间的微生物群落组成差异无统计学意义。基于Bray-Curtis距离的Adonis分析表明,3种不同组织区域的微生物群落组成在门水平上差异无统计学意义。
表1 主要微生物在肺结核患者肺部各区域门水平相对丰度的比较
3.属水平微生物组特征:本研究的27个样本在属水平上共注释236个属,其中坏死区有203个,肉芽肿区190个,正常肺区171个,3种区域共有的类群有139个属(图2)。基于Bray-Curtis距离的多元方差分析表明,坏死区和肉芽肿区的微生物组差异无统计学意义(F=1.11,P=0.288),而坏死区和正常肺区(F=3.94,P=0.005),肉芽肿区和正常肺区(F=4.76,P=0.002)的微生物组差异有统计学意义。总的来说肺结核患者肺部微生物主要含有7个主要属(相对丰度>1%),依次为Ochrobactrum、Sphingomonas、Corynebacterium、Brevundimonas、Brevibacterium、Sphingobacterium和Enhydrobacter。在相对丰度<1%的属中,PLS-DA分析表明Kocuria和Tsukamurella在不同的组织部位差异较大(表2)。
表2 主要微生物在肺结核患者肺部各区域属水平相对丰度的比较

图3 肺结核患者肺部不同区域属水平部分微生物的相对丰度差异
根据细菌的相对丰度和组间非参数Wilcoxon秩和检验P值(P<0.05),确定了8种在肺结核患者肺组织中比较重要的微生物,它们在不同组织部位的相对丰度差异以箱型图展示(图3)。从图中可以看出,Ochrobactrum(Z=2.31,P=0.021)和Brevundimonas(Z=2.31,P=0.021)在正常肺区的相对丰度高于坏死区。Sphingomonas(Z值分别为-2.89和3.02,P值均<0.05)和Kocuria(Z值分别为-3.75和3.58,P值均<0.05)在坏死区和肉芽肿区的相对丰度均高于正常肺区。Enhydrobacter(Z=-2.49,P=0.012)在坏死区的相对丰度高于肉芽肿区。Sphingobacterium(Z值分别为2.31和-2.78,P值均<0.05)在正常肺区的相对丰度高于坏死区和肉芽肿区。Tsukamurella(Z值分别为2.04和2.60,P值均<0.05)在正常肺区的相对丰度高于坏死区和肉芽肿区。Mycobacterium(Z值分别为-2.84和-2.79,P值均<0.05)在坏死区的相对丰度高于肉芽肿区和正常肺区。
同时,将成功配对的8例患者标本中上述8种重要微生物的相对丰度用折线图展示(图4)。从图中可以看出,Ochrobactrum在正常肺的相对丰度与坏死区相比呈上升趋势(Z=2.10,P=0.036)。Sphingomonas(Z值分别为-2.38和2.38,P值均<0.05)在正常肺区的相对丰度相比于坏死区和肉芽肿区下降。Enhydrobacter(Z值分别为2.10和-2.38,P值均<0.05)和Mycobacterium(Z值分别为2.10和-2.37,P值均<0.05)在坏死区的相对丰度相比于肉芽肿区和正常肺区上升。Sphingo-bacterium(Z值分别为2.52和-2.10,P值均<0.05)和Kocuria(Z值分别为-2.52和2.37,P值均<0.05)在正常肺区的相对丰度相比于坏死区和肉芽肿区上升。Brevundimonas和Tsukamurella的相对丰度没有明显变化。此外,配对样品相对丰度结果表明肺结核致病菌Mycobacterium并不是肺结核患者肺中主要的微生物,这类致病菌主要存在于肺结核病灶的坏死区(表3)。
表3 主要微生物在肺结核配对患者肺部各区域属水平相对丰度的比较

图4 8例样品配对肺结核患者肺部各区域属水平部分微生物分布的变化趋势
讨 论
笔者探索了肺结核患者肺部不同组织区域配对样品的微生物组特征。在属水平上,坏死区和肉芽肿区微生物组分布特征未见统计学差异;而坏死区和正常肺区,肉芽肿区和正常肺区中微生物群落组成差异有统计学意义。研究表明,肺结核患者痰液中的微生物种类远高于健康人群[8-9],这与笔者研究结果基本一致。无论从门水平还是属水平上,结核病肺部坏死区注释到的物种都是最多的,这可能和坏死区组织形态结构改变有关。Cheung等[10]对肺组织新鲜标本的研究结果表明,肺部微生物在门水平上主要有Proteobacteria、Firmicutes、Bacteroidetes和Actinobacteria。这与笔者研究结果一致,即无论是在病灶区域,还是在远离病灶的正常肺组织中,主要的微生物类群也为以上4种。此外,笔者还发现在肺部存在TM7类群并占据较高的相对丰度。目前TM7无法通过培养获得,对其研究甚少。He等[11]从口腔中发现了TM7门,认为其会抑制巨噬细胞中的肿瘤坏死因子α(TNF-α)的诱导表达,从而抑制体内的免疫应答。
研究表明,肺部主要的微生物有Sphingomonas、Streptococcus、Prevotella和Veillonella等[1-2]。笔者采用肺部配对FFPE组织来直接反映肺部不同组织部位的微生物分布特征,结果表明无论是坏死区、肉芽肿区还是正常肺区,Ochrobactrum、Sphingomonas、Corynebacterium、Brevundimonas、Brevibacterium、Sphingobacterium和Enhydrobacter均为主要类群。Zhou等[12]研究发现,结核病患者患侧肺和健侧肺患者的肺部微生物组是相似的,这与笔者研究结果一致。此外,笔者发现即使是肺结核病灶的坏死区,Mycobacterium依然不是优势菌种,这和很多实验室的研究是一致的[12-15]。而对于结核病与正常肺之间微生物组属水平的差异,笔者研究结果表明Sphingomonas、Enhydrobacter、Kocuria以及Mycobacterium的相对丰度从坏死区、肉芽肿区到正常肺区呈下降趋势。Ochrobactrum和Sphingobacterium属的相对丰度呈上升趋势。之前已有学者利用新鲜样本研究肺结核患者微生物分布特征。Wu等[14]研究表明,结核病患者痰液中Streptococcus、Pseudomonadaceae和Gramulicatella相对丰度较高。Krishna等[15]研究表明,结核病患者痰液中Rothia、Leuconostoc和Lactobacillu相对丰度较高。不同实验室的研究结果并不完全相同,原因可能是肺部微生物组的特征受到地域、饮食、环境等很多因素的影响,并且个体之间也存在着一定差异。其次,Hahn等[16]研究表明,不同的测序仪或不同的扩增片段都会对结果造成影响。此外,以往研究者们大多使用痰液或支气管灌洗液来研究肺部微生物组特征,这难以排除口腔菌群的影响。笔者使用FFPE样品,与以往研究的样本类型不同,可能也会对结果造成影响,但仍然需要进一步的研究。
对于肺结核患者而言,结核分枝杆菌是致病菌,在临床病理工作中主要通过抗酸染色来诊断其感染,并且Mycobacterium主要存在于病灶的坏死区中。笔者通过高通量测序发现,Mycobacterium的相对丰度在坏死区最高,而在肉芽肿区和正常肺区中几乎检测不到,这与临床实际情况相符。Botero等[9]也对结核分枝杆菌存在的位置进行过研究,结果表明其只存在于痰中,而不存在于口咽。
笔者通过使用配对样品揭示了肺部常驻微生物组特征及肺结核患者肺部微生物组的变化。但依然存在一定的不足,首先本研究揭示了肺部微生物组在肺结核患者病灶区和正常肺中的分布特征,但并未对这些微生物的致病性做进一步研究。其次,本次研究样本量较小,可能会对结果造成一定偏倚,这就限制了坏死区Mycobacterium与其他微生物类群相关性的研究。在未来的研究中,应扩大样本量来探索肺结核患者病灶中微生物之间的相互作用关系,来明确Mycobacterium在感染过程中对正常肺部微生物组成的影响。
综上所述,笔者使用肺结核手术患者的FFPE配对样本,利用显微切割技术,直接真实地展示了肺结核患者肺部病灶区和正常区的微生物组分布特征和差异。本次研究发现,肺结核患者肺部微生物组成在坏死区、肉芽肿区和正常肺区中有一定的分布规律,而致病菌结核分枝杆菌主要存在于坏死区中。不同病变区域微生物组群落差异与肺结核疾病的发生和发展可能有一定的相关性。
