静脉注射Ghrelin联合不同剂量瑞舒伐他汀对动脉粥样硬化兔CTRP3和CTRP9的影响
2018-11-20李建权林海霞刘巨鹏乌云刘国栋李盼
李建权,林海霞,刘巨鹏,乌云,刘国栋,李盼
(1.内蒙古包头市包钢集团第三职工医院心血管内科,内蒙古 包头 014010;2.内蒙古包头市包钢集团第三职工医院急诊医学科,内蒙古 包头 014010;3.包头医学院,内蒙古 包头 014010)
动脉粥样硬化已经成为严重威胁人类健康的主要因素,并呈逐年增长趋势。建立动脉硬化动物模型,进行相关研究显得十分必要。近年研究表明,Ghrelin通过延缓动脉粥样硬化、改善急性心肌梗死预后、抑制心室重构及改善心功能等作用在冠心病的发生、发展及预后中发挥着积极的作用。补体C1q肿瘤坏死因子相关蛋白(C1q tumor necrosis factor related protein,CTRP)家族因子CTRP3、CTRP9也是近年来的研究热点,对延缓动脉粥样硬化及心血管系统的保护有明显意义。本研究在兔动脉粥样硬化模型的基础上给予Ghrelin联合不同剂量瑞舒伐他汀治疗,观察动脉硬化相关指标的变化,具有临床指导意义。
1 资料与方法
1.1 观察对象 20只健康家兔来自内蒙古农业大学动物实验中心,二月龄,雄性,体质量(1.26±0.31)kg。
1.2 材料与设备 高脂饲料:胆固醇1%+蛋黄5%+猪油5%+普通饲料89%,140 g/d,12周;瑞舒伐他汀(美国阿斯利康制药有限公司生产,批号:H20160116),Ghrelin(美国Biovision公司),CTRP3、CTRP9检测试剂盒[武汉奥美生物工程有限公司(人源性)]采用ELisa法测定(双抗夹心酶联免疫吸附测定);彩色多普勒:Pillip Q7,采用13 MHz高频线阵探头。
1.3 实验方法
1.3.1 造模实验[1]20只兔,给予高脂饮食12周,在其前后分别行指标测定。
1.3.2 分组及治疗 兔动脉粥样硬化动物模型造模[1]成功后,随机分为3组,开始治疗实验,治疗期间恢复正常饲料,自由摄食水;20只随机分组,方案如下。

表1 实验分组与治疗方案
1.3.3 指标测定 在造模前后及治疗前后分别进行如下指标测定[1]:①超声测定实验兔颈总动脉血流阻力指数(RI)及血流搏动指数(PI);②血液生化指标:TC、HDL-C、LDL-C、Hcy、CTRP3、CTRP9。
1.4 统计学方法 采用SPSS 16.0统计软件,数据采用“x±s”表示,组间比较采用t检验。以P<0.05为差异具有统计学意义。
2 结果
2.1 造模前后测定指标 造模前后指标比较,除了CTRP9外,生化指标TC、HDL-C/LDL-C、Hcy、CTRP3以及RI、PI均有统计学意义,见表2。

表2 造模前后指标测定结果
2.2 治疗前后测定指标 其中,ASL与ASH两组治疗前各项指标分别与ASC组治疗前比较差异无统计学意义,具有可比性;经过4周的不同剂量瑞舒伐他汀联合Ghrelin治疗观察,具体结果,见表3。注:每一组内治疗前后比较:aP<0.05,aaP<0.05;每一组治疗后与ASC组治疗后比较:bP<0.05
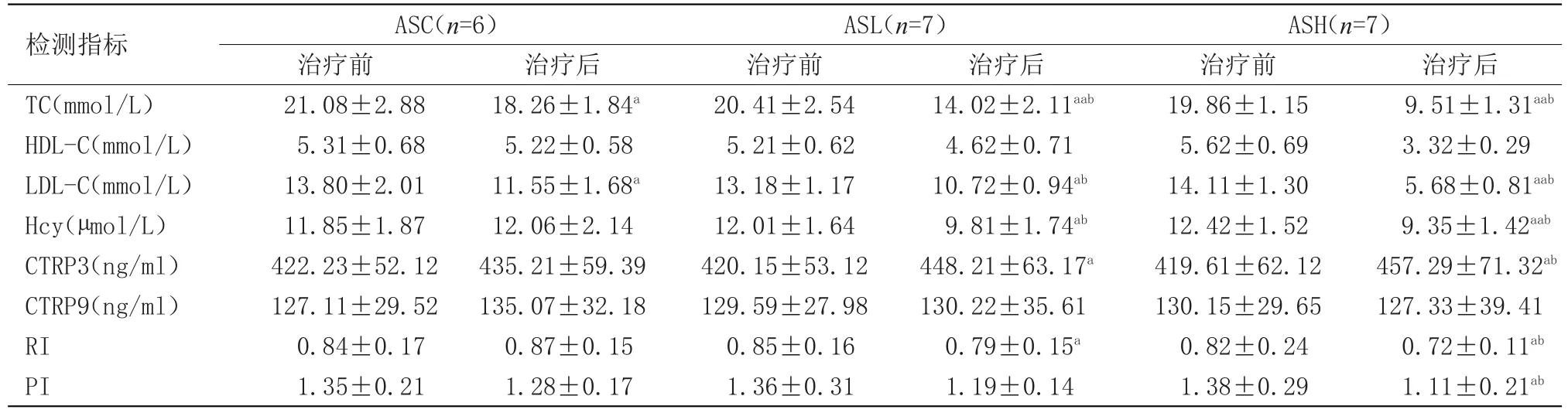
表3 各组治疗前后指标测定结果
3 讨论
本课题首先建立了兔动脉粥样硬化模型[1],经过12周的高脂饮食喂养,通过对血脂指标检测及应用彩色多普勒检测指标--血流阻力指数和搏动指数检测血管功能,结果显示,本研究应用的造模方法可以形成满意的兔动脉粥样硬化的动物模型。
补体C1q肿瘤坏死因子相关蛋白(CTRP),是由与脂联素结构类似的一组蛋白组成[2]。近年来对其家族成员CTRP3和CTRP9的生物学作用成为研究热点。CTRP3可引起血管明显舒张。Akiyama等[3]发现,CTRP3对内皮细胞具有促增殖、迁移作用,促增殖作用能被丝裂原活化蛋白激酶激酶1(MEK1/2)抑制剂和p38 MAPK抑制剂抑制,而促迁移作用仅能被ERK1/2抑制剂阻断,表明该信号通路在CTRP3促内皮细胞增殖和迁移中起着重要作用。研究发现,外周血中CTRP3水平与多种心脏代谢指标,如:TG、HDL-C、GFRH、Hs-CRP和主动脉脉搏波传导速度具有相关性[4]。此外,单核细胞分泌的CTRP3可抑制MCP-1分泌,同时增加脂联素分泌[5]。上述研究表明了CTRP3对于炎症反应具有抑制效应,在动脉粥样硬化中可能具有保护性作用。研究发现,CTRP9与新生血管内膜形成密切有关。在股动脉内膜剥脱的小鼠模型中,CTRP9显著抑制了新生内膜厚度和平滑肌细胞增殖[6]。CTRP9通过激活环磷酸腺苷(cAMP)-激酶A(PKA)通路来阻断PDGF-BB诱导的细胞外调节蛋白激酶(ERK)激活及细胞增殖和迁移。同时,CTRP9具有明显的舒张血管作用,其作用依赖于内皮细胞释放NO,通过AMPK/Akt/eNOS/NO释放增加是其发挥舒血管作用的重要分子机制[7-8]。本研究应用瑞舒伐他汀联合Ghrelin做为治疗方案,CTRP3具有显著性差异,而CTRP9无明显变化,也提示了干预行为及药物机理与二个因子的生物学作用密切相关。
Ghrelin[9]发现于1999年,是从大鼠胃黏膜中分离出来的具有促生长激素释放作用的小分子多肽,在人类动脉、静脉、血管平滑肌细胞及心肌细胞都有表达[10-11];Iantorno等[12]研究发现,Ghrelin可通过磷脂酰肌醇3-激酶(PI3K)通路,激活内皮细胞NO合酶,促进内皮细胞NO合成,以舒张血管保护血管内皮细胞。另外,Ghrelin也能通过降低活性氧(ROS)的产生和激活PI3K/Akt信号途径抑制高糖诱导的血管内皮细胞ECV-304凋亡[13],可抑制同型半胱氨酸诱导的心脏微血管内皮细胞功能障碍[14]。Ghrelin可抑制巨噬细胞对血浆LDL-C的吞噬,减少泡沫细胞的产生,从而减少脂质斑块形成[15]。研究表明Ghrelin可能通过上调HDL-C/LDLC比值,抑制泡沫细胞的形成[16]。Ghrelin可与其靶受体GSHR结合抑制多种炎症因子的释放,延缓动脉粥样硬化的进展[17]。他汀类药物具有改善内皮细胞功能、稳定斑块,抑制泡沫细胞形成、抑制血管平滑肌细胞增殖,抗动脉粥样硬化、降低炎症反应和氧化应激等作用[18]。其中,瑞舒伐他汀是目前降LDL-C较强的他汀类药物,能有效降低低密度脂蛋白,降低胆固醇[19-20]。
我们经过对兔动脉粥样硬化模型给予Ghrelin联合瑞舒伐他汀治疗,在ASC组,对于兔的动脉粥样硬化模型,经过12周的正常饮食,TC和LDL-C均有下降,有显著性差异,说明家兔对于高脂血症的存在具有自我调控能力,但是HDL-C未见明显变化,可能有多方面的影响因素;将三个组的治疗后数据进行了组间比较,具有显著性差异,说明Ghrelin联合瑞舒伐他汀的应用确有疗效。
结果显示,RI及PI均有改善,其中高剂量组具有极显著差异;血脂指标也有显著改善,有助于动脉粥样硬化的延缓,有助于减轻斑块的形成;经过二种药物的治疗,CTRP3水平变化显著,可能与脂质代谢及动脉粥样硬化的进程有着更密切的关系;而CTRP9对于二种药物的治疗未显示出显著性差异,也许与其生物学特性相关,CTRP9与缺血心肌及新生血管有更密切的关系[6],不除外剂量及疗程的不足,有待进一步研究。本研究同时观察了Hcy的变化,随着动脉粥样硬化模型的形成,Hcy显著升高,治疗实验中并未给予叶酸治疗,但其也有降低趋势,说明Hcy与代谢综合征的发生发展有着密切的内在的联系。我们未能观察Ghrelin和瑞舒伐他汀单独治疗的作用及结果,有待于进一步的研究。
本研究通过应用Ghrelin和不同剂量瑞舒伐他汀对动脉粥样硬化兔的治疗,检测血清中CTRP3、CTRP9的表达变化及血管功能的改善,阐明静脉注射Ghrelin和不同剂量瑞舒伐他汀联合使用对兔动脉粥样硬化的影响,对动脉粥样硬化的治疗提供重要的理论依据,具有临床指导意义。
