IGFBP-4在灯盏花素抑制肺癌A549细胞增殖中的作用
2018-11-20孙蕾李伟文黎媛蓝秀吕祝庆
孙蕾,李伟文,黎媛,蓝秀,吕祝庆
(浙江大学丽水医院 温州医科大学附属第五医院 丽水市中心医院 呼吸科,浙江 丽水 323000)
肺癌是高发病率和病死率的恶性肿瘤,在我国肺癌发病率高达54/10万,病死率达46/10万[1-2]。尽管放化疗、靶向药物治疗、免疫治疗等治疗延长了部分患者的生存时间,但极大部分患者仍难以获得满意的临床效果。研究证实从中药提取的单体及其衍生物具有显著的抗肿瘤作用[3-4]。灯盏花素(breviscapine,BVP)是灯盏花主要提取成分,具有抗炎、抗氧化、抗血小板聚集、改善循环和神经保护等作用。研究证实BVP具有显著的抗肿瘤作用,包括肝癌、结直肠癌、胃癌、前列腺癌等多种恶性肿瘤[5-6]。也有研究证实BVP具有抗肺癌的作用[7],但其机制仍未完全明确。本研究将通过多种方法探索BVP对肺癌A549细胞增殖的影响,并初步研究其可能的分子机制,为临床应用BVP治疗肺癌提供科学根据。
1 材料和方法
1.1 材料 肺癌A549细胞购买于上海生命科学细胞库。BVP购自上海融禾医药科技发展有限公司(纯度≥98%),MTT、DMSO、台盼蓝购自美国Sigma公司,β-肌动蛋白、Bcl-2、Bax单克隆抗体购自美国Cell Signal Technology公司;胰岛素样生长因子结合蛋白4(Insulin-like growth factor binding protein-4,IGFBP-4)抗体购自德国R&D Systems公司,IGFBP-4 ELISA试剂盒购自上海信裕生物科技有限公司,Adv-IGFBP-4-OETMDNA、EGFP和Adv-KDTMEasy RNAi EGFP腺病毒购自上海吉凯基因化学技术有限公司,qRT-PCR相关试剂盒购自大连宝生物工程有限公司。
1.2 方法
1.2.1 肺癌A549细胞培养:使用含体积分数10%胎牛血清的DMEM培养基(含100 U/mL青霉素,100 μg/mL链霉素)培养,将A549细胞接种于培养皿后,置入37 ℃、5% CO2、饱和湿度的细胞培养箱中培养。
1.2.2 MTT法检测细胞生长存活率:调整A549细胞密度为2×104/mL,接种于96孔培养板,每孔200 μL,过夜,加药后,置于培养箱中继续培养48 h。加入20 μL MTT,37 ℃温箱孵育2 h后,用DMSO 120 μL终止反应。以调零孔吸光度(A)值调零校准,酶标仪在492 nm波长处检测A值。细胞存活率(%)=(各浓度组A值/对照组A值)×100%。
1.2.3 台盼蓝染色:1×106个A549细胞接种于6孔板,0、25、50和100 μmol/L BVP处理48 h,收集细胞,加入1 mL PBS洗涤3次,细胞悬液与0.4%台盼蓝溶液以9∶1混合均匀(终浓度0.04%),3 min内镜像观察死细胞和活细胞情况。统计死细胞率(%)=死细胞总数/(活细胞总数+死细胞总数)×100%。
1.2.4 细胞凋亡检测:用1×106个A549细胞接种于6孔板,经0、25、50和100 μmol/L BVP处理48 h后,收集细胞,加入1 mL PBS洗涤3次,再加入500 μL Binding buffer,并依次加入5 μL Annexin V-FITC、5 μL PI,室温下避光孵育15 min,用流式细胞仪检测。
1.2.5 Western blot检测:1×106个A549细胞接种于6孔板,加药48 h后,PBS漂洗2次后,加入细胞裂解液冰上裂解15 min,12 000 r/min离心15 min,吸取上清。经BCA法定量后,取20 μg总蛋白4%~12%聚丙烯酰胺梯度凝胶电泳分离,电转至PVDF膜上,3%脱脂牛奶室温封闭1 h。加入一抗4 ℃孵育过夜,随后PBST缓冲液洗PVDF膜3次,每次8 min,加入HRP标记的二抗室温孵育1~2 h,再用PBST缓冲液洗PVDF膜3次,每次8 min,ECL试剂发光、显影和定影,并用Image J软件进行分析。
1.2.6 ELISA检测:1×106个A549细胞接种于6孔板,过夜,加入0、25、50、100 μmol/L BVP加药处理48 h,用无菌管收集细胞培养基上清,经离心20 min(2 000~3 000 r/min),仔细收集上清,按照ELISA试剂盒说明书步骤操作后,设置酶标仪波长为450 nm,并依序测量各孔的吸光度(A)。IGFBP-4相对比值=(实验组平均A值/对照组平均A值)。
1.2.7 RT-qPCR检测:加药处理48 h后,采用TRIZOL法抽提组织总RNA,并按照说明书步骤合成cDNA,接着进行荧光定量PCR,反应体系为25 μL,使用GAPDH作为内参照,引物系列如下:IGFBP-4:上游5’-GGGTGTTCTCTTTGGTGTTA-3’,下游5’-TGTTTTTAGGT GGCTGGATG-3’;GAPDH:上游5’-CTCCTCCTGTTCGACA GTCAGC-3’;下游5’-CCCAATACGACCAAATCCGTT-3’;采用ΔΔCt法分析IGFBP-4 mRNA的表达量。
1.2.8 IGFBP-4腺病毒感染:按照说明书,用5×103个A549细胞接种于96孔培养板,每孔体积为100 μL。融合率为40%~50%时进行病毒感染。取10 μL腺病毒原液稀释到10-7,未加入病毒的细胞孔中加入同样量的完全培养基作为对照组,置于培养箱继续培养,8~12 h以后观察细胞状态。在感染后12、24、48 h观察细胞中荧光表达情况,并获取高表达或者低表达IGFBP-4的A549细胞,并用Western blot进行验证。
1.3 统计学处理方法 采用SPSS22.0软件进行处理,计量资料以表示,采用单因素方差分析进行显著性检验。P<0.05为差异有统计学意义。
2 结果
2.1 BVP抑制A549细胞存活 与对照组相比,经终浓度为25、50和100 μmol/L BVP处理48 h后,MTT结果显示A549细胞存活率显著降低,台盼蓝染色示A549细胞死亡比例显著提高,差异具有统计学意义(P<0.05)。见图1。
2.2 BVP诱导A549细胞凋亡 流式细胞仪分析结果显示,与对照组比,25、50和100 μmol/L的BVP处理48 h后,A549细胞的凋亡率均明显增加,Western blot分析结果显示Bcl-2蛋白相对表达量降低,而Bax蛋白相对表达量增加,差异均有统计学意义(P<0.05)。见图2。
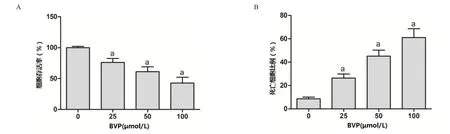
图1 BVP抑制A549细胞存活

图2 BVP对A549细胞凋亡的影响
2.3 BVP促进A549细胞IGFBP-4表达 Western blot和RT-qPCR检测结果显示,与对照组相比,25、50、100 μmol/L BVP处理48 h后,A549细胞IGFBP-4蛋白和mRNA表达量升高,ELISA结果显示培养基中IGFBP-4的含量显著增高,差异均有统计学意义(P<0.05)。见图3。
2.4 IGFBP-4高表达对BVP诱导A549细胞增殖抑制的影响 NC-OE(空载体)和IGFBP-4-OE(高表达)感染A549细胞后,与NC-OE细胞比,IGFBP-4-OE细胞存活率降低,Bax表达增加,Bcl-2表达降低,差异均有统计学意义(P<0.05);经100 μmol/L BVP处理48 h后,与NC-OE细胞相比,IGFBP-4-OE细胞存活率显著降低,Bax表达增加,Bcl-2表达降低,差异均有统计学意义(P<0.05);在IGFBP-4-OE细胞中,BVP处理后,细胞存活率减低,Bax表达增加,Bcl-2表达降低,差异均有统计学意义(P<0.05)。见图4。
2.5 IGFBP-4低表达对BVP诱导A549细胞增殖抑制的影响 NC-KD(空载体)和IGFBP-4-KD(低表达)感染A549细胞后,与NC-KD细胞相比,IGFBP-4-KD细胞存活率增加,Bax表达降低、Bcl-2表达增加,差异均有统计学意义(P<0.05);经100 μmol/L BVP处理48 h后,与NC-KD细胞相比,IGFBP-4-KD细胞存活率增加,Bax表达降低、Bcl-2表达增加,差异均有统计学意义(P<0.05);在IGFBP-4-KD细胞中,经BVP处理后,细胞存活率降低,增加Bax表达,Bcl-2表达降低,差异均有统计学意义(P<0.05)。见图5。
3 讨论
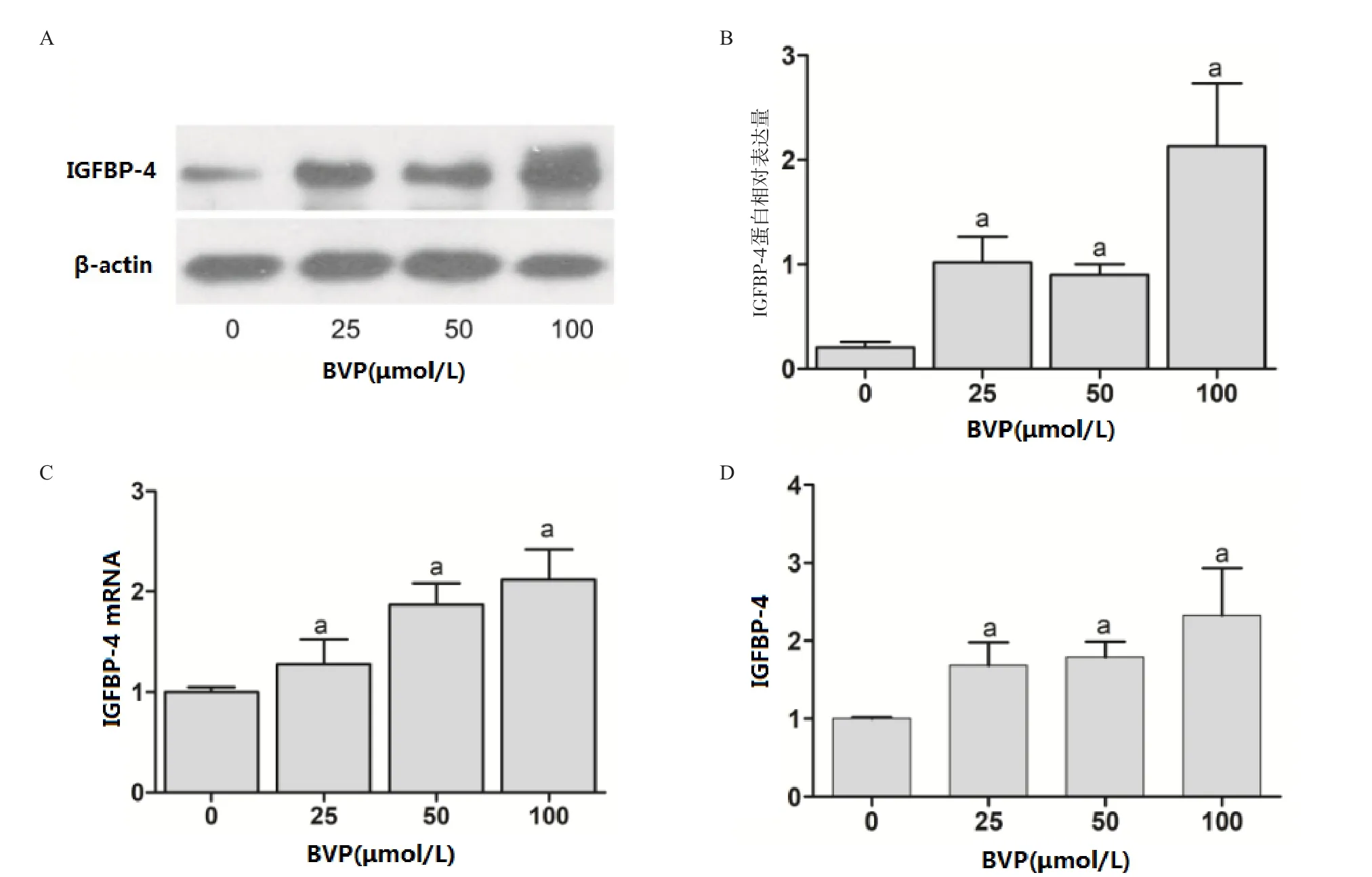
图3 BVP对A549细胞IGFBP-4表达的影响
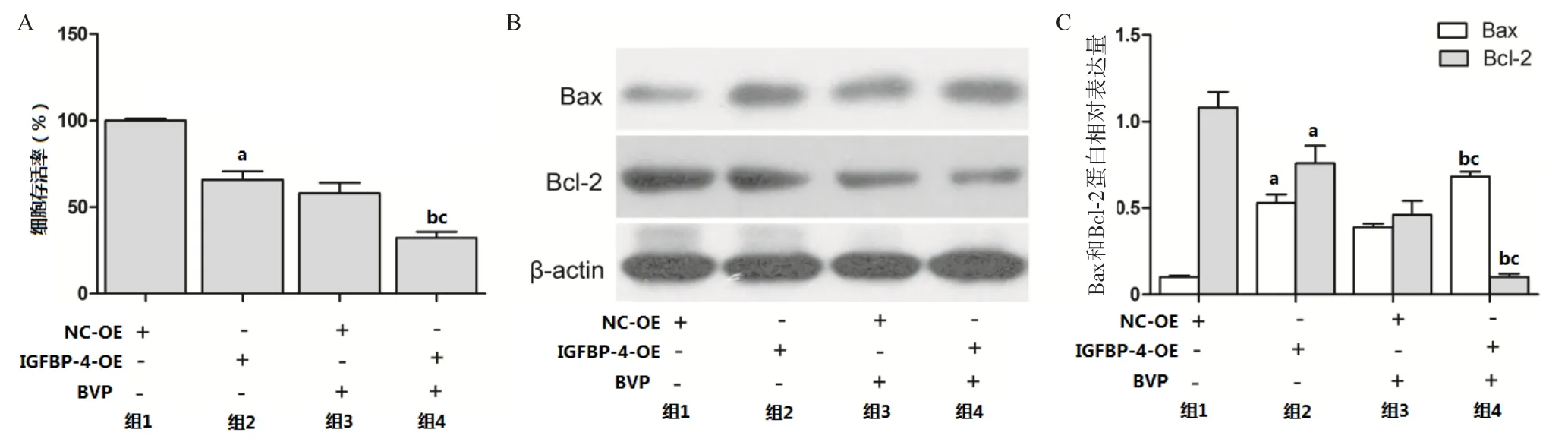
图4 IGFBP-4高表达对BVP诱导A549细胞增殖抑制的影响
BVP是一种从灯盏花提取的天然黄酮类混合物,其主要成分包括灯盏花甲素、灯盏花乙素及咖啡酰奎宁酸酯类。BVP具有抗肿瘤作用,WU等[5]研究发现BVP通过上调Cyt C、Caspase3、Bax,下调抗凋亡蛋白Bcl-2抑制肝癌细胞增殖。KE等[8]研究发现BVP抑制STAT3/AKT通路降低肝癌细胞迁移、降低肿瘤侵袭能力。GUAN等[9]发现BVP能够诱发前列腺癌DNA损伤,促进细胞凋亡,抑制肿瘤生长。也有研究证实BVP能够通过上调miRNA-7抑制肺癌细胞增殖[7]。但BVP的抗肺癌作用及其抗癌机制的相关报道仍十分缺乏。本研究中,我们发现BVP能够显著降低肺癌A549细胞的增殖和细胞活性,促进细胞凋亡;分子水平上,BVP能够显著增加Bax表达,而降低Bcl-2的表达,说明BVP具有抗A549细胞增殖,诱导A549细胞凋亡的作用。
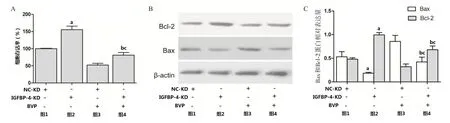
图5 IGFBP-4低表达对BVP诱导A549细胞增殖抑制的影响
IGFBP-4是由位于17q12-q21.1,长度约2 246 bp基因编码的237个氨基酸,广泛分布于全身多个器官,也可分泌到血液。IGFBP-4作为负性调控因子,与肿瘤生长呈负相关关系[10]。IGFBP-4能够增加肿瘤组织内细胞凋亡比例,抑制荷瘤形成[11]。然而,在肺癌组织中IGFBP-4呈低表达,被认为可能是肺癌细胞增殖、迁移的重要原因之一[12-13]。近年来有研究证实IGFBP-4抑制肺癌肿瘤微环境中A549细胞侵袭、迁移能力[14];但也有研究显示IGFBP-4与预后不良有关[12]。在本研究中,BVP能够增加IGFBP-4 mRNA和蛋白的表达,并增加IGFBP-4的分泌。IGFBP-4高表达能够降低A549细胞存活率,增加Bax、降低Bcl-2的表达,说明IGFBP4具有抑制A549细胞增殖的作用。与NC-OE细胞相比,BVP处理后,IGFBP-4高表达细胞的存活率显著下降,Bax表达增加、Bcl-2表达降低,说明IGFBP-4参与了BVP诱导A549细胞增殖抑制。与NC-KD细胞相比,IGFBP-4低表达细胞增殖活性增加,Bax表达减低、Bcl-2表达增加,说明敲低IGFBP-4有利于A549细胞增殖。经BVP处理后,空载体细胞存活率较IGFBP-4低表达细胞明显下降,说明敲低IGFBP-4抑制了BVP抗A549增殖作用。然而,在IGFBP-4低表达细胞中,经BVP处理后,细胞存活率仍降低,提示BVP可能还通过其他途径发挥抗A549细胞增殖作用。
综上所述,BVP具有抑制A549细胞增殖,诱导细胞凋亡的作用,其机制可能与BVP促进IGFBP-4表达增高有关。
