三七皂苷R1对胺碘酮诱导成纤维细胞氧化应激的干预作用
2018-11-20涂梦芸王志翊万新龙翁杰谢梦影郑晓群
涂梦芸,王志翊,万新龙,翁杰,谢梦影,郑晓群
(1.温州医科大学附属第二医院 检验科,浙江 温州 325027;2.温州医科大学 检验医学院 生命科学学院 检验医学教育部重点实验室,浙江 温州 325035;3.温州医科大学附属第二医院 全科医学科,浙江 温州 325027;4.温州医科大学 健康与环境生态研究所,浙江 温州 325035;5.温州医科大学附属第一医院 呼吸科,浙江 温州 325015)
胺碘酮是一种含碘苯丙呋喃衍生物,作为III类抗心律失常药物广泛应用于临床[1]。然而,胺碘酮的使用受到其不良反应的限制[2]。大多数不良反应都是小且可逆的,最严重的毒性是潜在致命的胺碘酮诱导的肺部毒性(amiodarone-induced pulmonary toxicity,AIPT)。这种不良反应通常与长期使用胺碘酮相关,高达5%~13%的患者以剂量依赖的方式发生,并导致10%~23%的患者死亡[3]。AIPT的病因尚未完全了解,其可能的机制包括直接细胞损伤、磷脂沉积、氧化应激和炎症介质释放等[4]。目前,寻找有效的药物治疗AIPT、阻止胺碘酮对肺的毒性作用是国内外研究的热点。研究[5-6]表明,三七皂苷R1是中药三七的主要活性成分,具有活血化瘀、抗氧化、抑制细胞内Ca2+内流等作用,但其是否具有对抗胺碘酮致细胞氧化应激的作用尚未见报道。本研究采用胺碘酮在体外建立人胚肺成纤维细胞(human embryonic lung fibroblast,HELFs)氧化应激损伤模型,探讨不同浓度的三七皂苷R1对该氧化应激损伤的保护作用。
1 材料和方法
1.1 材料
1.1.1 药物与试剂:胺碘酮购自法国赛诺菲-圣德拉堡民生制药有限公司。三七皂苷R1购自北京索莱宝生物科技有限公司。HELFs购自中国科学院典型培养物保藏委员会昆明细胞库。胎牛血清、DMEM培养基购自美国Gibco公司;CCK8试剂盒购自日本同仁化学研究所;活性氧(reactive oxygen species,ROS)检测试剂盒购自上海碧云天生物技术研究所;超氧化物歧化酶(superoxide dismutase,SOD)、丙二醛(malondialdehyde,MDA)检测试剂盒均购自南京建成生物公司。
1.1.2 仪器:酶标仪、HEPA CO2恒温培养箱、1300 SERIES A2生物安全柜均购自美国Thermo Scientific公司。
1.2 方法
1.2.1 细胞培养与实验分组:使用含10% FBS、1%青链霉素混合液的DMEM培养基体外培养HELFs,置于37 ℃、5% CO2的恒温培养箱中培养,通过倒置光学显微镜每日观察HELFs状态并按时换液。2 d进行一次传代,取对数生长期细胞进行实验[7]。实验分组:对照组、胺碘酮组、三七皂苷R1干预组和三七皂苷R1对照组。对照组为单纯细胞培养;胺碘酮组为在对照组基础上加入6 μg/mL胺碘酮;三七皂苷R1干预组为在胺碘酮组基础上,分别加入三七皂苷R1(25、50、100 μg/mL)干预;三七皂苷R1对照组为在对照组基础上加入100 μg/mL三七皂苷R1。以上各组细胞培养24 h后,观察各组细胞形态、细胞增殖以及细胞内ROS、MDA和SOD水平的改变。
1.2.2 细胞形态观察与细胞增殖检测:采用倒置显微镜观察各组细胞形态变化,用CCK8法检测各组细胞增殖情况。HELFs以1×104/孔接种于96孔板,每组设6个平行孔。按照1.2.1分组方法进行分组,药物作用24 h后,吸去培养液,各孔加入无血清DMEM培养基100 μL和CCK8试剂10 μL,同时设置不含细胞的空白对照组,在避光条件下继续培养3~4 h,通过酶标仪于450 nm处测定各孔吸光度。
1.2.3 ROS含量检测:按照1∶1 000的比例用无血清DMEM培养液稀释DCFH-DA,使其终浓度为10 µmol/L。稀释好的探针DCFH-DA加入各组细胞中,37 ℃避光孵育20 min。用无血清DMEM培养液洗涤细胞3次,使用荧光显微镜拍摄荧光图片,并使用荧光酶标仪,在488 nm激发波长、525 nm发射波长下检测各组细胞内的荧光强度。
1.2.4 酶化学法测定SOD和MDA水平:细胞分组处理完毕后,胰酶消化并收集细胞,用冷PBS清洗细胞2次,将细胞悬浮于500 µL PBS中,超声波裂解细胞,4 000 r/min离心15 min,取上清液,BCA法测定蛋白浓度。按照试剂盒说明书检测SOD活性和MDA含量。
1.3 统计学处理方法 采用SPSS18.0统计软件进行统计学处理。计量资料用表示,多组间比较采用单因素方差分析。P<0.05为差异有统计学意义。
2 结果
2.1 各组细胞形态变化 对照组细胞呈较宽大的纺锤形,胺碘酮组细胞明显变细变长,呈扁平狭长的梭形,三七皂苷R1干预组及三七皂苷R1对照组细胞形态和对照组细胞形态相似,见图1。
2.2 各组细胞的增殖活性 与对照组相比,胺碘酮组OD值明显升高,差异有统计学意义(P<0.001)。与胺碘酮组相比,25、50、100 μg/mL三七皂苷R1干预组OD值下降,其中100 μg/mL三七皂苷R1干预组下降最明显,差异均有统计学意义(P<0.05)。三七皂苷R1对照组与对照组相比,OD值差异无统计学意义(P>0.05),见表1。
2.3 各组细胞的ROS水平 荧光显微镜结果示,胺碘酮组荧光强度明显增强;与胺碘酮组相比,25 μg/mL三七皂苷R1干预后荧光强度无明显改变,而50、100 μg/mL三七皂苷R1干预后ROS荧光强度明显下降,见图2。荧光酶标仪结果示,与对照组相比,胺碘酮组细胞内ROS荧光强度显著增加,差异具有统计学意义(P<0.01);50、100 μg/mL三七皂苷R1干预后可以使ROS荧光强度下降,差异具有统计学意义(P<0.05)。三七皂苷R1对照组与对照组相比,差异无统计学意义(P>0.05),见表2。

图1 光学显微镜下观察各组细胞形态学变化(×200)
表1 各组细胞增殖活性比较(每组n=3,

表1 各组细胞增殖活性比较(每组n=3,
与对照组比:aP<0.01;与胺碘酮组比:bP<0.05
组别 OD值对照组 0.77±0.10胺碘酮组 1.35±0.04a三七皂苷R1(25 μg/mL)干预组 1.03±0.04b三七皂苷R1(50 μg/mL)干预组 0.95±0.08b三七皂苷R1(100 μg/mL)干预组 0.85±0.08b三七皂苷R1对照组 0.79±0.05
2.4 各组细胞的MDA含量、SOD活性 与对照组相比,胺碘酮作用后HELFs中MDA含量显著升高,差异有统计学意义(P<0.01);SOD生成显著降低,差异有统计学意义(P<0.01)。与胺碘酮组相比,50、100 μg/mL三七皂苷R1干预后能显著调节过氧化物酶表达,其中MDA浓度降低,而SOD活性增加,差异具有统计学意义(P<0.05)。三七皂苷R1对照组与对照组相比,差异无统计学意义(P>0.05),见表3。
3 讨论
长期使用胺碘酮会导致一些不良反应的发生,其中AIPT可能发展成不可逆转的肺纤维化因而引起人们广泛关注[8-9]。动物研究表明,肺中氧化应激的增强是AIPT发展过程中的重要环节,且使用抗氧化剂可以减缓AIPT的进程[10]。三七总皂苷是中药三七的主要有效成分,而三七皂苷R1是三七总皂苷的主要活性单位。三七皂苷R1主要作用包括减轻炎症反应、抑制氧化应激和防治缺血再灌注损伤[11-12]。

图2 荧光显微镜下观察细胞ROS水平(×200)
表2 各组细胞ROS水平比较(每组n=3,
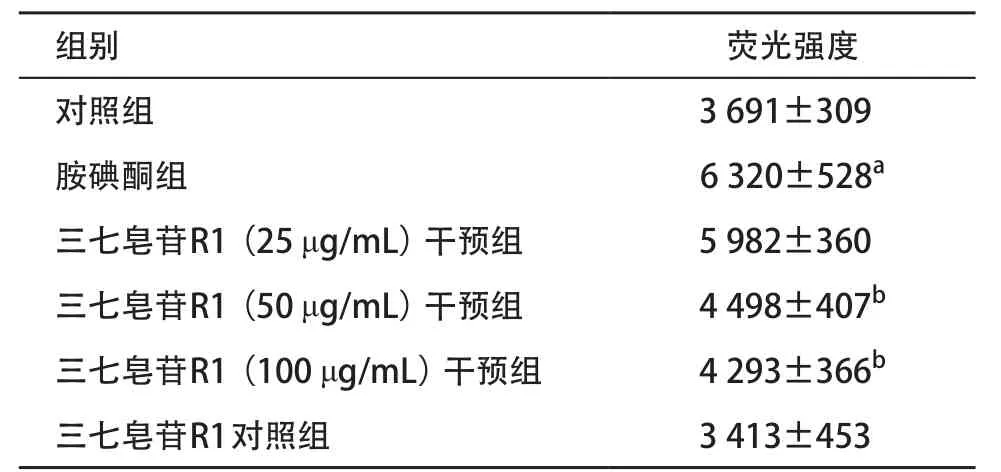
表2 各组细胞ROS水平比较(每组n=3,
与对照组比:aP<0.01;与胺碘酮组比:bP<0.05
组别 荧光强度对照组 3 691±309胺碘酮组 6 320±528a三七皂苷R1(25 μg/mL)干预组 5 982±360三七皂苷R1(50 μg/mL)干预组 4 498±407b三七皂苷R1(100 μg/mL)干预组 4 293±366b三七皂苷R1对照组 3 413±453
表3 各组细胞内SOD活性和MDA含量比较(每组n=3,

表3 各组细胞内SOD活性和MDA含量比较(每组n=3,
与对照组比:aP<0.01;与胺碘酮组比:bP<0.05
组别 SOD(U/mg prot)MDA(nmoL/mg prot)对照组 24.31±1.67 1.35±0.17胺碘酮组 13.51±1.26a 3.82±0.36a三七皂苷R1(25 μg/mL)干预组 16.94±0.91 3.00±0.27三七皂苷R1(50 μg/mL)干预组 19.93±1.11b 2.60±0.19b三七皂苷R1(100 μg/mL)干预组 21.76±1.47b 2.05±0.26b三七皂苷R1对照组 21.77±1.49 1.14±0.10
AIPT的主要病理学改变表现为早期弥漫性肺泡炎和后期成纤维细胞的病理性增殖[13]。本研究采用CCK8法测定细胞增殖活性,结果显示,胺碘酮作用后,HELF细胞增殖活性明显升高,表明胺碘酮能够促进HELF细胞增殖。而在三七皂苷R1干预后,HELF细胞的增殖活性显著降低,且具有浓度依赖性。三七皂苷R1对照组和对照组细胞的增殖活性不具有统计学差异,表明三七皂苷R1本身对HELFs的增殖活性没有影响。以上结果提示三七皂苷R1可能通过抑制HELFs的增殖从而延缓AIPT的进展。
氧化应激与肺纤维化的发病机制密切相关,在肺纤维化的形成和发展过程中发挥重要作用。研究发现抗氧化治疗能减轻肺纤维化的程度[14-15]。在正常生理状态下,细胞内ROS的产生和清除处于一种动态平衡状态。当产生的ROS超出抗氧化剂清除能力时,细胞内氧化还原状态趋向氧化,从而导致细胞功能发生障碍[16]。本研究结果表明胺碘酮作用后,细胞内ROS水平显著上升,而在50、100 μg/mL三七皂苷R1干预后,细胞内ROS水平下降。这表明三七皂苷R1一定程度上能够清除氧自由基,保护细胞免受氧化应激损伤。脂代谢异常可能参与肺纤维化疾病的发病过程[17]。有研究报道,胺碘酮作用于细胞后所产生的氧自由基能够攻击生物膜上的多不饱和脂肪酸,引发脂质过氧化,进而导致细胞损伤[18]。MDA是膜脂过氧化最重要的产物之一,其含量可以反映机体内脂质过氧化的程度和膜系统受损程度。SOD是一种含有金属元素的活性蛋白酶,能清除生物体在新陈代谢过程中产生的有害物质,其活性可间接反映机体清除氧自由基的能力。本研究结果表明,胺碘酮作用于HELFs后,匀浆液中SOD活性明显下降,而MDA含量明显升高,这提示胺碘酮能够引起HELFs氧化损伤。而三七皂苷R1干预后SOD活性升高,MDA含量降低,这提示三七皂苷R1干预后HELFs的抗氧化能力增强、脂质过氧化作用减弱,从而减轻胺碘酮诱导的HELFs损伤。
本研究结果显示,胺碘酮能够诱导HELFs增殖能力增强,并发生脂质过氧化,进而对细胞造成一定的损伤。抗氧化剂的应用可以减轻胺碘酮引起的HELFs氧化应激反应[19-20]。在本研究中,三七皂苷R1能明显减轻胺碘酮诱导的HELFs氧化损伤,调节细胞内过氧化物酶的表达,这为临床上治疗AIPT提供理论基础,而这一作用的具体分子机制尚需进一步研究。
