氩氦冷冻消融联合全身化疗治疗ⅢB/Ⅳ期肺鳞状细胞癌的疗效分析
2018-11-20刘长富于海鹏杨雪玲司同国
曹 非, 王 艳, 刘长富, 于海鹏, 杨雪玲, 司同国, 郭 志
肺癌是一种发病率高、预后较差的呼吸系统恶性肿瘤,5年存活率低于15%。最常见的病理类型是非小细胞肺癌(NSCLC),包括鳞状细胞癌、腺癌等,占80%~85%[1-2]。早期NSCLC缺乏典型的临床表现,70%患者确诊时已属晚期,丧失手术机会且预后较差[3]。 目前化疗是晚期肺鳞状细胞癌(lung squamous cell carcinoma,LSCC)的主要治疗手段,已被证实能够改善患者预后[4-5],但单纯全身化疗疗效有限,且多周期化疗后易出现化疗药物毒性累积导致患者不能耐受,甚至部分患者容易出现耐药反应进而病情进展。近年来随着氩氦冷冻消融技术在恶性肿瘤治疗方面应用越来越多,具有创伤小,恢复快,安全可靠等优点,在前列腺癌、原发性肝癌、肺癌、肝转移瘤等恶性肿瘤临床应用中取得不错疗效,能够改善患者生活质量,延长生存期[6-9]。但单一局部治疗远期疗效有限,局部联合全身治疗已成为恶性肿瘤治疗的必然趋势。本研究主要探讨冷冻消融联合全身化疗治疗晚期LSCC,是否可以通过短期内迅速降低肿瘤负荷,增强机体对化疗药物敏感性,延长化疗药物作用时间,提高疾病控制控制率,从而进一步改善患者预后,提高患者生活质量。
1 材料及方法
1.1 临床资料
选取2014年1月—2017年1月在我科就诊的77例晚期LSCC患者,按治疗方案不同分为对照组和联合治疗组。对照组43例,男37例,女6例,平均年龄(58±8)岁,肿瘤平均直径(4.49±0.95) cm,位于左肺上叶14例,右肺上叶9例,右肺下叶20例,TMN分期ⅢB期16例,Ⅳ期27例,KPS评分90分6例,80分26例,70分11例。联合治疗组34例,男28例,女 6 例,平均年龄(57±6)岁,肿瘤平均直径(4.45±1.19) cm, 位于左肺上叶 13 例,右肺上叶 5例,右肺下叶16例,TMN分期ⅢB期13例,Ⅳ期21例,KPS评分90分8例,80分20例,70分6例。所有患者均经肺穿刺病理确诊为LSCC,两组患者临床资料在性别、年龄、病灶大小、病灶部位、TMN分期、KPS 评分等之间差异无统计学意义(P>0.05)。见表1。

表1 77例晚期LSCC患者的一般资料
1.2 方法
1.2.1 治疗方案 对照组给与紫杉醇脂质体联合顺铂治疗,紫杉醇脂质体135 mg/m2加入5%葡萄糖注射液 500 mL,静脉滴入3 h,d1;顺铂 25 mg/m2加入0.9%NaCl溶液500 mL中,静脉滴入d1-3,21 d为一个化疗周期。联合治疗组先行肺肿瘤冷冻消融治疗,术后1周行全身静脉化疗,化疗方案与对照组相同。两组患者化疗期间给与止吐、护胃、保肝等对症支持治疗。
肺肿瘤冷冻消融治疗步骤:术前完善血常规、肝肾功能、血凝常规、心肺功能等检查,同时行胸部强化CT明确肿瘤大小、位置及与周围邻近结构关系,术前训练患者呼吸,充分交代病情及手术风险,签署手术志愿协议书。术中由CT扫描定位,选择合适的体位、穿刺部位,确定最佳进针角度及路径。常规消毒、铺无菌单,1%利多卡因局部麻醉后,以22 G细针按预定的穿刺角度及深度穿刺到拟冷冻靶区,后以22 G细针为参照,依据病灶形态、大小选择合适冷冻针穿刺到指定肿瘤区域进行冷冻消融治疗,治疗结束后再次行胸部CT平扫,观察有无气胸、出血等并发症出现,术后给与心电监护、止咳、补液等对症支持治疗。
1.2.2 疗效及安全性评价 对照组从开始全身化疗至2个周期化疗结束为评价周期,联合治疗组冷冻消融治疗后1周行全身静脉化疗开始至2个周期化疗结束为评价周期。评价依据包括影像学检查(胸部强化CT)及实验室检查(肺部肿瘤标志物,肝肾功能,血常规、血清电解质等),按照实体瘤mRECIST标准评价两组患者治疗后临床疗效,分为完全缓解(CR)、部分缓解(PR)、疾病稳定(SD)和疾病进展(PD),以(CR+PR)例数/计算疾病客观有效率(ORR),以(CR+PR+SD)例数/总例数计算疾病局部控制率(DCR)。药物不良反应评价根据美国国家癌症中心毒性分级标准分为0~Ⅳ度。
1.2.3 生活质量评价 根据KPS体力状况评分标准评价患者生活质量:①提高:KPS值增加超过10分;②稳定:KPS值波动幅度低于10分;③下降:KPS值下降超过10分。改善率=(提高+稳定)例数/总例数。
1.3 统计学分析
2 结果
2.1 疗效评价
对照组 CR 4例,PR 14例,SD 11例,PD 14例,客观有效率41.9%(18/43),疾病控制率67.4%(29/43); 联合治疗组CR 7例,PR 15例,SD 6例,PD 5 例,客观有效率64.7%(22/34),疾病控制率85.3%(28/34)。与对照组比较,联合治疗组在客观有效率及疾病控制率显著增高,差异有统计学意义(P<0.05)。见表2、图 1。
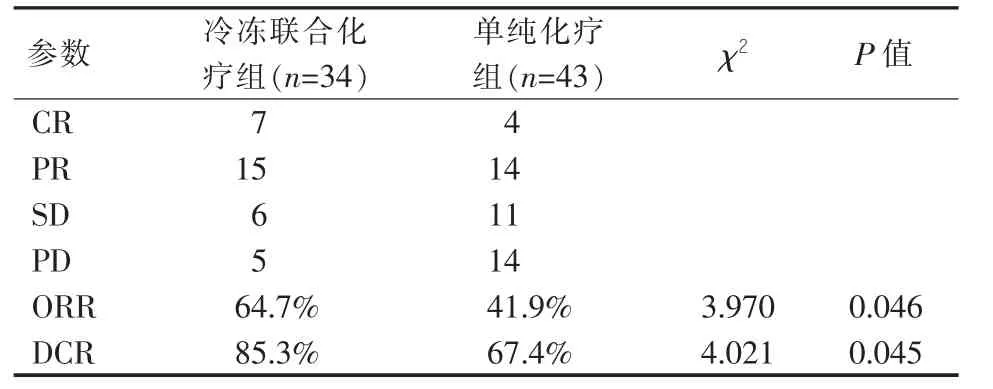
表2 两组患者临床疗效比较
图1 典型病例图像
2.2 预后评估
所有患者随访临床资料完整,平均随访时间16.5个月。对照组患者中位PFS 7个月(95%CI:6.07~7.92 个月),mOS 15 个月(95%CI:13.62~16.38 个月),联合治疗组患者 mPFS 10个月(95%CI:8.69~11.31 个月),中位 OS20 个月(95%CI:17.79~22.20个月),与对照组比较,联合治疗组在mPFS、mOS均显著延长,差异有统计学意义(P<0.05)。 见图2、3。
2.3 化疗不良反应
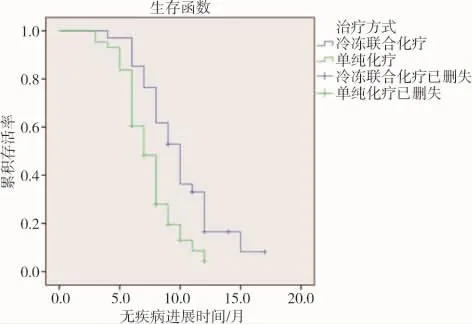
图2 两组患者治疗后无疾病进展时间(PFS)比较
对照组21例患者白细胞下降,15例中心粒细胞减少,17例血小板减少,32例出现恶心反应,23例患者现呕吐,29例患者有脱发;联合治疗组17例患者白细胞下降,12例中心粒细胞减少,13例血小板减少,25例出现恶心反应,20例患者现呕吐,21例患者有脱发。两组化疗后主要不良反应包括骨髓抑制,胃肠道反应,肝肾功能异常,脱发等,大多数患者不良反应多为Ⅰ、Ⅱ级,且多为一过性,少数患者反应较重,经给与对症支持治疗后得到缓解。两组患者总不良反应发生率之间差异无统计学意义(P<0.05)。 见表3。
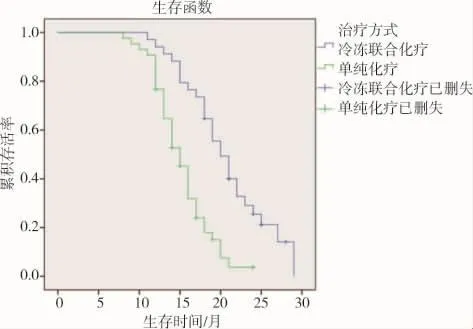
图3 两组患者治疗后总生存时间(OS)比较
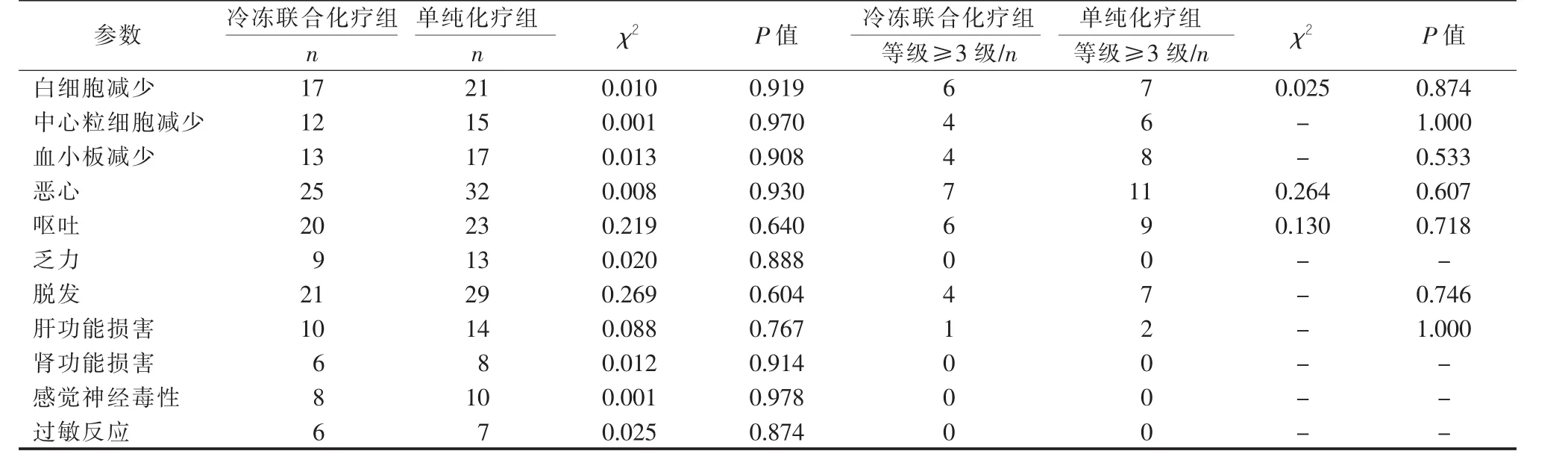
表3 两组治疗后不良反应比较
2.4 术后并发症
34例患者冷冻消融治疗后未出现肿瘤破裂出血,冷休克,肝肾功能衰竭,皮肤冻伤等严重并发症,术后不良反应相对较轻,10例患者术后1周内出现胸部冷冻区域疼痛、不适,评分2~3分,给与止痛处理后明显缓解。8例患者术后1个月内出现发热症状,多为低热,给与对症支持治疗好转。6例患者术后出现气胸,其中1例为迟发型气胸,5例患者气胸出气量较少,未作处理,1例患者气胸量较大,需行胸腔闭式引流治疗。5例患者术后出现咯血,量少,给与止血治疗后好转。3例患者术后出现刺激性胸膜反应,胸腔出现少量积液,无临床不适症状,未作处理。见表4。
2.5 生活质量评价
对照组患者生活质量提高7例,稳定22例,下降 14 例,改善率 67.4%(29/43);联合治疗组患者生活质量提高14例,稳定15例,下降5例,改善率85.3%(29/34)。两组比较,可见联合治疗组患者生活质量改善率明显提高,差异有统计学意义(P<0.05)。见表5。

表4 34例患者冷冻消融治疗术后1个月内并发症发生率
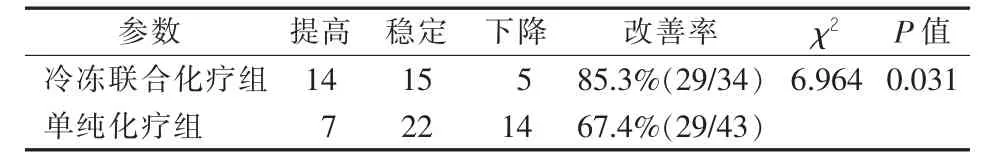
表5 两组患者生活质量情况比较
3 讨论
近年来,NSCLC发病率越来越高,大多数患者确诊时已属于晚期,无法手术切除[10]。铂类为主的一线系统化疗方案为晚期LSCC的主要治疗手段,但此类患者预后仍然较差,生存期短,中位生存时间只有 12~16 个月[1,11-12],且随着周期化疗次数的增加,化疗药物不良反应及耐药性问题越来越突出,部分患者因不能耐受化疗药物不良反应而终止治疗进而病情进展甚至死亡。是否可以通过与其它治疗方法的联合来提高疾病控制率,减轻化疗不良反应,提高生活质量和延长生存时间是晚期LSCC治疗的关键[13]。
氩氦冷冻消融作治疗为一种局部微创治疗手段,在肺癌治疗方面应用越来越多[14-16]。张云嵩等[17]报道冷冻消融治疗放化疗失败的晚期NSCLC能改善患者生活质量,延长生存期,提高DCR,其1年OS和 PFS分别为 81.8%和 27.8%。 Niu等[18]研究显示晚期肺癌行冷冻消融治疗与未行冷冻消融中位生存期分别为14个月和7个月,多次冷冻消融治疗较单次冷冻消融疗效更加显著;Chou等[19]研究表明针对于不可手术切除的肺癌患者,冷冻消融治疗优势明显,其1、2、3年总生存率分别为96%、88%和88%,1、2、3年疾病控制率分别为 75%、72%和72%;Gu等[20]研究发现冷冻消融联合吉非替尼治疗较单纯吉非替尼治疗晚期NSCLC能疗效显著,冷冻消融治疗能够延长靶向药物有效时间,加强药物疗效,联合应用能明显改善患者预后。本文的研究目的主要是探讨晚期LSCC联合治疗与单纯全身化疗临床疗效及预后比较,旨在为晚期肺癌患者提供更加有效治疗方法。
本研究结果显示,冷冻消融联合全身化疗治疗组ORR 64.7%,DCR 85.3%,单纯全身化疗治疗组ORR为41.9%,DCR为67.4%。联合治疗组在ORR和DCR均显著高于对照组,两组差异有统计学意义(P<0.05)。在疾病预后方面,冷冻消融联合全身化疗组mPFS为10个月,mOS为20个月,单纯全身化疗组mPFS和mOS分别为7个月、15个月,联合治疗组在mPFS和mOS均显著高于对照组,两组差异具有统计学意义。由此可见冷冻消融联合全身化疗较单纯全身化疗组疗效显著,可明显改善患者预后,延长生存期。分析原因可能为:①冷冻消融治疗可在短时间内迅速降低肿瘤负荷,减轻肿瘤张力,提高晚期LSCC患者ORR和DCR,进而有效控制肿瘤进展。②冷冻消融可使靶区肿瘤细胞大量坏死,肿瘤及周边组织通透性增加,从而使残余癌细胞对化疗药物敏感性增加。③冷冻消融能够导致肿瘤细胞大量坏死崩解,释放细胞内处于遮蔽状态的肿瘤相关抗原,解除机体免疫抑制状态,从而增强机体抗肿瘤的免疫力。④冷冻消融治疗与全身化疗具有协同作用,能够改变或延长化疗药物治疗的有效时间。
在本研究中,两组患者化疗后不良反应主要包括骨髓抑制、消化道反应、脱发等,大多数患者不良反应为Ⅰ、Ⅱ级,少数患者反应较重,但给与对症支持治疗后得到缓解。尽管两组患者化疗后不良反应发生率之间差异无统计学意义,但在随访观察中发现联合治疗组不良反应发生严重程度较轻,分析原因可能与冷冻消融治疗后患者免疫力得到增强,能够较好耐受药物不良反应有关。在生活质量改善情况方面,对照组生活质量改善率67.4%,联合治疗组改善率85.3%,两组比较差异有统计学意义。由此可见CT引导下晚期LSCC冷冻消融治疗并不加重化疗药物不良反应,其与全身化疗联合可减轻化疗引起不适症状,明显改善患者生活质量。
观察组34例患者冷冻消融术后未出现肿瘤破裂出血,呼吸衰竭、肝肾功能衰竭、冷休克等严重并发症,穿刺点疼痛、咳血、发热、气胸、胸膜反应等不良反应可见,大多数临床症状较轻,经给与对症处理后明显缓解。分析冷冻消融治疗并发症发生率较低的原因:①充分评估患者一般状况,选择合适的患者进行治疗。 ②术前完善实验室及影像学检查,排除高危因素,仔细研究讨论肿瘤影像学表现,制定最佳穿刺路径、穿刺角度,尽量避开血管、气管。③术前训练患者呼吸及与患者充分交流,缓解患者恐惧、紧张心理,从而能够较好配合地完成手术。④术后常规给与止咳、止血、护胃等支持治疗,密切观察病情变化,及时处理不适反应。
