MicroRNA-29b对肝纤维化及肝星状细胞增殖、凋亡的影响
2018-11-20
(河南大学淮河医院 感染科,河南 开封 475000)
肝纤维化并非一种独立疾病,而是伴发于多种慢性肝病的肝脏病变。近年来,我国肝纤维化发病率逐渐上升,若不及时治疗,肝内纤维组织大量增生,由肝纤维化发展到肝硬化,严重威胁患者的生命健康[1]。肝星状细胞(hepatic stellate cell, HSC)的激活在肝纤维化发展过程中发挥重要作用[2]。MicroRNA(miRNA)主要调控细胞的增殖、分化、凋亡。较多研究证实,miRNAs与HSC向成纤维细胞发展有关,其中miR-29b在多种肿瘤中表达下调,被认为是肿瘤抑制型miRNA[3-4]。关于miR-29b与肝纤维化的研究已有较多报道,但是HSC中miR-29b的研究较少[3-4]。本研究通过CCl4复制肝纤维化模型,旨在探究miR-29b在肝纤维化过程中的作用及其对HSC的影响。
1 材料与方法
1.1 实验动物
清洁级SD大鼠20只,8周龄,体重200 g,由上海医科大学动物实验中心提供,合格证号:SYXK(沪)2014-0004,所有动物在统一环境中饲养,温度25℃,湿度65%,严格按照动物饲养规则进行喂养。
肝星状细胞HSC-T6、LX-2购自北京医科大学肝病研究中心,来源于美国标准生物品收藏中心,保存于-80℃。
1.2 主要试剂与仪器
CCl4(美国RD公司)使用前加入中性菜籽油进行稀释,调整浓度为600 ml/L。兔抗大鼠转化生长因 子 -β1(tansforming growth factor-β1, TGF-β1)、SAMD3(sterile alpha motif domain containin protein 3)单克隆抗体一抗、辣根过氧化物酶(horse radish peroxidase, HRP)标记山羊抗兔二抗购自美国Santacruz公司,RNA提取试剂盒(北京生化科技有限公司),逆转录试剂盒(日本TaKaRa公司),BCA测定试剂盒(上海碧云天生物科技有限公司),LipofectamineTM2000转染试剂(美国Invitrogen公司,miR-29b siRNA正向引物:5'-TGCGCTAGCACCATT TGAAATC-3';反向引物:5'-CCAGTGCAGGGTCCG AGGTATT-3'),光学显微镜(上海光学仪器厂),实时荧光定量聚合酶链反应(quantitative real-time polymerase chain reaction, qRT-PCR)仪(美国BioRed公司)。
1.3 方法
1.3.1 动物模型的复制 将大鼠随机分为对照组和模型组,每组10只。模型组大鼠经腹部注射60%3 ml/kg CCl4,2次/周,对照组以同样方式注射等量生理盐水。在第0、6和12周,大鼠禁食12 h,腹腔注射50 mg/kg戊巴比妥钠进行麻醉,切开腹部皮肤,取出肝脏组织,留取一部分在4%多聚甲醛中固定,另一部分保存在-80℃冰箱备用。
1.3.2 苏木精-伊红染色(hematoxylin-eosin staining)大鼠肝组织行HE染色。常规制备石蜡切片浸入二甲苯固定30 min,在质量分数为100%、95%、85%和75%的乙醇溶液中分别脱水5 min,流水冲洗后,加入苏木精染色10 min,浸入1%盐酸后用蒸馏水冲洗。均加入伊红液染色3 min,依次在75%、85%、95%和100%乙醇溶液中脱水2 min,加入二甲苯透明处理,滴加中性树脂封片,放置于显微镜下观察,选取5个视野计算纤维化面积,无纤维化为0分,纤维化面积<25%为1分,25%~50%为2分,50%~75%为3分,>75%为4分。
1.3.3 实时荧光定量聚合酶链反应(quantitative realtime polymerase chain reaction, qRT-PCR) 采 用qRT-PCR检测肝组织中miR-29b、TGF-β1、SAMD3基因的表达。取出冷冻肝组织,用无菌剪刀将组织剪碎,采用RNA提取试剂盒提取肝脏总RNA,按照逆转录试剂盒说明书进行操作,将RNA逆转录为cDNA,qRT-PCR引物由广州Invitrogen公司合成,引物序列见表1。反应体系:10×cDNA模板1μl,正反向引物各 1μl,H2O 8μl,10μl 2×SYBR Mix。反应条件:95℃预变性2 min,95℃变性10 s,60℃退火30 s,72℃延伸2 min,共35个循环,72℃继续延伸10 min。在CFX manager 3.0软件上以GAPDH作为内参基因,采用2-ΔΔCt法行基因相对定量分析。

表1 qRT-PCR引物序列
1.3.4 Western blot检测 采用Western blot检测肝组织中TGF-β1、SAMD3的蛋白表达。将肝脏组织剪碎后加入蛋白裂解液,在冰上反应30 min,离心后收集上清液,采用BCA试剂盒测定蛋白浓度,制备8%分离胶、12.5%浓缩胶,蛋白上样量统一为30μg,电泳开始时电压设置为80 V,进入分离胶后,电压调整为120 V,电泳结束后转移蛋白凝胶至PVDF膜上,转膜反应在冰上进行,电压设置为100 V,转膜反应1 h,加入TBST溶液清洗后,加入5%脱脂牛奶,室温下封闭1 h,TBST溶液清洗PVDF膜,加入一抗稀释液(TGF-β1、SAMD3抗体),4℃震荡过夜,PBST清洗3次,加入二抗稀释液,室温下孵育2 h,PBST清洗。凝胶成像仪观察蛋白的表达。
1.3.5 miR-29b转染HSC-T6、LX-2细胞 采用含10% FBS的DMEM培养基,置于37℃、5%二氧化碳CO2培养箱中培养HSC-T6、LX-2细胞。细胞贴壁生长后,加入0.25%胰蛋白酶溶液消化,生长至80%时,加入DMEM培养基终止消化。将细胞随机分为空白对照组、miR-29b转染组、阴性转染组。miR-29b转染组、阴性转染组参照转染试剂盒分别转染miR-29b siRNA和无意义对照序列,置于37℃、5% CO2培养箱中培养48 h。
1.3.6 MTT法 采用MTT法检测HSC-T6、LX-2细胞的增殖。收集培养后的细胞制备单细胞悬浮液,调整细胞密度为5×104个/ml,置于37℃、5% CO2培养箱中分别培养12、24、48和72 h,加入10μl MTT孵育4 h,加入100μl DMSO溶液,在570 nm波长处测定吸光度值(OD值)。细胞抑制率=(OD实验组-OD空白对照组)/OD空白对照组×100%。
1.3.7 流式细胞术 采用流式细胞仪检测细胞周期和细胞凋亡的变化。收集培养后的细胞制备单细胞悬浮液,调整细胞密度为5×104个/ml,置于37℃、5%CO2培养箱中培养,当细胞生长至80%时,加入0.25%胰蛋白酶消化细胞,收集细胞后加入预冷PBS溶液洗涤,70%乙醇溶液中固定1 h,PBS清洗,加入PI染色重悬后置于流式细胞仪中检测细胞周期变化。在细胞悬浮液中加入Annexin V-APC,室温下黑暗中孵育15 min,用细胞流式仪检测细胞凋亡情况。
1.4 统计学方法
数据分析采用SPSS 21.0统计软件,计量资料以均数±标准差(±s)表示,比较用单因素方差分析或重复测量设计的方差分析,两两比较用SNK-q检验,P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠肝纤维化状况
HE染色结果显示,对照组大鼠肝脏组织细胞形态正常结构完整,呈四周放射样整齐排列;模型组大鼠肝组织出现纤维增生,结构遭到破坏,存在炎症细胞浸润,随着时间的延长肝纤维化程度逐渐加重。对照组第0周大鼠肝组织纤维化评分为(0.00±0.00)分,模型组第0、6和12周大鼠肝组织纤维化评分分别为(0.97±0.13)、(1.66±0.15)和(2.57±0.32)分,经方差分析,差异有统计学意义(F=4.032,P=0.000)。进一步两两比较经SNK-q检验,模型组第6周大鼠肝组织纤维化评分高于模型组第0周(P<0.05);模型组第12周大鼠肝组织纤维化评分高于模型组第6周(P<0.05)。见图 1、2。
2.2 各组大鼠肝组织中 miR-29b、TGF-β1、SAMD3表达水平
对照组、模型组大鼠不同时间miR-29b、TGF-β1、SAMD3相对表达量比较,经方差分析,差异有统计学意义(P<0.05)。见表2和图3、4。
2.3 miR-29b对HSC-T6、LX-2细胞增殖的影响
空白对照组、阴性转染组、miR-29b转染组12、24、48和72 h的HSC-T6细胞抑制率比较,采用重复测量设计的方差分析,结果:①不同时间点的细胞抑制率有差别(F=36.675,P=0.000);②3组细胞抑制率有差别(F=9.566,P=0.000);③3组细胞抑制率变化趋势有差别(F=48.755,P=0.000)。
空白对照组、阴性转染组、miR-29b转染组12、24、48和72 h的LX-2细胞抑制率比较,采用重复测量设计的方差分析,结果:①不同时间点的细胞抑制率有差别(F=35.258,P=0.000);②3组细胞抑制率有差别(F=5.810,P=0.000);③3组细胞抑制率变化趋势有差别(F=12.908,P=0.000)。见表3和图5。
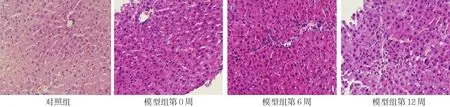
图1 各组大鼠肝组织 (HE×100)
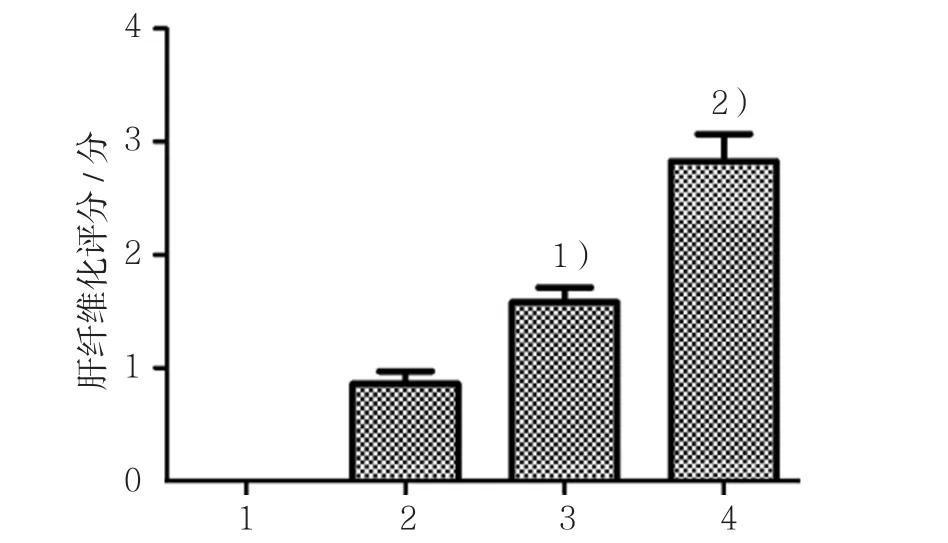
图2 各组大鼠肝组织纤维化评分比较 (n =10,±s)
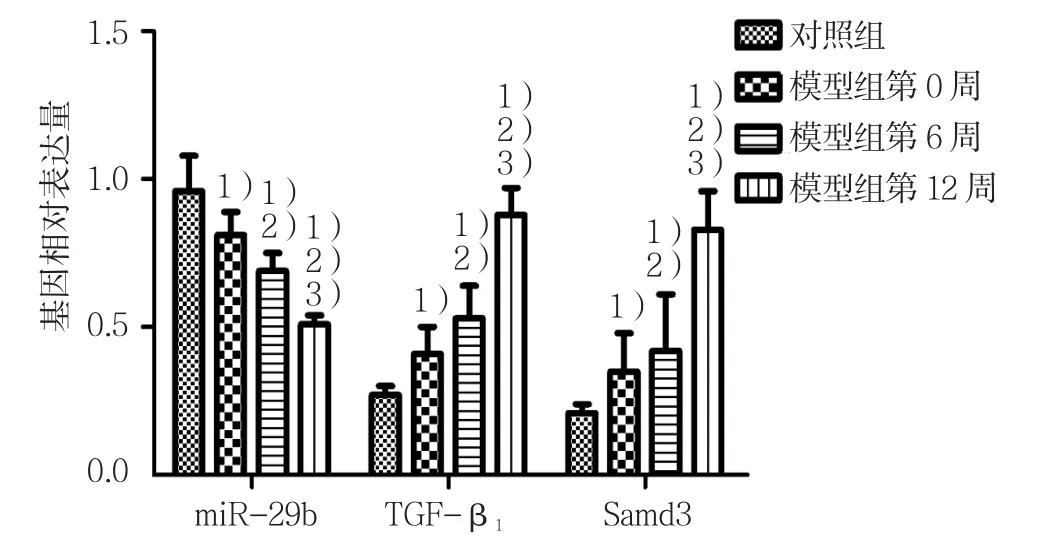
图3 各组大鼠肝组织中miR-29b、TGF-β1、SAMD3基因表达水平比较 (n =10,±s)
表2 各组大鼠肝组织中miR-29b、TGF-β1、SAMD3表达水平比较 (n =10,±s)

表2 各组大鼠肝组织中miR-29b、TGF-β1、SAMD3表达水平比较 (n =10,±s)
注:1)与对照组比较,P <0.05;2)与模型组第0周比较,P <0.05;3)与模型组第6周比较,P <0.05
SAMD3基因 蛋白 基因 蛋白对照组 0.98±0.10 0.26±0.04 0.29±0.03 0.23±0.03 0.36±0.06模型组第0周 0.78±0.151) 0.43±0.081) 0.41±0.061) 0.39±0.061) 0.43±0.051)模型组第 6周 0.67±0.141)2) 0.54±0.091)2) 0.78±0.111)2) 0.46±0.111)2) 0.72±0.091)2)模型组第 12 周 0.52±0.121)2)3) 0.82±0.061)2)3) 1.12±0.141)2)3) 0.76±0.141)2)3) 1.17±0.071)2)3)F值 11.417 58.591 79.247 27.559 143.552 P值 0.003 0.000 0.000 0.000 0.000 TGF-β1组别 miR-29b
2.4 miR-29b对HSC-T6、LX-2细 胞 周 期 的影响
空白对照组、阴性转染组、miR-29b转染组HSC-T6、LX-2细胞G1期比例比较,经单因素方差分析,差异有统计学意义(F=5.048和3.605,P=0.014和0.041)。进一步两两比较经SNK-q检验,HSC-T6、LX-2细胞miR-29b转染组G1期比例[(62.34±13.66)%和(56.83±8.28)%]均高于空白对照组[(49.73±7.56)%和(50.34±9.65)%]、阴性转染组[(48.23±10.64)%和(46.79±8.35)%]。见图6。
空白对照组、阴性转染组、miR-29b转染组HSC-T6、LX-2细胞S期比例比较,经单因素方差分析,差异有统计学意义(F=14.091和4.418,P=0.000和0.022)。进一步两两比较经SNK-q检验,HSC-T6、LX-2细胞S期比例[(25.37±6.24)%和(30.36±5.47)%]低于空白对照组[(38.51±6.64)%和(39.65±9.64)%]、阴性转染组 [(39.76±7.23)%和(36.74±5.52)%]。见图6。
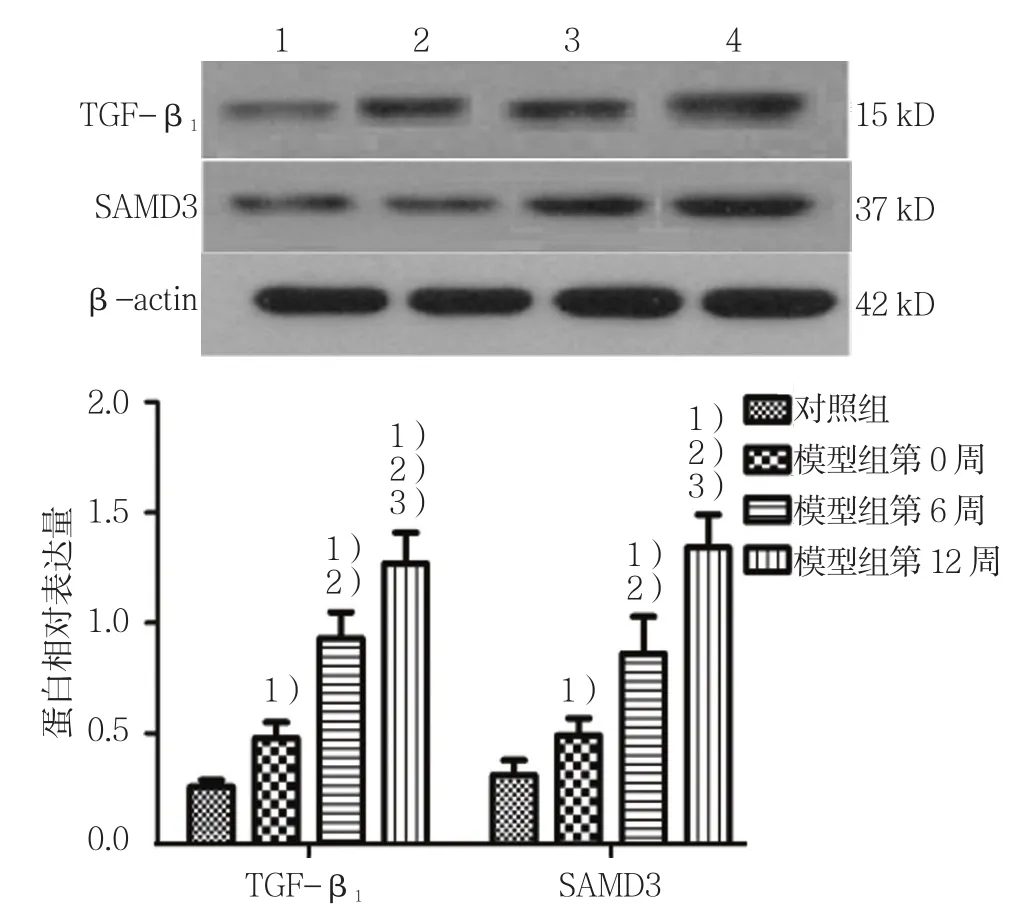
图4 各组大鼠肝组织中miR-29b、TGF-β1、SAMD3蛋白表达水平比较 (n =10,±s)
2.5 miR-29b对HSC-T6、细胞凋亡的影响
空白对照组、阴性转染组、miR-29b转染组HSC-T6、LX-2细胞凋亡率比较,经单因素方差分析,差异有统计学意义(F=100.553和97.438,均P=0.000)。进一步两两比较经SNK-q检验,miR-29b转染组HSC-T6、LX-2细胞凋亡率[(23.64±6.37)%和(20.13±5.26)%]高于空白对照组[(3.16±0.87)%和(3.83±0.76)%]、阴性转染组[(3.07±0.75)%和(2.98±0.72)%]。见图 7。
表3 转染后HSC-T6、LX-2细胞抑制率比较 (%,±s)

表3 转染后HSC-T6、LX-2细胞抑制率比较 (%,±s)
注:†与空白对照组、阴性对照组比较,P <0.05
LX-2 12 h 24 h 48 h 72 h 12 h 24 h 48 h 72 h空白对照组 6.13±0.87 6.26±0.79 6.14±0.88 6.28±0.71 5.38±0.62 5.64±0.34 5.49±0.51 5.52±0.46阴性转染组 7.41±0.92 6.83±0.89 6.25±1.02 6.48±0.84 5.83±0.76 5.65±0.77 5.76±0.68 5.74±0.79 miR-29b转染组 13.95±2.37† 24.44±3.85† 37.57±6.16† 28.17±8.15† 11.33±2.36† 21.16±4.49† 29.47±5.06† 18.69±3.18†HSC-T6组别
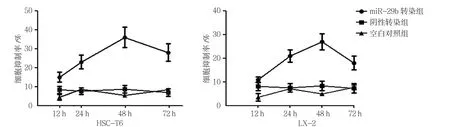
图5 HSC-T6、LX-2细胞抑制率比较 (±s)
2.6 miR-29b对HSC-T6、LX-2细胞中TGF-β1、SAMD3表达的影响
空白对照组、阴性转染组、miR-29b转染组HSC-T6细胞中TGF-β1、SAMD3蛋白相对表达量比较,经方差分析,差异有统计学意义(F=29.988和16.315,均P=0.0000)。空白对照组、阴性转染组、miR-29b转染组LX-2细胞中TGF-β1、SAMD3蛋白相对表达量比较,经方差分析,差异有统计学意义(F=44.951和50.643,均P=0.000)。见表4和图8。

图6 HSC-T6、LX-2细胞周期

图7 miR-29b对HSC-T6、LX-2细胞凋亡的影响
表4 HSC-T6、LX-2细胞中TGF-β1、SAMD3蛋白表达水平比较 (±s)
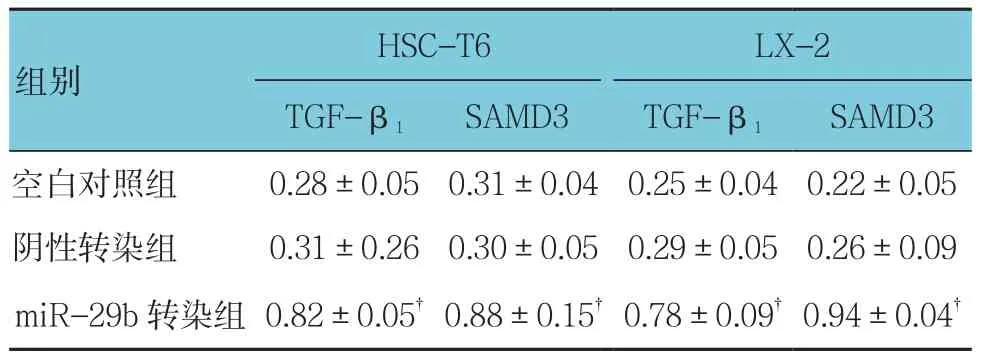
表4 HSC-T6、LX-2细胞中TGF-β1、SAMD3蛋白表达水平比较 (±s)
注:†与空白对照组、阴性对照组比较,P <0.05
组别HSC-T6 LX-2 TGF-β1 SAMD3 TGF-β1 SAMD3空白对照组 0.28±0.05 0.31±0.04 0.25±0.04 0.22±0.05阴性转染组 0.31±0.26 0.30±0.05 0.29±0.05 0.26±0.09 miR-29b转染组 0.82±0.05† 0.88±0.15† 0.78±0.09† 0.94±0.04†
空白对照组、阴性转染组、miR-29b转染组HSC-T6细 胞 中miR-29b、TGF-β1、SAMD3基 因相对表达量比较,经方差分析,差异有统计学意义(F=10.784、21.085和24.096,均P=0.000)。空白对照组、阴性转染组、miR-29b转染组LX-2细胞中miR-29b、TGF-β1、SAMD3基因相对表达量的比较,经方差分析,差异有统计学意义(F=37.022,30.513和36.648,均P=0.000)。见表5和见图9。
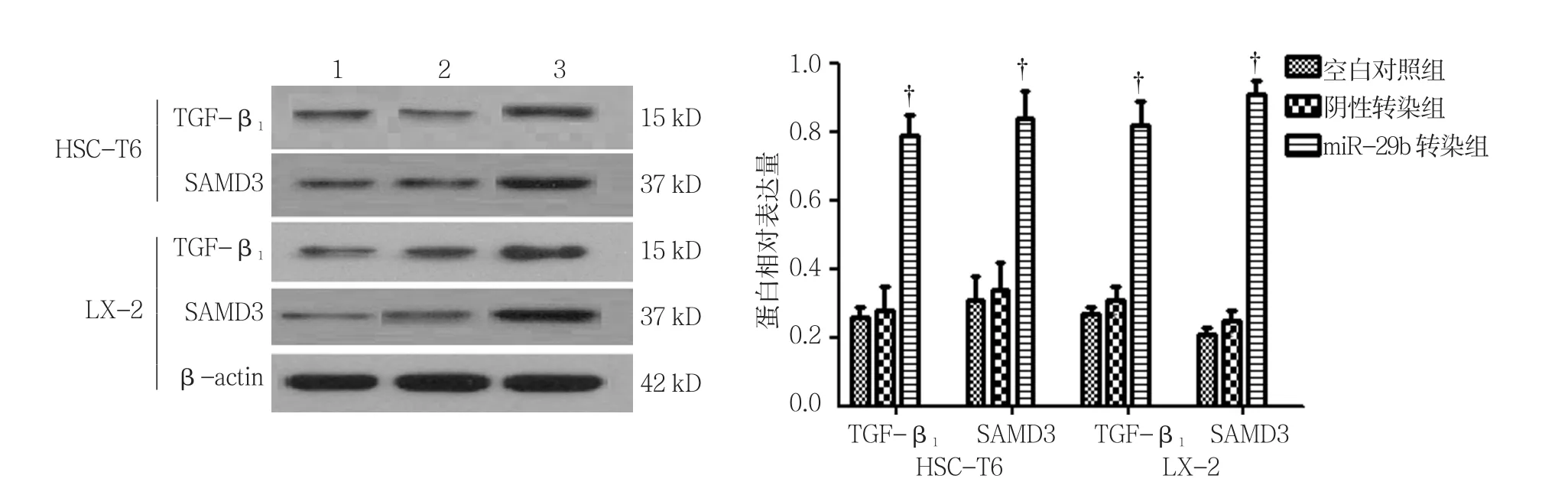
图8 HSC-T6、LX-2细胞中TGF-β1、SAMD3蛋白表达水平比较 (±s)
表5 HSC-T6、LX-2细胞中miR-29b、TGF-β1、SAMD3基因表达水平比较 (±s)

表5 HSC-T6、LX-2细胞中miR-29b、TGF-β1、SAMD3基因表达水平比较 (±s)
注:†与空白对照组、阴性对照组比较,P <0.05
LX-2 miR-29b TGF-β1 SAMD3 miR-29b TGF-β1 SAMD3空白对照组 0.82±0.05 0.36±0.04 0.29±0.04 0.86±0.65 0.33±0.04 0.23±0.05阴性转染组 0.80±0.09 0.738±0.05 0.31±0.05 0.79±0.87 0.34±0.05 0.26±0.09 miR-29b转染组 0.42±0.05† 0.80±0.03† 0.79±0.15† 0.35±5.37† 0.78±0.09† 0.75±0.04†HSC-T6组别

图9 HSC-T6、LX-2细胞中miR-29b、TGF-β1、SAMD3基因表达水平比较 (±s)
3 讨论
肝纤维化主要由不同因子共同作用下破坏肝细胞外基质降解、分泌的平衡状态,导致细胞外基质逐渐沉积于肝细胞间造成肝脏损伤。引起肝纤化的因素较多,一般能够引起慢性肝病的因素均能导致肝纤化。研究显示,其病因主要包括感染性、代谢缺陷、化学毒性、免疫性肝病等方面[5]。近年来肝纤维化研究取得了较好的成果,较多临床研究证实肝硬化能够逆转,其中HSC在逆转过程中发挥重要作用,并且miRNA-29b也参与其中[6]。最新研究证实,在肝硬化恢复阶段激活后的HSC主要通过凋亡机制进行调节[7]。因此,了解肝纤维化的形成机制、HSC凋亡机制,以及与miRNA-29b的关系对肝纤维化临床治疗具有一定的参考意义。
miRNA属于内源非编码单恋分子,通过与靶基因mRNA上3’配对结合抑制mRNA的转录。最近研究发现,miRNA与肿瘤的发生、发展密切相关,参与肿瘤增殖、周期改变及迁移侵袭[8]。miR-29b基因属于microRNA一员,在胚胎组织中几乎不表达,在成熟组织细胞中广泛表达。较多研究显示,miR-29b在肺癌、卵巢癌等肿瘤组织中表达下调[9]。临床研究显示,与正常人相比,肝病患者血清miR-29b水平降低,且降低程度与病情严重程度呈正相关,表明miR-29b参与肝纤维化病程的发展[10]。体外研究显示,上调miR-29b能够促进胶原纤维生成,使星状细胞发生活化,加速胞外基质的生成[11]。国内外研究证实,TGF-β1/SAMDs通路参与肝纤维活化形成过程,TGF-β1与细胞膜受体结合后发生磷酸化,通过SAMD3等信号分子进入细胞核中,与转录因子结合进行基因调控[12-13]。动物研究发现,TGF-β1刺激HSC后miR-29b过表达,SAMD3受抑制表达量下降,说明miR-29b可能位于TGF-β1/SAMDs通路上游[14]。本研究为证实miR-29b在肝纤维化中的作用,通过HE染色发现肝组织随着模型复制时间的延长,纤维化比例逐渐升高,表明模型复制成功,大鼠肝脏组织逐渐形成纤维化,且组织病变特征符合肝纤维化病理特征。本研究结果显示在纤维化形成过程中,miR-29b基因表达水平逐渐降低,TGF-β1、SAMD3表达水平逐渐升高,推测抑制miR-29b的表达能够增强TGF-β1/SAMDs信号通路,进而促进肝纤维化,与国内学者研究结果相似[15]。
正常状态下,HSC为静止状态,当肝脏受到刺激后迅速激活HSC,数量迅速升高,生成大量纤维细胞,破坏细胞外基质合成、降解[16]。在肝纤维化恢复阶段,活化HSC数量明显降低,诱导HSC凋亡[17]。国外学者研究显示,miR-15b可以下调线粒体凋亡蛋白Bcl-2,上调Caspase-3,诱导HSC细胞凋亡[18]。细胞周期检测结果显示,miR-16能够抑制周期蛋白D1表达,使其在G1期增殖受阻滞,抑制细胞增殖,诱导凋亡[19]。体外研究结果显示,促纤维化细胞因子能够使HSC中miR-21上调,进而促进PTEN的表达,抑制HSC激活诱导其凋亡[20]。国外相关研究结果显示,miR-29b为肿瘤抑制因子,能够抑制肿瘤细胞增殖,诱导凋亡,同时抑制细胞侵袭能力[21]。国内研究报道,miR-29b能够通过抑制PTEN基因促进乳腺癌细胞迁移、凋亡[22]。本研究结果表明,转染miR-29b后 HSC-T6细胞增殖明显受到抑制,尤其在48 h时抑制最为明显。流式细胞仪检测结果显示,细胞在G1期增殖受到阻滞,G1期细胞数高于空白对照组、阴性转染组,而S期细胞数量降低。细胞流式仪检测结果显示,细胞凋亡率增加,提示转染miR-29b后能够抑制HSC-T6、LX-2细胞增殖,诱导HSC-T6、LX-2细胞早期凋亡,抑制肝纤维化。
本研究也存在一定的局限性,选取的模型时间较少,后期需要设置不同时间的模型组进一步验证,此外并未对肝纤维化大鼠进行给药治疗,以便探究miR-29b在肝纤维化恢复期的作用。总之,随着大鼠肝纤维化加重,miR-29b表达量逐渐降低,可抑制肝星状细胞增殖,诱导凋亡。
