三溴丙酮酸对MCF-7细胞增殖、侵袭的影响及其机制研究*
2018-11-20李浩戴世龙赵宇许博文张青松
李浩,戴世龙,赵宇,许博文,张青松
(1.河北省开滦总医院 普外科,河北 唐山 063000;2.华北理工大学 研究生学院,河北唐山 063210)
乳腺癌是常见的恶性肿瘤之一,部分患者确诊时肿瘤已浸润、转移,因此寻找有效的治疗中、晚期肿瘤的药物具有重要意义。三溴丙酮酸(3 bromopyruvate, 3-BrPA)是可促进凋亡或自噬的抗肿瘤新药[1-2]。目前,对其抑制肿瘤增殖及侵袭的机制知之甚少。真核转录起始因子5A2(eukaryotic translation initiation factor 5A2, eIF5A2)、c-myc基 因及转移相关蛋白1(metastasis-associated protein 1,MTA1)在肿瘤增殖、侵袭中起重要作用[3]。3-BrPA是否通过该途径发挥抗肿瘤作用,尚未见报道。本实验通过研究3-BrPA对eIF5A2、c-myc基因、MTA1表达的影响,探讨其抑制肿瘤增殖、侵袭的可能机制。
1 材料与方法
1.1 材料
1.1.1 细胞株及仪器 乳腺癌MCF-7细胞株由华北理工大学中心实验室保存。
1.1.2 主要仪器 iMark酶标仪、Mini-Protean Tetra System、Trans-Blot SD Semi-Dry Transfer Cell购 自美国伯乐公司,QuantStudioTM6 Flex Real-Time PCR System(美国life公司),超速低温离心机(美国Sigma公司),Transwell小室(美国Costar公司)。
1.1.3 主要试剂 3-BrPA(大连美仑生物技术有限公司),MTT(美国Sigma公司),胎牛血清(澳大利亚Bovogen Biologicals公司),Matrigel基质胶(美国BD公司),eIF5A2、MTA1兔抗人单克隆抗体(美国Cell Signaling公司),c-myc兔抗人多克隆抗体(美国Epitomics公司),β-actin鼠抗人单克隆抗体(台湾Arigo公司);逆转录聚合酶链反应(reverse transcription-polymerase chain reaction,RT-PCR)试剂盒、SYBR® Premix Ex TaqTMⅡ(Tli RNaseH Plus)试剂盒购自大连宝生生物技术有限公司,RT-PCR特异性引物(上海英潍捷基贸易有限公司)。
1.2 方法
1.2.1 细胞培养及分组 乳腺癌MCF-7细胞在DMEM培养基(含10%胎牛血清和1%双抗),置于37℃、5%二氧化碳CO2恒温培养箱中常规培养,2 d或3 d换液1次。待长至80%~90%密度时,按1∶2传代培养。实验分为5组:加入等量PBS的对照组,75、100、125和150μmol/L 3-BrPA组(实验组)。
1.2.2 MTT法 利用MTT法检测细胞增殖情况。取对数生长期MCF-7细胞,将细胞按5×104个/孔接种于96孔板。细胞贴壁后,实验组加入等体积不同浓度的3-BrPA(以PBS稀释),对照组加入等体积PBS,每组6个复孔,常规培养24、48和72 h后加入MTT 15μl/孔,37℃孵育4 h,弃上清,加入二甲基亚砜 150μl/孔,摇床上震荡10 min,酶标仪检测490 nm处光密度值(optical density, OD值)。细胞存活率=实验组OD值/对照组OD值×100%,实验重复3次。
1.2.3 Transwell实验 依据Transwell实验,研究3-BrPA对MCF-7细胞侵袭的影响。在上室中均匀加入Matrigel胶,加入100μl以无血清培养基重悬的MCF-7细胞悬液,细胞数约2×104个/孔;下室加入含20% FBS的DMEM培养基600μl。细胞贴壁后,实验组分别加入等体积的75、100和150μmol/L 3-BrPA溶液,对照组加入等体积PBS,常规培养24 h后取出Transwell小室,PBS清洗2遍或3遍,4%多聚甲醛固定10 min,用棉签轻轻拭去室内未侵袭出的细胞,瑞士-吉姆萨染色10 min后PBS清洗3遍,每个小室随机取3个视野采集图像,实验重复3次。
1.2.4 RT-PCR 采用RT-PCR检测eIF5A2、c-myc及MTA1基因的表达。实验组MCF-7细胞以100μmol/L 3-BrPA处理24 h,对照组加入与药物等体积的PBS,提取细胞总RNA,纯度控制在1.8~2.1。按照RT-PCR试剂盒说明书进行操作。反应条件:95℃预变性30 s,95℃变性5 s;60℃退火34 s,共40个循环。以2%琼脂糖凝胶电泳行荧光扩增产物验证。采用2-ΔΔCt法对结果进行分析,β-actin为内参,引物序列见表1。

表1 PCR引物序列
1.2.5 Western blot检测 采用 Western blot检测eIF5A2、c-myc及MTA1蛋白的表达。用药物处理各组细胞24 h,BCA法定量提取蛋白,与5×上样缓冲液按4∶1的比例混合均匀后煮沸3~5 min备用。制胶、电泳、转膜,5%脱脂奶粉封闭2 h,4℃孵育一抗过夜。TBST漂洗3次,5 min/次,摇床上二抗孵育2 h,TBST漂洗3次,5 min/次。化学发光剂显影,内参选用β-actin,采用Image J软件分析图像灰度值,每组实验重复3次。
1.3 统计学方法
数据分析采用SPSS 20.0统计软件,计量资料以均数±标准差(±s)表示,两组比较用t检验,多组比较用方差分析,方差齐则两两比较用LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 3-BrPA对乳腺癌MCF-7细胞的生长抑制作用
24、48和72 h时,5组MCF-7细胞存活率比较,经方差分析,差异有统计学意义(P<0.05)。3-BrPA作用于乳腺癌MCF-7细胞后,细胞存活率降低,并具有剂量和时间依赖性。进一步两两比较经LSD-t检验,3-BrPA作用24 h时,75和100μmol/L 3-BrPA组细胞存活率与对照组比较,差异无统计学意义(P>0.05);药物处理48 h时,各实验组较对照组细胞存活率降低(P<0.05);150与125μmol/L 3-BrPA组细胞存活率比较,差异无统计学意义(P>0.05);3-BrPA作用于细胞72 h时,各实验组较对照组细胞存活率降低(P<0.05);75和100μmol/L 3-BrPA作用于细胞后,其存活率随药物作用时间延长而降低(P<0.05)。见表2和图1。
表2 各组不同时间点MCF-7细胞存活率比较 (%,±s)

表2 各组不同时间点MCF-7细胞存活率比较 (%,±s)
注:†与对照组比较,P <0.05
24 h 48 h 72 h对照组 100.00±0.00 100.00±0.00 100.00±0.00 75μmol/L 3-BrPA组 94.85±6.20 83.00±2.60† 74.58±5.75†100μmol/L 3-BrPA组 82.4±12.59 68.79±6.07† 59.62±12.6†125μmol/L 3-BrPA组 26.38±10.16† 20.75±7.72† 17.83±3.82†150μmol/L 3-BrPA组 16.43±2.91† 12.37±3.18† 12.78±3.50†F值 152.206 394.904 191.023 P值 0.000 0.000 0.000组别
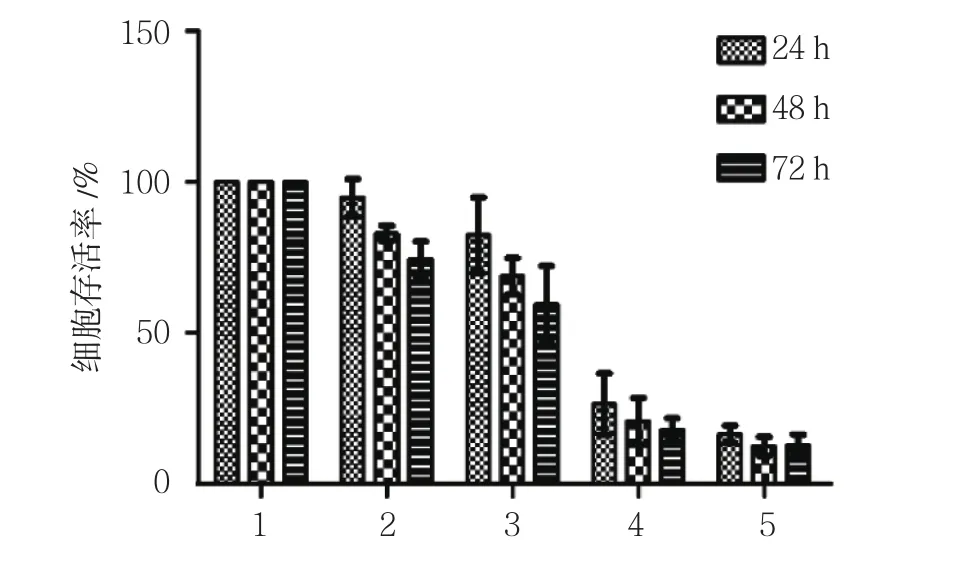
图1 各组不同时间点MCF-7细胞存活率比较 (±s)
2.2 3-BrPA对MCF-7细胞侵袭的影响
MCF-7细胞经3-BrPA处理24 h时,对照组,以及75、100和150μmol/L 3-BrPA组细胞数分别为(281.67±18.77)、(159.00±24.06)、(76.33±9.07) 和(40.67±11.50)个,经方差分析,差异有统计学意义(F=119.894,P=0.000),各组穿过的细胞数不同。进一步两两比较经LSD-t检验,与对照组相比,各实验组细胞数降低,且具有剂量依赖性(P<0.05)。见图2。
2.3 3-BrPA对eIF5A2、c-myc及MTA1基因表达的影响
RT-PCR结果表明,标准化对照组基因表达量为(1.000±0.000),则 100μmol/L 3-BrPA 组eIF5A2、c-myc及MTA1基因的相对表达量分别为(0.764±0.088)、(0.735±0.144)和(0.606±0.095)。100μmol/L 3-BrPA作用24 h时的eIF5A2、c-myc及MTA1基因表达水平与对照组比较,差异有统计学意义(t=4.664、3.186和7.170,P=0.010、0.033 和 0.019),100μmol/L 3-BrPA组较对照组降低。见图3。
2.4 3-BrPA对eIF5A2、c-myc及MTA1蛋白表达的影响
MCF-7细胞经3-BrPA处理24 h后,75和100μmol/L 3-BrPA组、对照组eIF5A2、c-myc及MTA1蛋白表达水平比较,经方差分析,差异有统计学意义(P<0.05),75和 100μmol/L 3-BrPA 组较对照组降低。进一步两两比较经LSD-t检验,75μmol/L 3-BrPA组eIF5A2蛋白表达水平与对照组比较,差异无统计学意义(P>0.05);100μmol/L 3-BrPA组eIF5A2蛋白表达水平较对照组降低(P<0.05);与对照组相比,c-myc和MTA1蛋白表达量经3-BrPA处理后均降低,且具有浓度依赖性(P<0.05),其中MTA1蛋白降低更明显。见表3和图4。
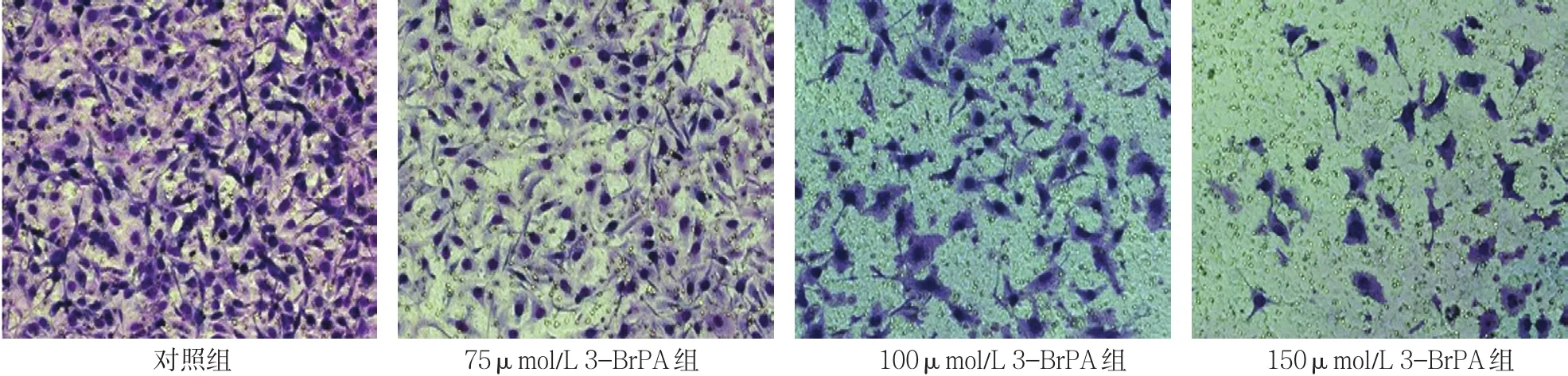
图2 3-BrPA作用24 h时各组MCF-7细胞侵袭情况 (×200)
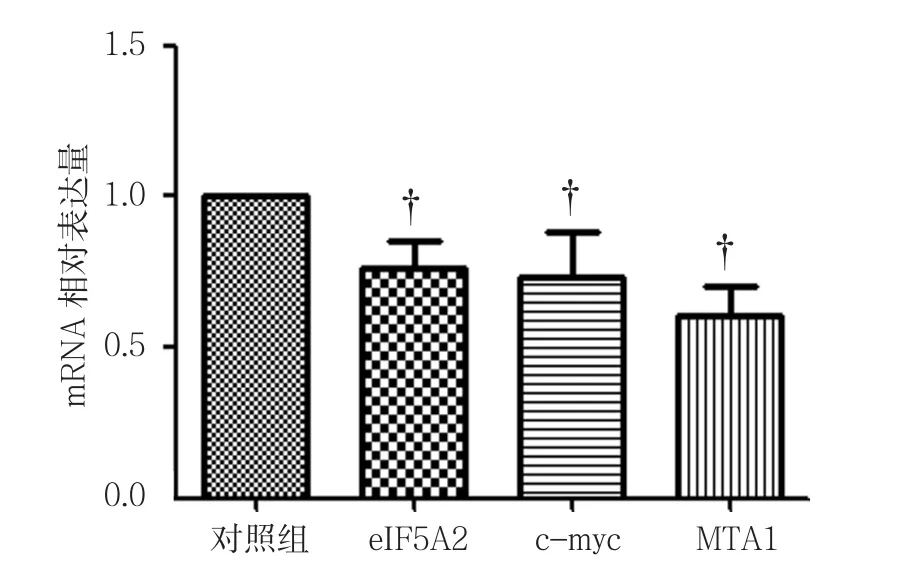
图3 对照组与100μmol/L 3-BrPA组eIF5A2、c-myc及MTA1基因相对表达量比较 (±s)
表3 各组eIF5A2、c-myc及MTA1蛋白表达水平比较 (±s)

表3 各组eIF5A2、c-myc及MTA1蛋白表达水平比较 (±s)
注:†与对照组比较,P <0.05
eIF5A2 c-myc MTA1对照组 0.971±0.102 1.029±0.112 1.549±0.045 75μmol/L 3-BrPA组 0.821±0.057 0.687±0.057† 1.049±0.125†100μmol/L 3-BrPA组 0.628±0.083† 0.516±0.069† 0.368±0.044†F值 12.976 29.749 160.834 P值 0.007 0.001 0.000组别

图4 各组eIF5A2、c-myc及MTA1蛋白的表达 (±s)
3 讨论
乳腺癌发病率居女性肿瘤之首,且近10年仍有上升趋势[4]。部分患者被确诊为乳腺癌时,已发生浸润及远处转移,此时化疗具有重要意义。3-BrPA是近年发现的一种新型有效的抗肿瘤药物,目前处于研究阶段,尚未进入临床应用。以往的研究主要集中在对肿瘤糖代谢及凋亡方面的研究[5],关于其抑制肿瘤增殖及侵袭的机制知之甚少。
eIF5A2在胃腺癌、卵巢癌、结肠癌、非小细胞性肺癌及食管癌等实体肿瘤中均有过表达[6]。eIF5A2过表达与患者生存期的缩短呈正相关,并且会增加肿瘤的侵袭及转移,促进肿瘤上皮间质转化。降低eIF5A2基因的表达,肿瘤的侵袭、转移及上皮间质转化受到抑制。有研究表明,eIF5A2可通过c-myc调节MTA1的表达,来降低肿瘤侵袭和转移的能力[7-8]。有研究表明,eIF5A2-c-myc/MTA1轴在肿瘤的上皮间质转化、增殖、迁移及侵袭中可能起重要作用[3]。MTA1为eIF5A2的下游靶点,下调MTA1的表达后,胰腺癌SW1900细胞的增殖、迁移及侵袭作用受抑制,细胞凋亡率增加[9]。MENG等[10]研究提示,下调eIF5A2基因以降低CyclinD1、CyclinD3的表达,可抑制胰腺癌MKN28细胞的增殖;亦可通过eIF5A2抑制c-myc、MTA1的表达及上皮间质转化途径,降低其侵袭和迁移能力。XU等[11]通过miR-9靶向作用于非小细胞肺癌细胞eIF5A2基因后,细胞上皮间充质转化受抑制,增殖和迁移能力也降低。MENG等[8]通过siRNA抑制eIF5A2基因,可明显抑制胃癌细胞的增殖、迁移及侵袭能力。
有研究表明,3-BrPA可以抑制MCF-7细胞增殖,使细胞周期阻滞在S期及G2/M期,并促进其凋亡,该过程可能与降低Bcl-2、c-myc及突变型P53的表达有关[12]。依据MTT和Transwell结果,3-BrAP作用于乳腺癌MCF-7细胞,其增殖和侵袭能力降低;RTPCR和Western blot结果表明,3-BrPA作用于乳腺癌MCF-7细胞24 h,eIF5A2、c-myc、MTA1基因和蛋白表达水平降低,其中MTA1基因和蛋白降低更为明显。
综上所述,3-BrPA可以抑制乳腺癌MCF-7细胞的增殖和侵袭,其机制可能与降低eIF5A2、c-myc、MTA1基因和蛋白的表达有关,但具体作用机制有待进一步深入研究。目前,3-BrPA尚处于临床前研究阶段,细胞实验和动物体内实验效果均比较理想。由于3-BrPA在溶剂中的化学性质不稳定,见光易分解。因此,解决药物成药问题是其进入临床应用的关键,也是下一步的研究重点。
