肝细胞癌中SETDB1的表达及其对肿瘤生长的影响
2018-11-20
(西南医科大学附属医院 肝胆外科,四川 泸州 646099)
肝细胞癌(hepatocellular carcinoma, HCC)是我国最常见的消化系统恶性肿瘤之一[1-2]。编码基因位于人类染色体1q21上的SET结构域分支型1(SET domain bifurcated 1, SETDB1)是一种组蛋白赖氨酸N端甲基转移酶[3-5]。有研究显示,前列腺癌及非小细胞肺癌中高表达的SETDB1对肿瘤细胞的增殖、迁移及侵袭具有促进作用,并且能对患者预后进行评价[6-7]。本研究检测HCC中SETDB1的表达,通过敲除SETDB1研究其对肝癌细胞体内外增殖凋亡能力的影响。
1 资料与方法
1.1 一般资料
1.1.1 临床资料 选取2014年1月-2016年3月于西南医科大学附属医院肝胆外科行手术切除的50例HCC患者的组织标本及35例因肝外伤或肝血管瘤而切除患者的正常肝组织标本。所有标本于离体30 min内取材,于中性甲醛溶液中保存、固定。
1.1.2 细胞来源及主要试剂 肝癌MHCC97H细胞购自上海细胞库,并由本科实验室保存。SETDB1特异性shRNA慢病毒颗粒(病毒载体类型:psi-LVRH1GP)购自广州复能基因公司,DMEM(11965-084)、胎牛血清(16000044)购自美国Gibco公司,Annexin V凋亡检测试剂盒(FITC/PI双染法,E606336)购自上海生工生物工程有限公司,Trizol试 剂(15596026)、RT-PCR试剂盒(SuperScript®One-Step RT-PCR System with Platinum® Taq DNA Polymerase, 10928042) 及qPCR试剂盒(DyNAmo Flash SYBR Green qPCR Kit, F415L)购自美国Invitrogen公司,兔抗人SETDB1单克隆抗体(#2196)、兔抗人组蛋白H3单克隆抗体(#9717)、兔抗人H3K9me3单克隆抗体(#13969)、兔抗人p53单克隆抗体(#2527)及兔抗人β-actin单克隆抗体(#4970)购自美国CST公司;兔SP免疫组织化学试剂盒购自武汉博士德生物技术有限公司。
1.2 免疫组织化学染色
将石蜡包埋的标本组织切片常规进行脱蜡及水化预处理;用抗体稀释液按1∶100比例稀释兔抗人SETDB1多克隆抗体,滴加抗体于组织切片上并充分浸没组织标本。4℃恒温冰箱内孵育过夜,洗净未结合一抗后,使用辣根过氧化物酶标记的山羊抗兔二抗结合相应一抗,DAB法显示阳性蛋白。每张组织切片在400倍视野下随机选取10个视野进行阅片。>10%癌细胞胞核呈棕黄色或棕褐色染色即为阳性,否则判定为阴性。
1.3 细胞培养及慢病毒感染
MHCC97H细胞于适宜环境中培养,稳定传2代或3代后进行实验。将MHCC97H细胞按过夜增殖至愈合度达70%的密度接种于6孔细胞培养板。达到预定培养密度后移除培养基,磷酸盐缓冲溶液(phosphate buffer saline, PBS)充分洗涤细胞。慢病毒感染分组:每孔加入1 ml sh-SETDB1慢病毒上清液、2 ml完全培养基及15μg Ploybrene作为sh-SETDB1组;每孔加入1 ml sh-Control慢病毒上清液、2 ml完全培养基及15μg Ploybrene作为sh-Control组。转染48 h后,使用含2μg/ml Puromycin的完全培养液筛选稳定转染细胞株。
1.4 qRT-PCR
通过Trizol试剂提取标本及细胞RNA,配制逆转录及PCR扩增体系。逆转录条件:50℃预变性30 min,94℃变性2 min,循环1次后94℃变性15 s,60℃退火30 s,68℃延伸3 min,循环40次后72℃继续延伸10 min。通过2-△△Ct法计算SETDB1基因的相对含量。
1.5 Western blot检测
采用RIPA试剂提取细胞总蛋白,凝胶垂直电泳分离蛋白,70 V恒压转膜150 min,5%牛血清白蛋白(bovine serum albumin, BSA)室温封闭1 h;用3%浓度的脱脂奶粉溶液按1∶1 000比例稀释SETDB1、H3K9me3、p53及β-actin抗体。在4℃下孵育相应条带过夜。洗去残余一抗后采用1∶5 000稀释的辣根过氧化物酶标记山羊抗兔或抗鼠二抗室温孵育条带1 h。于暗室内,增强化学发光法观察蛋白表达。每个样本独立重复实验3次。
1.6 平板克隆形成试验
将MHCC97H细胞按500个/孔均匀接种于6孔板中,更换完全培养基2次/周。培养2周后,使用4%多聚甲醛固定细胞30 min,1%结晶紫染色15 min,置于蒸馏水中洗去多余染液。风干后将6孔板置于网格纸上统计每孔克隆形成数量,计算克隆形成率。每个样本独立重复实验3次。
1.7 流式细胞术
将MHCC97-H细胞用预冷PBS工作液冲洗2次,胰酶消化细胞后1 500 r/min离心5 min沉淀细胞,预制缓冲液调整细胞数为1×106个/ml,将500μl细胞悬液与5μl Annexin V-FITC及10μl PI混合,室温遮光反应10 min后上机测试。
1.8 裸鼠皮下移植瘤模型的复制
6只5周龄BLAB/c裸鼠,随机分为sh-SETDB1组和sh-Control组,每组3只,分组后各组适应性饲养1周。分别取对数生长期的sh-SETDB1和sh-Control细胞,以冷PBS溶液制成细胞悬液,调整细胞终浓度为2.0×107个/ml。使用1 ml注射器,将0.2 ml细胞悬液(约含4.0×106个细胞)接种于裸鼠背部近右下肢处皮下组织内,复制裸鼠皮下移植瘤模型。裸鼠饲养4周,每周测量肿瘤长度及宽度,按(长轴×短轴2)/2来计算肿瘤体积,绘制肿瘤生长曲线。
1.9 统计学方法
数据分析采用SPSS 13.0统计学软件,计量资料以均数±标准差(±s)表示,比较用t检验或单因素方差分析,计数资料以率(%)表示,比较用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 SETDB1蛋白在HCC和正常肝组织中的阳性表达
免疫组织化学染色发现,SETDB1位于细胞核。50例HCC组织中SETDB1蛋白的阳性表达率为80.00%(40/50),35例正常肝组织中SETDB1蛋白的阳性表达率为31.43%(11/35),经χ2检验,差异有统计学意义(χ2=20.238,P=0.000)。见图1。

图1 SETDB1在HCC和正常肝组织中的表达
2.2 不同影响因素下的SETDB1阳性表达
HCC组织中不同直径肿瘤比较,差异有统计学意义(P<0.05),SETDB1阳性表达与肿瘤体积增大关系密切。见表1。
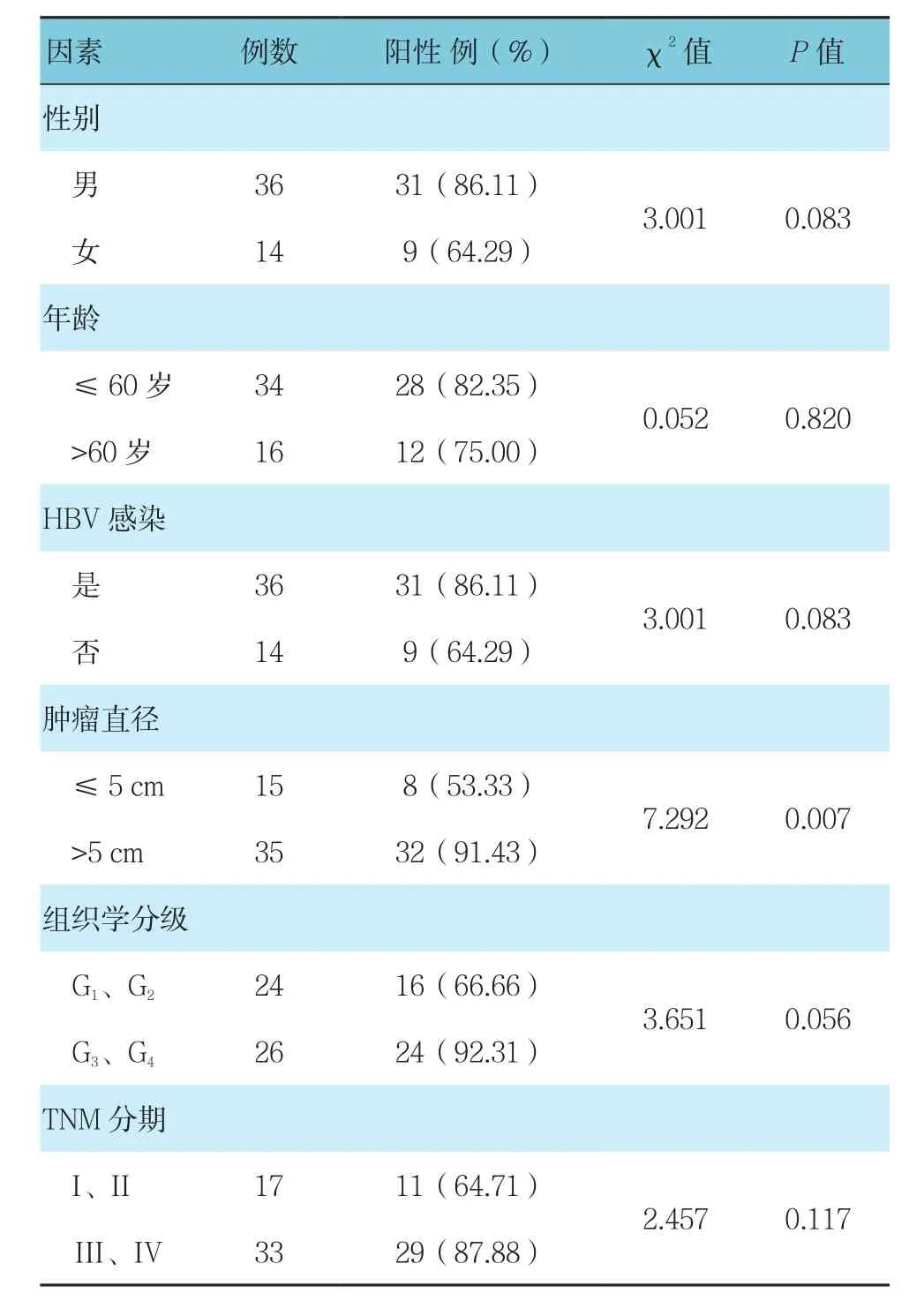
表1 不同影响因素下的SETDB1阳性表达率比较
2.3 沉默SETDB1表达对MHCC97H细胞增殖、凋亡的影响
sh-Control组SETDB1 mRNA相对表达量为(1.00±0.00),sh-SETDB1组 为(0.38±0.11), 经t检验,差异有统计学意义(t=5.219,P=0.017)。sh-Control组SETDB1蛋白相对表达量为(0.46±0.08),sh-SETDB1组为(0.17±0.02),经t检验,差异有统计学意义(t=3.071,P=0.036)。sh-SETDB1组抑制MHCC97H细胞克隆率为(81.34±10.29)%,sh-Control组为(53.22±8.31)%,经t检验,差异有统计 学 意 义(t=4.025,P=0.029)。sh-SETDB1组 促进MHCC97H细胞凋亡率为(31.45±6.19)%,sh-Control组为(18.08±5.33)%,经t检验,差异有统计学意义(t=3.740,P=0.031)。见图 2。

图2 沉默SETDB1表达对MHCC97H细胞增殖、凋亡的影响
2.4 沉默SETDB1表达对裸鼠皮下移植瘤生长的影响
sh-SETDB1组MHCC97H细胞在裸鼠体内的生长速度为(0.010±0.004)cm3/d,sh-Control组为(0.050±0.010)cm3/d,经t检验,差异有统计学意义(t=23.605,P=0.039)。饲养4周后处死动物获取皮下肿瘤,sh-SETDB1组最终肿瘤体积为(1.34±0.31)cm3,sh-Control组为(0.41±0.12)cm3,经t检验,差异有统计学意义(t=3.581,P=0.031)。见图3。
2.5 沉默SETDB1表达对MHCC97H细胞中H3K9me3和p53表达的影响
sh-Control组MHCC97H细胞中H3K9me3的表达水平为(0.73±0.09),sh-SETDB1组为(0.13±0.02),经t检验,差异有统计学意义(t=4.427,P=0.025)sh-Control组 p53的表达水平为(0.67±0.06),sh-SETDB1组 为(0.21±0.04), 经t检 验, 差异有统计学意义(t=3.060,P=0.041),sh-Control组H3的表达水平为(0.42±0.03),sh-SETDB1组为(0.39±0.02),两组比较,差异无统计学意义(t=1.036,P=0.205)。SETDB1并未调控组蛋白H3的表达,而是通过调控组蛋白H3甲基化抑制p53的表达,促进肿瘤细胞增殖。见图4。
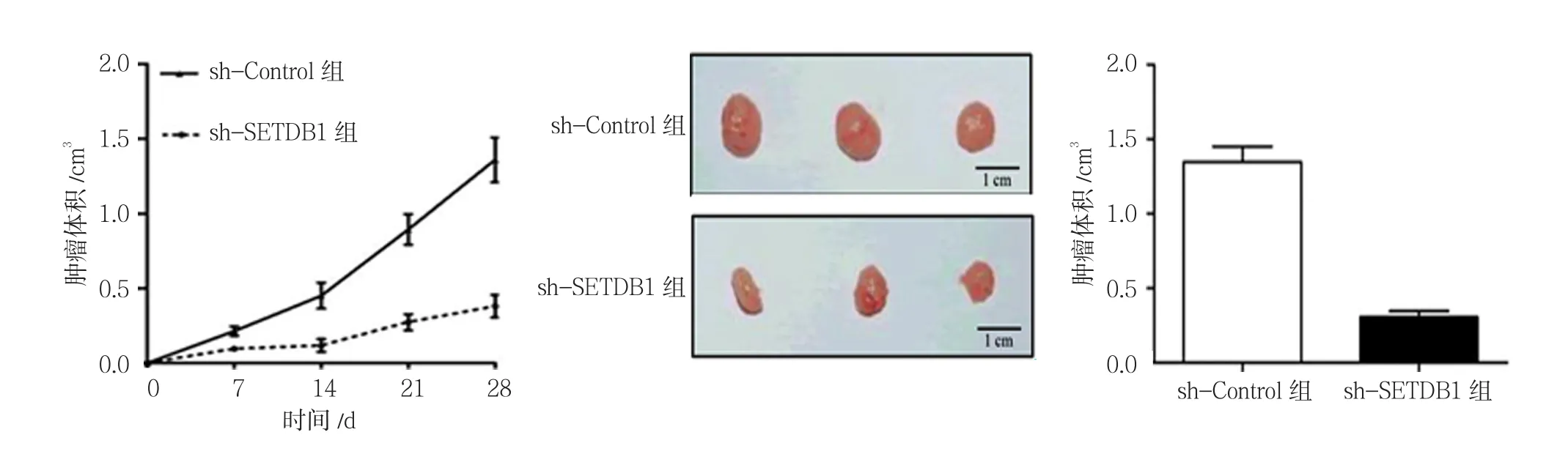
图3 沉默SETDB1表达对MHCC97H细胞移植瘤生长的影响

图4 沉默SETDB1表达对MHCC97H细胞内H3K9me3和p53表达的影响
3 讨论
SETDB1作为一种蛋白甲基化转移酶,实验证据表明其能与异染色质蛋白1及其共抑制子KAP1在异染色质中结合而促进H3K9me3形成[8-9]。本研究的免疫组织化学染色结果显示,50例HCC组织中SETDB1的阳性表达率要高于35例正常肝组织,并且高表达SETDB1的患者肿瘤体积增大。说明在临床上检测肝癌组织中SETDB1的表达对判断患者肿瘤进展有一定参考价值。
目前,虽然在许多肿瘤中都发现了SETDB1的异常表达,但是其具体的生物学功能尚不完全清楚[10]。在非小细胞肺癌中,SETDB1通过正向激活WNT-βcatenin信号通路来促进HCC细胞增殖,相似的生物学作用也存在于脑胶质母细胞瘤中[11-12]。但是WU等[13]的研究结果却指出,SETDB1能与SMAD2和SMAD3形成SETDB1/SMAD2/3抑制性复合体来抑制TGF-β诱导的肺癌细胞转移。在本研究中,笔者通过细胞增殖及凋亡实验表明,体外沉默SETDB1的表达致使肝癌MHCC97H细胞的增殖能力受到抑制。除此之外,动物肿瘤生长模型也指明,下调SETDB1的表达能够抑制MHCC97H细胞在体内的生长。综合上述结果表明,下调SETDB1的表达是抑制肝癌生长的有效手段之一。SETDB1能够特异性甲基化组蛋白H3的K9位点,形成甲基化的组蛋白H3K9me3。有研究指出,H3K9me3的形成与包括p53在内的许多抑制肿瘤细胞生长的基因失活有关[14]。在本研究中,笔者在沉默SETDB1表达后发现H3K9me3的表达水平降低,而p53的表达水平升高,提示SETDB1促肿瘤生长可能与抑制p53的表达有关。另外,p53在肺癌中还可能作为一种转录抑制因子结合在SETDB1的启动子区域,抑制其转录过程[15]。说明p53与SETDB1存在复杂的相互制约关系。在HCC中p53的失活是一种普遍现象,这也部分揭示了SETDB1在HCC中高表达的原因[16]。
综上所述,SETDB1是HCC中高表达的促癌分子,沉默SETDB1的表达可能通过恢复p53的表达而抑制HCC增殖并促进其凋亡。
