脉冲射频背根神经节对CCI模型大鼠脊髓中Iba1和TRPV1表达的影响*
2018-11-20徐雪汝林星武傅少雄施小妹刘荣国
徐雪汝 林星武 傅少雄 施小妹 刘荣国
(福建医科大学省立临床学院 福建省老年病重点实验室 福建省立医院疼痛科,福州350001)
神经病理性疼痛 (neuropathic pain, NP)[1]是由于躯体感觉系统的损伤或疾病所引起的疼痛,严重影响病人生存质量,是医学界亟待解决的重大课题。已知脊髓中活化的小胶质细胞在NP的产生和传导通路中发挥重要调节作用,阻断小胶质细胞的活化能明显缓解NP[2,3]。瞬时感受器电位香草酸受体1是分布于外周及中枢神经系统的离子通道型受体,脊神经损伤后,同侧DRG及脊髓内的TRPV1表达增加[4]。敲除脊髓及DRG中的TRPV1表达后,可明显缓解机械性及热痛觉过敏[5]。值得注意的是,增强 TRPV1表达可调控神经传导物质的释放,进而激活胶质细胞;而抑制TRPV1的表达,胶质细胞活化则明显下降[6]。因此TRPV1在激活小胶质细胞并形成NP中具有重要作用。脉冲射频作为一种微创技术被广泛用于慢性疼痛治疗,但PRF的神经调控机制尚未完全阐明。TRPV1作为小胶质细胞-神经元之间痛觉信号传递的关键分子,是否参与PRF的镇痛机制未见报道。本研究拟复制SD大鼠CCI疼痛模型,并对CCI大鼠DRG行PRF治疗,观察大鼠疼痛行为改变和脊髓中Iba1、TRPV1的表达变化,研究 PRF对CCI大鼠疼痛的调控作用及其镇痛机制,为临床应用PRF治疗NP提供实验依据。
方 法
1.实验动物和分组
清洁级SD 大鼠100只,体重250~280 g,由福建医科大学实验动物中心提供,采用随机数字表法分为4 组,每组25 只,分别为假手术组(Sham组)、慢性坐骨神经缩窄损伤组(CCI 组)、CCI +PRF处理组(CCI + PRF 组)、CCI + 假PRF处理组(CCI + free-PRF 组)。造模前 (Basal),CCI后1 d、3 d、5 d、7 d (CCI-1 d、3 d、5 d、7 d),PRF 后 1、7、14 d (PRF-1 d、7 d、14 d) 四组大鼠均接受行为学和痛阈测定。于术前、CCI-7 d、PRF-14 d每组各处死5 只大鼠,采用RT-PCR测定脊髓中Iba1、TRPV1表达水平。于CCI-7 d、PRF-14 d 采用免疫荧光法测定各组脊髓中Iba1、TRPV1水平。
2.模型制备
(1)慢性坐骨神经缩窄损伤(CCI) 模型 按照Bennett[7]的方法制备CCI 模型。大鼠全麻后暴露右坐骨神经主干,用4-0 铬制羊肠线(上海金环)环绕坐骨神经主干做4 道单结环扎,使单结刚好能沿神经上下滑动,每个结间隔1 mm。Sham组仅暴露右坐骨神经。为保证结扎松紧度一致,本研究采取专人结扎,由近及远,每次均以结扎侧肢体出现轻微抽动,术侧后爪不堪重负,足趾并拢轻度外翻、自发性的缩足反射等现象。
(2)脉冲射频DRG治疗模型 于CCI 后第7 d,暴露右侧L4-5DRG,将射频仪 (Cosman RF-G4 ,美国) 的负极板贴于大鼠足底,22G 射频治疗套管针(Cosman RF-G4,美国)置于DRG上,取出针芯,插入电极,连接射频仪,设定模式:脉宽20 ms、脉冲频率2 Hz,温度42℃,持续6 min。CCI + free-PRF 组:造模后第7 d,于右侧L4-5DRG放置射频电极,无脉冲射频治疗,持续6 min。术中肛温维持在37~37.5 ℃,于麻醉恢复期间,腹腔内注射5 ml 无菌生理盐水维持血容量。
3.疼痛行为学观察和测量
在造模前测定各组大鼠基础痛阈值,造模后1 d、3 d、5 d、7 d,PRF 后 1、7、14 d 进行疼痛行为学测定。所有测定均在8:00~12:00 am安静环境下进行。
(1)机械刺激缩爪反应阈值(mechanical withdrawal threshold, MWT) 测量 按照 Chaplan SR 等[8]的方法,用Von Frey 纤维(Stoelting公司,美国)以up and down 法测定MWT,将一有机玻璃箱置于金属筛网上,大鼠适应10 min 后,以Von Frey 针丝垂直刺激大鼠术侧后足掌部,避开爪垫,持续时间≤ 4 s,大鼠出现抬足或舔足行为视为阳性反应,否则为阴性反应。测定首先从2 g 开始,当该力度刺激不能引起阳性反应,则给予相邻大一级力度刺激;如出现阳性反应则给予相邻小一级力度刺激,如此连续进行,直至出现第一次阳性和阴性反应,再连续测定4 次,取平均值为阈值。最大力度为15 g,大于此值时记为15 g。每次刺激间隔30 s,每次测量时使尼龙丝弯曲到相同的弧度,以确保每次施加的刺激相同。
(2)热辐射刺激缩爪反应潜伏期(thermal withdrawal latency, TWL) 测量 按照Hargreaves等[9]的方法将动物放在6 mm 厚有机玻璃板上,将PL-200 型全自动热痛刺激仪(成都泰盟科技有限公司)光源焦距通过有机玻璃板照射动物后肢足底掌心,电子秒表记录从照射开始到引起后肢回缩反应时的潜伏期作为热痛觉观测指标。读数精确到0.01 s。取每只大鼠5 次测量结果的均值为统计数据,测量间隔时间为5 min。事先调节光照强度,使平均潜伏期约10 s。上限为20 s,以免造成组织损伤。
4.RT-PCR法测定Iba1、TRPV1的表达
取L4-5段脊髓,置于液氮中保存。利用Trizol提取组织总mRNA,按照说明书进行反转录和扩增,目的基因是TRPV1、Iba1,内参基因是β-actin。RT-PCR反应体系组成如下:cDNA 模板2 L、上下游引物各0.5 μl、1 U Taq 聚 合 酶、2 L 2.5 mmol/L dNTP 和2.5 L 10 × PCR 缓冲液,加超纯水至总体积25 L。反转录条件如下:37℃ 15 min,85℃ 5 s;冰上冷却,cDNA 产物-20℃冻存。扩增条件如下:95℃ 30 s,总共40 循环,95℃变性5 s,60℃退火20 s。每组都重复3次实验。各目的基因引物序列如下:Iba1:forward 5'-GCAAGGATTTGCAGGGAGGA-3',reverse 5'-TGGGATCATCGAGGAAGTGC-3';TRPV1:forward GAGTGCCGACACCTATCCAG,reverse CGATCACCTCCAGAACCGAG;β-actin:forward 5'-ACTCTGTGTGGATTGGTGGC-3',reverse 5'-AGAAAGGGTGTAAAACGCAGC-3' 。
5.免疫荧光染色法检测Iba1、TRPV1的表达
大鼠腹腔麻醉,开胸经心脏灌注4% 多聚甲醛。取L4-5段脊髓,并用刀片在非手术侧划一缺口作为标记,多聚甲醛固定12 h,样本置于石蜡中包埋,切片,片厚5 μm。采用等距随机抽样法,抽取5 张用于免疫荧光染色。脱蜡,3%过氧化氢室温下孵育10 min,0.1 mol/L 枸橼酸缓冲液微波修复10 min,冷却至室温,依次加入3% 血清工作液封闭10 min 后,甩掉封闭液,直接加入一抗:兔抗鼠Iba1 抗体(ab178680,abcam,英国),兔抗鼠TRPV1抗体 (ab74855,abcam,英国),1:300,4℃孵育过夜,滴加羊抗兔二抗IgG (1:5 000,Thermo 公司,美国),室温孵育30 min,PBS 冲洗3次,抗荧光淬灭封片液封片,Olympus 光学显微镜(Olympus,日本)观察。阴性对照以PBS 代替一抗,余步骤相同。
6.统计分析
采用SPSS 20.0 统计学软件进行分析,符合正态计量资料以均数 ± 标准差(±SD)表示,机械刺激缩爪反应阈值、热辐射刺激缩爪反应潜伏期采用重复测量数据的方差分析统计,并进行组间各时间点的比较。Iba1、TRPV1 的表达量采用单因素方差分析 (one-way ANOVA),组间两两比较采用LSD-t检验。P< 0.05 表示差异有统计学意义 。
结 果
1.MWT和TWL测定比较
(1)各组MWT的比较:术前各组间比较及Sham组内各时点比较,差异无统计学意义。CCI组、CCI + PRF组、CCI + free-PRF组均于CCI-7 d MWT降至最低,且三组之间比较,差异无统计学意义。脉冲射频后,CCI + PRF组MWT从2.69 ± 0.28 g(CCI-7 d) 上升至 6.96 ± 0.38 g (PRF-14 d),显著高于CCI组和CCI + free-PRF组(P< 0.05),但仍低于Sham组(P< 0.05,见图1A)。
(2)各组TWL的比较:术前各组间比较及Sham组内各时点比较,差异无统计学意义。CCI组、CCI + PRF组、CCI + free-PRF组均于CCI-7 d降至最低,且三组之间比较,差异无统计学意义。脉冲射频后,CCI + PRF组TWL从4.26 ± 0.08 s (CCI-7 d)上升至7.09 ± 0.34 s (PRF-14 d),显著高于CCI组和CCI + free-PRF组(P< 0.05),但仍低于Sham组(P< 0.05,见图1B)。
2.RT-PCR法检测Iba1、TRPV1 mRNA水平
术前、CCI-7 d、PRF-14 d测定各组Iba1、TRPV1 mRNA表达水平。术前各组Iba1、TRPV1 mRNA 均低水平表达。CCI-7 d,与Sham组比较CCI组、CCI + free-PRF组、CCI + PRF组表达显著增加(P< 0.05), 但 CCI组、CCI + free-PRF组、CCI +PRF组之间两两比较无显著性差异。于PRF-14 d,CCI + PRF组Iba1、TRPV1 mRNA表达均比射频治疗前(CCI-7 d)显著降低(P< 0.05),并低于CCI组和CCI + free-PRF组(P< 0.05),但仍高于Sham组(P< 0.05,见图2)。
3.免疫荧光法检测Iba1、TRPV1的表达
Sham组内各时间点大鼠脊髓中小胶质细胞胞体小、荧光表达强度弱。CCI-7 d, CCI组、CCI +free-PRF组、CCI + PRF组,小胶质细胞活化状态,胞体增大,形态清楚,形态呈“丰满”状,Iba1、TRPV1蛋白免疫反应荧光密度值与Sham组比较显著增强(P< 0.05),但三组两两比较,无显著性差异。PRF-14 d,CCI + PRF组 Iba1、TRPV1蛋白免疫反应荧光密度值显著低于CCI组和CCI + free-PRF组 (P< 0.05),但仍显著高于 Sham 组 (P< 0.05)。CCI + PRF组 PRF-14 d与 CCI-7 d比 较,Iba1、TRPV1蛋白免疫反应荧光密度值明显减少(P< 0.05,见图3、4)。

图1 四组术侧MWT (A)和TWL (B)比较(±SD)*P < 0.05,与 Sham 组比较;#P < 0.05,与CCI组、CCI + free-PRF组比较;△P < 0.05,与CCI + PRF组内的CCI-7 d比较Fig.1 The comparison of MWT (A) and TWL (B) in ipsilateral paw among four groups (±SD)*P < 0.05, compared with those in group Sham; #P < 0.05, compared with those in group CCI and CCI + free-PRF;△P < 0.05, compared with that on CCI-7 d in CCI + PRF group.

图2 各组大鼠脊髓Iba1、TRPV1 mRNA 表达比较(±SD)*P < 0.05,与Sham组比较;#P < 0.05,CCI + PRF组中 PRF-14 d与CCI-7 d比较;△P < 0.05,与CCI组、CCI + free-PRF组比较Fig.2 The comparisons of Iba1、TRPV1 mRNA expressions among different groups (±SD)*P < 0.05, compared with those in group Sham; #P < 0.05, PRF-14 d data compared with CCI-7 d data in group CCI + PRF; △P < 0.05, compared with those in group CCI and CCI + free-PRF.

图3 各组大鼠脊髓Iba1, TRPV1表达比较(免疫荧光法,×100) Scale bar = 200 μmFig.3 Expressions of Iba1, TRPV1 in the spinal cord of rats in different groups (immunofluorescence, × 100) Scale bar = 200 μm
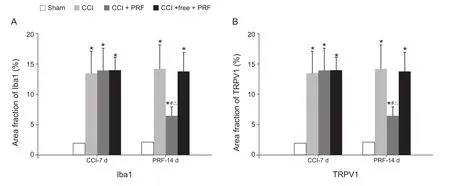
图4 免疫荧光法检测各组大鼠脊髓中Iba1、TRPV1的表达(±SD)*P < 0.05,与Sham组比较;#P < 0.05,CCI + PRF组中PRF-14 d与CCI-7 d比较;△P < 0.05,与CCI组、CCI +free-PRF组比较Fig.4 The comparisons of Iba1, TRPV1 expressions among different groups in immunofluorescence (±SD)*P < 0.05, compared with those in group Sham; #P < 0.05, PRF-14 d data compared with CCI-7 d data in group CCI +PRF; △P < 0.05, compared with those in group CCI and CCI + free-PRF.
讨 论
本研究选用的是 SD大鼠CCI模型,对坐骨神经主干轻度结扎,选择性损伤有髓鞘的神经纤维,保留大部分具有传递疼痛作用的C类纤维,可以很好地模拟出人类临床常见慢性疼痛的症状[10]。大鼠CCI模型建立后第1 天即出现术侧足趾外翻,下肢软弱无力,不堪重负,行走缓慢,后足翻起部分触碰地面,会立即主动撤回该足,并发生自发性缩足动作。造模后第1天术侧后爪开始出现疼痛反应,MWT 和TWL与假手术组相比明显降低,CCI-7 d达高峰并在随后观察时间内维持稳定,而假手术组各时点MWT 和TWL 无显著性变化,表明NP模型成功。本实验的疼痛行为学改变也曾于笔者之前的研究所证实[11,12]。
NP的发生机制涉及外周敏化和中枢敏化。当外周组织损伤后,机体产生、释放炎症介质,直接或间接作用于伤害性感受器,伤害性感受信息沿着传入神经汇集于假单极神经元DRG中,DRG将汇聚的痛、温、触等各种信息整合,经脊髓背角、脑干和丘脑向上传递,最终在大脑皮层形成痛觉。脊髓是疼痛信息传递和整合的初级中枢,在中枢敏化中发挥重要作用,因此我们选择脊髓节段作为研究观察的切入点。现已证实,当外周神经损伤后,脊髓背角接收异常兴奋的初级感觉神经元信号,引起脊髓中小胶质细胞肥大、增殖以及相关基因表达等一系列改变,由静息态的分枝状转变为活化态阿米巴状后释放多种生物活性物质,使神经元- 胶质细胞以及胶质细胞-胶质细胞之间建立起双向信息交流通路,从而形成NP,而抑制小胶质细胞活化以及其活性物质的释放可明显减轻疼痛[13,14]。本研究Sham组中各时间点大鼠脊髓中小胶质细胞胞体小、荧光强度弱。CCI损伤后,小胶质细胞胞体增大,形态清楚,形态呈“丰满”状,Iba1(小胶质细胞特异性抗体)免疫荧光强度及Iba1 mRNA表达亦明显升高,同时伴随着机械痛和热痛的出现,以上结果提示,本研究中脊髓小胶质细胞参与了NP的形成,这与Masuda等[15]的研究结果一致。
瞬时感受器电位受体(TRPV1),是一种配体门控的非选择性阳离子通道,对多种有害的化学和热刺激敏感,炎性物质激活TRPV1后引起大量Ca2+内流,并触发外周感觉神经末梢释放大量炎性介质,从而加剧疼痛。TRPV1除了在炎症性疼痛中发挥重要作用外,还参与了NP的痛觉敏化。研究发现,在完全弗氏佐剂所致的炎性痛模型[16]、SNI所致的NP模型[2]中TRPV1表达均明显上升;在大鼠糖尿病性NP模型中DRG、脊髓背角、皮肤端TRPV1水平均于造模后7 d开始上升,14 d达到顶峰,28 d恢复正常水平[17]。因此,TRPV1参与多种疼痛的传导过程。本研究造模前脊髓中TRPV1 呈低水平表达,CCI后TRPV1表达显著增加,并于损伤后21 d的观察期内维持高水平,这与上述研究结果相似,再次证明了TRPV1参与了NP 的形成。目前,已知位于感觉传入系统中的TRPV1可调控神经传导物质的释放,如谷氨酸、脊髓背角中的降钙素基因相关肽,进而激活胶质细胞。而Chen 等发现足底注射辣椒素、完全弗氏佐剂注射、坐骨神经结扎的小鼠脊髓中Iba1明显升高,在TRPV1基因敲除的小鼠中Iba1则明显下降,提示在伤害性、神经病理性、炎症性疼痛中TRPV1对于激活脊髓中的小胶质细胞发挥重要作用[18]。因此,抑制TRPV1表达可减少小胶质细胞激活,从而阻断NP的发生、发展。
临床上对于顽固性NP的治疗,口服药物疗效欠佳,而神经毁损、外科干预等可导致不可逆并发症。PRF作为一种有效的疼痛治疗手段已被广泛用于NP治疗。对于PRF的镇痛机制,有研究认为,PRF可选择性引起细胞形态、突触传递和疼痛信号的改变来实现神经调控。例如,Van Zundert等[19]发现,PRF治疗后实验动物的脊髓背角浅表I和II板层中,c-fos的免疫反应阳性神经元明显升高。Vallejo等[20]在坐骨神经损伤附近应用PRF,发现可调节痛觉传导通路上疼痛基因的表达,减少损伤侧坐骨神经、DRG促炎基因的表达,如TNF-α和IL-6。亦可上调DRG中γ-氨基丁酸受体、Na/K-ATP酶、5-羟色胺Ⅲ受体,脊髓c-fos、Na/K-ATP酶的表达。由于NP的发生机制牵涉到极其复杂的神经网络系统,上述研究远未穷尽PRF的镇痛机制。最近研究发现,NP大鼠DRG实施PRF治疗后,大鼠的机械痛敏减轻,同时脊髓背角内小胶质细胞的活化降低。笔者前期研究发现,PRF可以明显减轻CCI 模型的机械异常痛敏、热痛敏,并在治疗后14天的观察期维持稳定[11]。鉴于疼痛模型中TRPV1对于激活脊髓中的小胶质细胞发挥重要作用,遏制TRPV1表达可以抑制小胶质细胞激活并缓解慢性疼痛。由于PRF可降低小胶质细胞活化而缓解疼痛,因此PRF 的作用机制可能与TRPV1的改变有关。本研究发现:①大鼠CCI后第7 d于DRG实施 PRF治疗,射频后第1天即开始出现机械痛阈和热痛阈的回升,至治疗后第7 d、14 d均持续升高,提示单次PRF治疗可抑制致痛物质的释放及正反馈信号形成,因此在停止治疗后仍有持续调控镇痛作用,但阈值未恢复至正常水平。这也说明,本实验中的PRF(脉宽20 ms、脉冲频率2 Hz,温度42℃,持续6 min)模式不能够完全逆转和治疗NP,如果要进一步提升疗效,可尝试改变PRF的参数设置、在中枢敏化形成之前治疗、或者复合小剂量的镇痛药物等。②CCI后大鼠脊髓内Iba1、TRPV1表达程度较CCI前均显著增强,而PRF治疗后两者表达显著减弱,但仍强于Sham组,同时伴随着痛阈的提高。以上结果表明,在CCI模型中脊髓TRPV1表达和小胶质细胞活化增加,PRF治疗有可能抑制CCI大鼠脊髓中TRPV1的表达而减轻小胶质细胞活化,从而缓解疼痛。
本研究的不足之处是仅短时间观察(14天)PRF的镇痛作用;论证了PRF能够抑制脊髓内TRPV1和小胶质细胞活化而缓解疼痛,但未做TRPV1免疫双标,不能确定TRPV1表达于何种细胞等等,更多具体细节仍需后续深入研究。
综上所述,PRF大鼠CCI模型DRG可下调脊髓内TRPV1的表达,抑制小胶质细胞的活化,进而减轻NP,这为临床应用PRF治疗慢性疼痛再次提供了理论支持依据。
