慢性神经痛对中脑腹侧被盖区多巴胺神经元活动水平的影响*
2018-11-20李永丰钱召强
李永丰 钱召强
(1陕西师范大学现代教学技术教育部重点实验室,西安710062;2陕西师范大学生命科学学院,西安710062)
慢性疼痛是人群中比较常见的疾病之一,但其病因复杂、部分发病机理不明,临床表现复杂多变,治疗效果不佳,是长期困扰病人和医生的难题;同时慢性疼痛可以加重情绪障碍,引起焦虑,长期会导致抑郁症状的发生,许多慢性痛病人的器质性疾病已经恢复,但伴随着出现了焦虑抑郁样情绪,因此,疼痛与抑郁症发生之间的关系成为近来关注的难点问题。研究表明,慢性疼痛可以诱导出抑郁相关行为。在大鼠部分坐骨神经结扎(the partial sciatic nerve ligation model, PSNL)模型中,术后4周强迫游泳测试(forced swimming test, FST)和悬尾测试(tail suspension test, TST)不动时间明显增加[1],小鼠探究能力减弱[2];大鼠在神经瘤动物模型(the sciatic nerve neuroma)中表现出快感缺失(糖水偏爱测试中糖水偏爱率下降)和FST不动期增加[3],表现出明显的抑郁样行为;CCI模型中,术后2~4周强迫游泳不动时间显著增加,快感缺失[4],并且疼痛敏感程度与不动期持续时间呈正相关[5]。以上实验都发现经历了慢性疼痛组小鼠有明显的抑郁样行为。
多巴胺(dopamine, DA)奖赏通路在疼痛反应和抑郁症的发生中发挥着重要的作用。研究发现,伏隔核[6](nucleus accumbens, NAc)以及多巴胺的释放量与减缓持续性的疼痛作用相关[7,8],DA参与了吗啡系统的镇痛作用等[9]。Rossetti ZL等建立习得性无助模型后发现伏隔核内多巴胺水平也表现出明显降低,而抗抑郁治疗可通过上调NAc内DA水平而消除抑郁样行为[10]。在社交挫败抑郁动物模型中,小鼠中脑腹侧被盖区(ventral tegmental area, VTA)多巴胺能神经元的放电频率明显增加[11],相反慢性不可预测应激(unpredictable chronic mild stress,CMS)使得VTA区自发放电频率减少50%,通过在基底外侧杏仁核和腹侧苍白球进行调[12]。近期研究发现,双向控制(抑制或者激活)VTA脑区特定的多巴胺能神经元可以诱导或者逆转应激所产生的抑郁症状[13,14],该研究提示中脑多巴胺系统参与了疼痛等负面情绪的调节,进一步引发对慢性疼痛诱发焦虑抑郁样状态机制的探讨和研究。
VTA多巴胺能神经元参与社交挫败、慢性不可预测应激、慢性疼痛经历等所导致的抑郁症的发生,然而其电生理机制尚未见研究报道。因此,本研究采用坐骨神经慢性压迫模型作为慢性疼痛模型,在其疼痛经历的过程和诱发抑郁焦虑样行为表现的基础上,利用在体多通道电生理及行为学等手段,深入探讨慢性疼痛经历与VTA脑区多巴胺能神经元电活动之间的关系,同时为慢性疼痛导致焦虑抑郁样情绪症状的有效治疗提供新思路。
方 法
1.实验动物及分组
健康雄性C57BL/6J小鼠(实验开始时8~9周龄),由南京大学-南京生物医药研究院提供。12小时昼夜周期,室温23±2℃,相对湿度为50%±5%。实验前动物4只一笼饲养,自由进食饮水,适应环境一周。随后将动物随机分为2组:A组:假手术组(Sham);B组:CCI模型组(CCI)。在实验第0天测痛之后分别进行假手术和手术,在第1、4、7、21、30天测机械和热痛,在第33天进行糖水偏爱测试,在第35天进行旷场和高架十字迷宫测试实验,同时在第35天做在体电生理记录。
2.实验仪器
热刺激痛觉测试仪(美国ITC公司),Electric Von Frey电子测痛仪(美国Stoelting公司),旷场,高架十字迷宫,LabState多功能动物行分析系统(宁波安来软件科技有限公司),EthoVision XT 10运动轨迹跟踪系统(荷兰Noldus公司),CED电生理记录分析系统(英国CED公司),脑立体定位仪(美国Kopf公司)。
3.实验方法
(1)慢性神经病理性疼痛模型的建立
建立慢性神经病理性疼痛模型:参照文献报道[15]的方法,小鼠腹腔注射戊巴比妥钠(40 mg/kg)麻醉后,切开左后肢上部皮肤,分离肌肉暴露坐骨神经主干,用鼠尾胶原纤维(约5#羊肠线直径)从坐骨神经中枢端到外周端依次轻度结扎打三个结,结扎环间隔0.15 mm,结扎松紧程度以左后肢出现轻微收缩为宜,对坐骨神经形成区段性的慢性压迫。手术完成后,缝合肌肉和皮肤,伤口处涂抹青霉素预防感染。
假手术:只暴露出坐骨神经不结扎,其余步骤和建模完全一致。
(2)机械痛阈值测定(mechanical withdrawal threshold, MWT)
术后第4、7、21、30天进行测试,将小鼠放入底为铁丝网的不透明有机玻璃箱(13 cm×14 cm×9 cm)内,让小鼠在此环境适应30 min,待小鼠的梳理和探究活动基本消失后,用von Frey纤毛垂直刺激小鼠左后肢足底中部,持续加力,记录能引起左后肢产生缩足反应的力,重复3次,若2次引起左后肢产生缩足反应,则记录为机械痛阈值[16]。
(3)热缩腿反射潜伏期测定(thermal withdrawal latency, TWL)
术后第4、7、21、30天进行测试,将小鼠置于底为3 mm厚玻璃板的不透明有机玻璃箱 (13 cm×14 cm×9 cm)中,使其适应30 min,待小鼠的梳理和探究活动基本消失后,热刺激痛觉测试仪照射小鼠左后肢足底中部(落在足底的光斑直径约为3 mm),记录从照射开始至小鼠出现抬腿回避时间即为TWL,照射时间不超过30 s,以防小鼠足底灼伤。每只小鼠测量5次,对侧间隔5 min,去掉最大值和最小值,计算3次TWL的平均值[16]。
(4)糖水偏爱测试
术前1天,术后第14、33天进行测试。实验前一天训练小鼠适应实验环境2小时。实验前一天晚上20:00剥夺水瓶,实验当天8:00开始进行饮水消耗测试,分别量取等量的一瓶1%的蔗糖溶液和一瓶清水,供小鼠饮用。实验期间由Lab State软件自动记录2小时内小鼠舔舐两种液体的次数。计算糖水消耗的总体积以及糖水偏爱的百分比[17]。
(5)旷场测试
术前1天,术后第14、35天进行旷场测试。测试当天实验开始前,将小鼠置于测试环境中适应环境半小时以上,降低小鼠对新环境的应激水平。实验开始时,将小鼠放在一个四周和底面为均匀白色的旷场测试箱(无盖方箱,50 cm×50 cm×40 cm)箱底中心。用Ethovision XT 10动物运动轨迹跟踪系统记录其10 min的活动情况。主要记录和分析指标:小鼠的运动距离、在中心区域(25 cm×25 cm)停留时间。每只小鼠实验结束后,清理箱内小鼠粪便和尿液,清水和30%酒精擦拭箱体去除异味,防止影响后续小鼠的测试。
(6)高架十字迷宫测试
术前1天,术后第14、35天进行测试。测试当天实验开始前,将小鼠置于测试环境中适应环境半小时以上。实验开始时,将小鼠放置在高架十字迷宫装置中心。用EthoVision XT 10动物运动轨迹跟踪系统记录其5 min的活动情况。主要记录和分析指标:小鼠的运动距离、进入开臂的次数、在开臂停留的时间。每只小鼠实验结束后,都要清理箱内残留物,清水和30%酒精擦拭去除异味,防止影响后续小鼠的测试。
(7)在体电生理记录
在术后的第14、35天,小鼠用25%乌拉坦(40 mg/kg)进行全身麻醉,然后固定于脑立体定位仪上,用保温毯保持体温37±1℃,然后沿大脑中缝线剪开皮肤,用颅钻在颅骨上开窗,根据大鼠脑立体定位图谱进行核团定位,记录电极电阻3~7 Ω,电极内液为2 mol/L KCl,中脑腹侧被盖区(AP:-3.2 mm; ML: ± 0.5 mm; DV: -4.0 mm),多巴胺能神经元根据其自身的放电特征进行识别和分析(频率< 10 Hz,动作电位持续时间> 2.5 ms)[18]神经元自发电信号的胞外记录,记录稳定的放电状态5分钟,计算单位时间的放电频率,采用CED公司的在体多通道神经电生理记录分析系统,使用Spike 2软件进行记录和分析。
4.统计分析
采用SPSS 20.0软件进行统计学分析,结果用均数±标准误(±SEM)形式表示,多组样本均数比较进行方差齐性检验,组间比较采用单因素方差分析(One-way ANOVA),post hoc检验采用LSD法,对于VTA多巴胺能神经元放电特征比较采用Students't检验进行。
结 果
1.行为学结果
(1)小鼠术后MWT和TWL的变化
机械痛、热痛敏阈值显示术后第4、7、14天Sham和CCI组之间小鼠痛阈表现出显著性差异(P< 0.001,见图1 A),术后14天MWT降至最低。术后21天Sham和CCI组之间小鼠痛阈出现显著性差异(P< 0.05,见图1B),术后30天CCI组小鼠MWT和TWL基本恢复到基础值状态。在这个过程中,研究表明CCI造模成功,第30天恢复了正常的阈值,表明疼痛症状消失。
(2)糖水偏爱测试
糖水偏爱实验结果显示,术前1天与术后14天CCI组小鼠均无显著的糖水摄入次数偏爱,与术后33天相比(P= 0.006,P< 0.01,见图2 A),术后第14天与手术后第33天相比(P= 0.002,P< 0.01,见图2 A)摄入糖水次数均明显下降,具有显著性差异;术后33天与术前1天(P= 0.039,P< 0.05,见图2 B),术后第14天与术后第33天(P= 0.027,P< 0.05,见图2 B)相比摄入糖水的比率(摄入糖水的次数比摄入糖水和水的次数之和)都明显降低,具有统计学差异。
(3)旷场测试
旷场实验结果显示,术前1天与术后第14、35天相比,小鼠运动距离无显著性差异,表明CCI手术14天后,小鼠的运动能力已基本恢复(见图3 A)。术后14、35天小鼠均表现出在旷场中心区域停留时间降低,其中术后第35天与术前相比,有显著性差异(P= 0.009,P< 0.01,见图3 B)。
(4)高架十字迷宫测试
高架十字迷宫结果显示,术后第35天CCI组小鼠与手术前(P= 0.009,P< 0.01,见图4 A),手术后第14天与手术后第35天(P= 0.011,P< 0.01,见图4 A)相比在开臂中停留的时间均表现出显著性差异;进入开臂次数百分比与术前与术后第35天(P= 0.003,P< 0.01,见图4 B),手术后第14天与手术后第35天(P= 0.045,P< 0.01,见图4 B)相比都表现出显著性差异。

图1 (A)Sham和CCI组小鼠机械痛阈值测定(n = 9,±SEM);(B)热缩腿反射潜伏期测定(n = 10,±SEM)手术后假手术和手术组30天内疼痛阈值的比较,*P < 0.05,***P < 0.001Fig.1 (A) Mechanical withdrawal threshold and (B) Thermal withdrawal latency of CCI model mice and Sham mice.Compared with sham, ***P < 0.001 (n = 9,±SEM); *P < 0.05 (n = 10,±SEM)

图2 CCI组小鼠糖水偏爱测试(n = 10,±SEM)摄入糖水的总次数(A)和摄入糖水的比率(B)第33天明显比手术前,手术后第14天降低,**P < 0.01,*P < 0.05Fig.2 Sucrose preference test of CCI model mice (n = 10,±SEM)Compared with the -1day,(A) the sucrose intake frequency and (B) preference were statistically reduced on the 14th,33th day after surgery, ** P < 0.01,*P < 0.05.
(5)慢性神经痛大鼠多巴胺能神经元放电的改变
分别对手术前,手术后14天,35天的小鼠,采用在体多通道电生理技术,在动物中脑腹侧背盖区进行神经元自发放电的记录和采集,分别记录各组小鼠各8只,用spike2软件对神经元自发放电特征进行甄别后每组依次记录63,64,91个神经元自发放电信息。统计分析发现各组小鼠VTA脑区多巴胺能神经元自发放电频率活动水平手术后14天显著增加(P< 0.001),手术后35天显著降低(P= 0.041,P< 0.05,见图5 A)和手术前相比较,簇状放电活动水平手术后第14天与术后第35天相比显著降低(P= 0.031,P< 0.05,见图5 C),术后第14天簇状放电活动的持续长度与术前和术后第35天相比均明显增加(P< 0.001,见图5 D)。
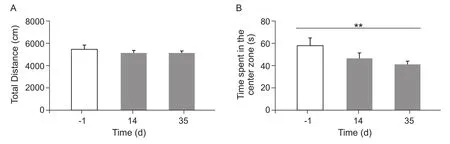
图3 CCI组小鼠的旷场测试总运动距离和中心区停留时间(n = 11-17,±SEM)(A)运动距离没有显著性的差异;(B)在中心区域停留的时间手术后第35天与术前相比明显减少, ** P < 0.01Fig.3 Total distance (cm) and time spent in the center zone (sec) of CCI group (n = 11-17,±SEM)Compared with the -1 day,(A) Total distance was not changed and (B) the time spent in the center zone was statistically reduced on the 35th day after surgery,** P < 0.01.
讨 论
目前,全世界至少有3.2亿人口正在受到慢性疼痛的折磨。这些病人伴随睡眠障碍、焦虑和抑郁等情绪障碍,严重影响病人的生活质量,其中神经病理性疼痛是最常见的慢性痛之一。神经病理性疼痛指外周或中枢系统损伤或疾病引起的疼痛综合征,以自发性疼痛、痛觉过敏和痛觉超敏为特征,严重影响着人类的健康和生存质量,神经病理性疼痛引发抑郁的内在机制复杂,涉及到不同的神经递质、离子通道、受体、神经元以及神经环路等多个层面的相互作用[19],存在有中枢炎症反应增强,单胺能系统功能障碍,神经再生降低和突触可塑性损害等发病机制和假说[20]。中脑边缘多巴胺奖赏系统控制动物多种行为的发生,如奖励动机性行为、成瘾以及学习相关行为[21]。目前的研究发现,慢性疼痛并发抑郁症与多巴胺神经传递失调等中脑边缘系统的功能异常有关[22,23],常引起情绪障碍以及机动性行为异常[24],但其确切电生理机制尚未明确,临床上也缺乏有效的治疗手段。

图4 CCI组小鼠高架十字迷宫开闭停留时间和进入开臂次数百分比(n = 11-17,±SEM)A 在中心区域停留的时间和进入开放臂次数百分比(%)手术后第35天,与手术前以及手术后第14天都存在显著性的差异,*P < 0.05,**P < 0.01Fig.4 Time spent in the open arm (s) and percent of entries in the open arm (%) of CCI model mice (n = 11-17,±SEM)Compared with the -1day, (A) the time spent and (B) percent of entries in the open arm were statistically reduced on the 35th day after surgery, *P < 0.05, ** P < 0.01.

图5 VTA区DA神经元在术前和术后第14、35天的放电活动 (n = 63, 39, 71,±SEM)(A) VTA多巴胺神经元放电频率在手术前和术后第14天,第35天的活动;(B)单个多巴胺神经元放电的波形;(C)多巴胺簇放电的频率和(D)每个簇放电的长度在手术前和术后第14天,第35天的活动;(E)手术前,手术后第14天,第35天单位时间簇放电示意图Fig.5 The firing activity of dopamine neurons in the VTA at 1 day before the operation,14 and 35 days after the operation(n = 63, 39, 71,±SEM)(A) the firing rates in dopamine neurons; (B) A representative firing trace in dopamine neuron; (C, D) the frequency and average length of burst in dopamine neurons; (E) Representative bursts firing traces in dopamine neurons.
本研究采用经典的坐骨神经慢性压迫作为慢性神经痛模型,并在术后不同的时间点观察和评价了动物慢性疼痛的行为学表观以及其所诱发的焦虑抑郁样行为。结果显示,在坐骨神经损伤后,小鼠机械和热痛阈值显著性降低;随着慢性疼痛的长期刺激,小鼠出现焦虑抑郁相关的行为学特征,坐骨神经压迫组小鼠出现了糖水偏爱率降低,旷场中心区域停留时间缩短,高架十字迷宫开臂探究时间减少。发现慢性疼痛引发的焦虑抑郁样情绪是一个长期稳定的表现,即CCI小鼠的焦虑抑郁样表现并没有随时间而消退,而是伴随疼痛症状的消失而出现。这些行为学表征表明小鼠探索能力下降,快感缺失以及兴趣缺失,与焦虑抑郁样的特征吻合,提示小鼠发生了焦虑抑郁样情绪表现。本研究通过在体多通道电生理技术,在神经损伤前1天,术后第14、35天后进行中脑腹侧被盖区神经元电信号的采集记录,并根据多巴胺能神经元的自发放电特征对神经元电信号进行筛选和甄别,通过比较分析,发现中脑腹侧被盖区多巴胺能神经元的自发放电频率在处于疼痛状态时增加,而在焦虑抑郁状态时降低;簇状放电中动作电位的数量和持续时间在处于疼痛状态时增加,在焦虑抑郁状态时减少。
Sagheddu等发现,在大鼠SNI手术后的第7~14天通过离体脑片记录中脑腹侧被盖区多巴胺能神经元的自发放电活动,多巴胺能神经元簇状电活动加强,即簇状放电中动作电位的数量增加了[25],结合本研究行为学结果,小鼠在术后14天并没有抑郁情绪的发生,Britt的研究发现大鼠在坐骨神经分支损伤模型(spared nerve injury model, SNI)术后第28天出现的抑郁症[26],这些报道与本实验结果相互印证,可见DA神经元的活动水平在小鼠慢性疼痛经历的过程中起着不同的作用,在术后第14天由于疼痛阈值达到了最低,小鼠处于最疼的状态,DA的活动水平显著增加,这和Brischoux报道的电击、机械伤害等厌恶刺激均可导致VTA区DA神经元的活动水平增加的现象一致[27]。第35天虽然小鼠的痛阈值恢复,但是由于长期的疼痛经历致使产生了焦虑抑郁样情绪,VTA的多巴胺神经元活动水平降低,与文献报道的DA神经元活动水平的高低扮演不同角色,并引发不同行为的结论一致[28,29]。中脑腹侧被盖区中DA神经元的活动水平与抑郁症发生密切相关,不同的应激模型中VTA区中的DA神经元的活动水平不一致[28],导致不同应激模型中DA神经元活动水平的差异主要是由于应激诱发的通路不同,例如社交挫败主要是VTA到NAc和前额叶(the medial prefrontal cortex, mPFC)的投射控制行为的发生[29,30],慢性应激主要发生在BLA和VP,因此虽然结果都发生探究能力下降,快感缺失等相似的抑郁症状,但却是由不同的环路和神经递质调节[28],同时厌恶刺激例如电击,机械伤害等均可导致VTA区DA神经元的活动水平增加[31,32]与本文研究的结果一致,在厌恶性刺激机械损伤坐骨神经结扎后第14天VTA中DA神经元活动水平增加,而疼痛症状消失之后小鼠出现了焦虑抑郁样情绪之后DA神经元的活动水平显著降低,进一步解释了在慢性痛的发展过程中VTA区DA神经元参与了其疼痛和焦虑抑郁样情绪的调节。
本研究提示,长期慢性疼痛刺激使得中脑腹侧被盖区多巴胺能神经元的自发放电的活动的变化,可能是抑郁症状出现的重要原因之一。慢性疼痛经历这一特殊因素诱发的焦虑抑郁样行为表现与中脑腹侧被盖区多巴胺能神经元电活动发生改变密切相关,为疼痛病发抑郁症的治疗提供了线索,但由于多巴胺能神经元存在多种离子通道和受体,关于疼痛、抑郁以及多巴胺神经元之间联系的分子机制仍有待进一步的研究发现。
