内皮祖细胞对老年大鼠创伤性颅脑损伤的影响
2018-11-19吉林医药学院附属医院放射科吉林吉林132013
唐 钰 (吉林医药学院附属医院放射科,吉林 吉林 132013)
创伤性脑损伤后血管生成是一种反应性保护机制。创伤性脑损伤后脑组织出现缺血缺氧,新生血管的生成具有重要作用,可以改善脑灌注,减轻继发性神经细胞损伤〔1,2〕。内皮祖细胞可以分化为内皮细胞,是血管内皮细胞的前体,在血管形成中发挥重要作用,内皮祖细胞通过分泌细胞因子促进损伤区新生血管生成〔3,4〕。顺磁性氧化铁(SPIO)可以标记脾脏来源的内皮祖细胞〔5,6〕。本文采用SPIO标记内皮祖细胞,通过CT灌注成像观察其对老年大鼠创伤性颅脑损伤影响。
1 材料与方法
1.1 材料 实验动物:健康、清洁级、雄性、17~19周龄、Wistar老年大鼠,购自北京生命科学研究所,许可证号:SYXK(京)2015-0003。
主要试剂:胎牛血清、淋巴细胞分离液、SPIO、Dulbecco磷酸盐缓冲液(DPBS,美国Sigma公司),胰蛋白酶、DMEM培养基、山羊抗大鼠CD31多克隆抗体(美国Gibco公司)等。
1.2 实验方法
1.2.1 内皮祖细胞分离、培养和鉴定 将大鼠处死后打开腹腔,分离脾脏组织,冲洗干净后剪碎,研磨,并加入DPBS冲洗至研磨脾脏变为接近白色,将得到的细胞悬液加入含有淋巴细胞分离液的离心管中,2 000 r/min离心20 min,提取单个核细胞的白膜层,再加入DPBS离心,弃去上清液,重复操作2次,支撑细胞悬液,将细胞悬液以3×106/ml接种到培养瓶中培养,观察细胞贴壁生长情况,采用流式细胞仪对内皮祖细胞进行鉴定。
1.2.2 SPIO标记内皮祖细胞 将SPIO工作液和多聚赖氨酸(PLL)工作液混合制成SPIO-PLL复合标记物,吸弃内皮祖细胞培养瓶中的培养基,加入复合标记物过夜孵育,普鲁士蓝染色观察标记的内皮祖细胞:将过夜孵育的内皮祖细胞洗涤后,多聚甲醛固定,加入普鲁士蓝溶液作用15 min,倒置显微镜观察SPIO标记的内皮祖细胞。
1.2.3 分组 将实验大鼠随机分为对照组(24只)、SPIO组(12只)、颅脑损伤组(24只)、内皮祖细胞组(36只),对照组大鼠不予任何处理,SPIO组大鼠颅脑损伤模型建立后6 h经尾静脉注射SPIO工作液100 μl,颅脑损伤组大鼠建立颅脑损伤模型,内皮祖细胞组大鼠建立颅脑损伤模型+建模后6 h经尾静脉注射SPIO标记的内皮祖细胞100 μl(1×106个内皮祖细胞)。
1.2.4 建立创伤性颅脑损伤模型 SPIO组、颅脑损伤组、内皮祖细胞组大鼠建立创伤性颅脑损伤模型。将大鼠腹腔麻醉成功后固定到手术台上,颅顶部皮肤消毒后行正中纵行切口暴露右侧顶骨,眼科镊扩大骨窗到3 mm×3 mm,将打击锤自由落体撞击硬脑膜,止血后缝合头皮。
1.2.5 各组大鼠建模后CT灌注成像 将对照组、颅脑损伤组和内皮祖细胞组大鼠各12只,移植后3、5、7 d进行CT灌注扫描,利用软件产生颅脑损伤伤侧和健侧脑血容量(CBV)、脑血流量(CBF)、平均通过时间(MTT)和表面通透性(PS),计算灌注指标的相对值(伤侧/健侧)。
1.2.6 普鲁士蓝染色 移植后2、24、48 h取SPIO组大鼠和内皮祖细胞组大鼠各4只,处死大鼠后取大鼠脑组织石蜡包埋进行普鲁士蓝染色。伊红染液复染,二甲苯固定切片,观察普鲁士蓝染色情况。
1.2.7 脑组织CD31+细胞免疫组化染色及微血管计数比较 移植后3、5、7 d取颅脑损伤组,内皮祖细胞组大鼠各8只,处死大鼠,取脑组织进行石蜡包埋,采用SP法对CD31+细胞进行常规免疫组化染色,胞核呈蓝色、胞质呈棕色的长条索样细胞为CD31+细胞,在400倍高倍镜下选5个高倍视野计数CD31+细胞,取平均值。微血管计数:胞质呈棕染的管腔样结构的内皮细胞或者两个及以上细胞之间的连接为微血管,在200倍视野下计数创伤区微血管数量。
1.3 统计学方法 采用SPSS20.0软件,计量资料两组之间比较采用t检验,多组之间比较采用方差分析,组内两两比较采用LSD检验。
2 结果
2.1 SPIO标记的内皮祖细胞对颅脑损伤区域的分布普鲁士蓝染色结果发现:移植后2、24、48 h,内皮祖细胞组在颅脑损伤区域均见大量蓝染颗粒聚集(SPIO标记的内皮祖细胞)。移植后2 h,蓝染细胞主要在颅脑损伤组织周边分布,和非损伤区域界限明显;移植后24 h,在颅脑损伤区域见少量散在蓝染细胞;移植后48 h,在颅脑损伤区域中央见大量蓝染细胞,表明SPIO标记的内皮祖细胞随着时间的延长,从颅脑损伤区域周边向颅脑损伤区域中央聚集;SPIO组在移植后2、24、48 h在颅脑损伤区域均未见蓝染细胞,表明SPIO没有向颅脑损伤区域聚集的能力。
2.2 颅脑损伤组和内皮祖细胞组微血管计数比较内皮祖细胞组移植后3、5、7 d颅脑损伤区微血管计数均显著高于颅脑损伤组(P<0.05)。见表1。
2.3 颅脑损伤组和内皮祖细胞组CD31+细胞数比较内皮祖细胞组移植后3、5、7 d颅脑损伤区CD31+细胞数均显著高于颅脑损伤组(P<0.05)。见表2。
表1 颅脑损伤组和内皮祖细胞组微血管计数比较(,n=8)
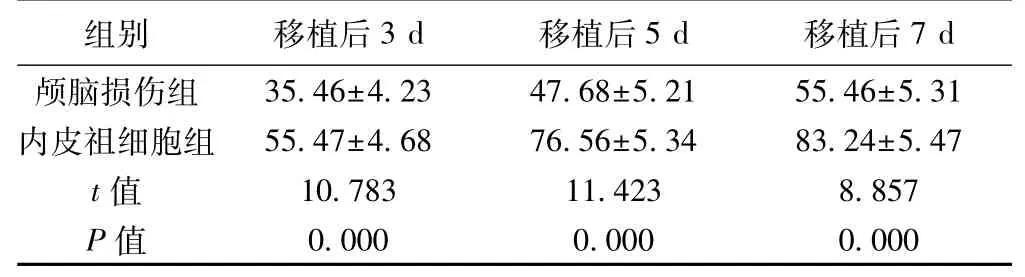
表1 颅脑损伤组和内皮祖细胞组微血管计数比较(,n=8)
组别 移植后3 d 移植后5 d 移植后7 d颅脑损伤组 35.46±4.23 47.68±5.21 55.46±5.31内皮祖细胞组 55.47±4.68 76.56±5.34 83.24±5.47 t值 10.783 11.423 8.857 P值 0.000 0.000 0.000
表2 颅脑损伤组和内皮祖细胞组CD31+细胞数比较(,n=8)

表2 颅脑损伤组和内皮祖细胞组CD31+细胞数比较(,n=8)
组别 移植后3 d 移植后5 d 移植后7 d颅脑损伤组 77.65±6.87 114.35±9.12 129.78±8.32内皮祖细胞组 121.43±8.21 163.24±9.53 178.69±8.57 t值 14.236 13.264 11.423 P值 0.000 0.000 0.000
2.4 各组大鼠CT灌注参数比较 颅脑损伤组大鼠移植后3、5、7 d相对脑血容量(rCBV)、相对脑血流量(rCBF)、PS值均显著高于对照组(P<0.05),移植后相对平均通过时间(rMTT)值和对照组比较差异无统计学意义(P>0.05);内皮祖细胞组移植后3 d和移植后5 d rCBV值显著低于颅脑损伤组(P<0.05),移植后7 d rCBV值和颅脑损伤组比较差异无统计学意义(P>0.05);内皮祖细胞组移植后 3、5、7 d rCBF和 PS值均显著低于颅脑损伤组(P<0.05),移植后5 d rMTT值显著高于颅脑损伤组(P<0.05),内皮祖细胞组移植后3、7 d rMTT值和颅脑损伤组比较差异无统计学意义(P>0.05)。见表3~表6。
表3 各组大鼠rCBV比较(,n=12,%)

表3 各组大鼠rCBV比较(,n=12,%)
与对照组比较:1)P<0.05;与颅脑损伤组比较:2)P<0.05;下表同
组别 移植后3 d 移植后5 d 移植后7 d对照组 101.23±5.46 102.13±5.37 101.75±5.18颅脑损伤组 179.89±32.141) 139.35±27.581) 124.34±21.261)内皮祖细胞组164.23±28.671)2) 82.31±19.831)2) 123.43±16.531)F值 43.264 31.243 13.231 P值 0.000 0.000 0.000
表4 各组大鼠rCBF比较(,n=12,%)
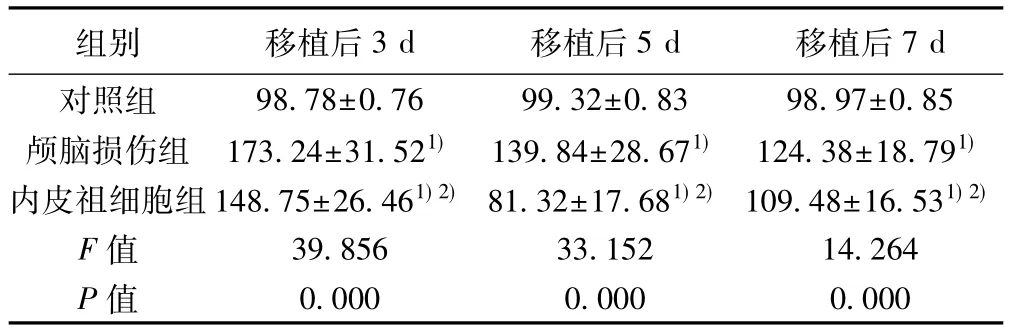
表4 各组大鼠rCBF比较(,n=12,%)
组别 移植后3 d 移植后5 d 移植后7 d对照组 98.78±0.76 99.32±0.83 98.97±0.85颅脑损伤组 173.24±31.521) 139.84±28.671) 124.38±18.791)内皮祖细胞组148.75±26.461)2) 81.32±17.681)2) 109.48±16.531)2)F值 39.856 33.152 14.264 P值 0.000 0.000 0.000
表5 各组大鼠rMTT比较(,n=12,%)

表5 各组大鼠rMTT比较(,n=12,%)
组别 移植后3 d 移植后5 d 移植后7 d对照组 101.32±4.65 102.64±5.36 101.87±4.86颅脑损伤组 102.53±8.67 101.73±7.54 99.96±7.83内皮祖细胞组 108.42±8.47 119.78±10.532) 102.31±8.02 F值 0.146 12.435 0.115 P值 0.836 0.000 0.867
表6 各组大鼠PS比较(,n=12,ml·100 g-1·min-1)

表6 各组大鼠PS比较(,n=12,ml·100 g-1·min-1)
组别 移植后3 d 移植后5 d 移植后7 d对照组 0.02±0.01 0.01±0.01 0.03±0.02颅脑损伤组 10.43±0.781) 7.68±0.571) 3.78±0.631)内皮祖细胞组 7.68±0.931)2) 4.47±0.531)2) 0.02±0.012)F值 344.264 253.254 66.364 P值 0.000 0.000 0.000
3 讨论
血管再生指血管以分裂或出芽的方式形成新的血管网,为细胞组织提供营养物质和氧气,改善局部组织血供,颅脑损伤后的血管再生可以恢复损伤区血供,减轻神经元受到的损害,颅脑损伤后血管再生在继发性损伤和创伤修复过程中发挥重要作用,因此促进颅脑损伤患者血管再生对损伤后修复具有重要作用〔7~9〕。内皮祖细胞参与新生血管的形成,颅脑损伤后局部缺血缺氧引起碱性成纤维细胞生长因子、血管内皮细胞生长因子等多种细胞因子表达上调,上述细胞因子的升高动员骨髓中内皮祖细胞,使内皮祖细胞和基质细胞的黏附作用降低进入血液,血液循环中的内皮祖细胞在黏附分子的作用下聚集到损伤部位,在损伤部位通过整合机制整合到新生血管壁内增殖分化为血管内皮细胞参与新生血管的生成;内皮祖细胞在局部微环境的作用下可以分化为血管内皮细胞参与血管内膜的再生;内皮祖细胞还可以通过旁分泌的方式影响血管生成因子的释放,促进血管内皮化,增加新生血管数量〔10~12〕。本文研究发现SPIO标记的内皮祖细胞可以增加颅脑损伤大鼠颅脑损伤区微血管计数和CD31+细胞数量,内皮祖细胞能够促进颅脑损伤大鼠颅脑损伤局部新生血管生成,能够促进颅脑损伤的修复。
CT灌注成像是脑功能成像的方法之一,可以通过组织血管化程度及血流灌注状态获得微循环的信号,可以通过CBV、CBF、MTT、PS等灌注参数反映内部微血管密度和血流动力学特点等情况,可以间接反映内皮祖细胞参与颅脑损伤区域血管再生的过程〔13,14〕。血液黏滞度、微动脉直径、动脉压、颅内压等决定了损伤灶局部的血流量,微动脉和微静脉直径的大小决定了CBV值,在机体创伤情况下血管自身调节功能异常,引起CBV值下降,从而导致组织灌注不足引起继发损伤,损伤早期脑水肿为血管性水肿,呈低灌注状态,对机体损害不大,随着病情进展发展为细胞毒性脑水肿,细胞毒性脑水肿对轻微损伤的神经元造成无法逆转的损伤,呈高灌注状态〔15〕。本研究结果发现,创伤性颅脑损伤大鼠脑损伤区处于高灌注期,内皮祖细胞抑制可以改善脑损伤区的高灌注水平,表面通透性恢复也比较快。
