国内外HER-2/neu基因扩增型胃癌临床病理及预后特征分析
2018-11-17黄秀芳原向伟刘琼茹梁津杰方晓华蔡育波杨文丽陈艳虹陈仙兰张林碧华
黄秀芳 原向伟 刘琼茹 梁津杰 方晓华 蔡育波 杨文丽 黄 辉 陈艳虹 陈仙兰张 鑫,3 林碧华
1.广东省江门市中心医院病理科,广东江门 529030;2.广东省江门市中心医院脊柱骨科,广东江门 529030;3.广东医科大学广东省医学分子诊断重点实验室,广东东莞 523808;4.广东医科大学生物化学与分子生物学教研室,广东东莞 523808
胃癌(gastric carcinoma)是常见的消化道恶性肿瘤,其中胃腺癌最为常见,可占85%以上[1-2]。世界新发胃癌的患者,一半以上位于我国[3],由于早期症状不典型,普查不及时,我国早期胃癌的诊断率不足10%,5年生存率较低[4-5],可见我国胃癌防治的严峻,深入研究胃癌的发生机制,寻找更为有效的诊断标记物及潜在的治疗靶点意义重大。曲妥珠单抗(Trastuzumab)在人类表皮生长因子受体2(human epidermal growth factor receptor 2, HER-2)阳性胃癌分子靶向治疗过程中的疗效已明确,荧光原位杂交(Fluorescence in situ hybridization, FISH)技术是检测HER-2/neu扩增的金标准,也是重要的胃癌伴随诊断项目[6]。虽然HER-2/neu扩增可指导患者用药,但HER-2/neu扩增的胃癌患者中,其临床病理特征及预后仍有争论。本文利用癌症基因组图谱(the cancer genome atlas,TCGA)的数据和我院胃癌患者数据进行比较,探索HER-2/neu扩增与胃癌临床病理特征及预后的相关性。
1 资料与方法
1.1 TCGA胃腺癌数据下载
参考文献[7-8],在R语言软件平台(v3.2)上通过TCGAbiolinks程序的GDCquery函数下载癌症基因组图谱中胃腺癌的基因组拷贝数信息(由Affymetrix Genome-Wide Human SNP Array 6.0芯片过滤得到)及对应样品的临床信息;利用GDCprepare_clinic函数输出整理各患者的病理临床信息。数据库的更新下载日期为2018年5月31日,基础信息较为完整的有效患者数为441例。
1.2 全基因组拷贝数变异分析
参考文献[9-11],在GenePattern公共服务器平台(https://genepattern.broadinstitute.org/),利用 GISTIC 2.0软件分析各组肿瘤样品的全基因组拷贝信息,参考基因组为人类19版基因组(human genome 19,hg19),探针标记的物理位点信息(Markers file)和CNV参照信息(CNV file)均整理自SNP Array 6.0的第 35版本信息(http://www.affymetrix.com/);关键的运行参数均为默认,并分析HER-2/neu基因(ERBB2)的拷贝数变异情况。
1.3 临床资料
选择2008年1月~2014年12月,在我院进行手术切除的胃癌标本404例,术前或活检前均未接受放、化疗及免疫治疗,所有标本均经病理学明确诊断为胃腺癌。三组数据集的一般临床病理信息比较见表1。
1.4 FISH法检测HER-2/neu基因扩增水平
HER-2/neu基因检测试剂盒购自广州达安基因股份有限公司(国械注册20153402099),操作步骤及判读标准参考说明书。根据病理医师选定的检测区域在蜡块上做标记,按4.0μm石蜡切片,65℃烤片1h;二甲苯室温脱蜡,逐级酒精水化,超纯水浸泡3min,沸水煮片20min;蛋白酶K反应液覆盖组织,37℃消化5min,过2×SSC缓冲液,逐级酒精脱水;探针杂交液覆盖组织,加盖盖玻片,橡皮胶水封边,85℃变性5min,37℃避光杂交过夜;孵育结束后,过2×SSC缓冲液,过0.1% NP-40/2×SSC缓冲液,70%乙醇脱水3min,滴加DAPI染液,加盖盖玻片,荧光显微镜观察计数,并参考文献[12]进行判读。
1.5 统计学方法
计数资料用频数表示,用Excel 2010及GraphPad Prism 5.0软件处理数据,各组间频数数据(2×2频数表)统计使用χ2检验(Chi-squared test)或Fisher’s精确检验(Fisher’sexact test),生存分析使用Kaplan-Meier分析、Log-rank检验,检验水平α=0.05。
2 结果
2.1 一般临床病理信息比较
比较TCGA数据库与我院患者一般临床病理信息,可知两群患者在年龄(χ2=30.082,P< 0.001)、T分期(χ2=46.662,P<0.001)和N分期(χ2=27.073,P<0.001)的分布中有差异,在性别、病理分级、M分期及临床分期中的分布无差异。
2.2 HER-2/neu基因扩增情况
TCGA数据库中,HER-2/neu基因扩增65例,占全部患者的14.7%;我院HER-2基因扩增69例,占全部患者的17.1%,两组数据分布无统计学差异(χ2=0.865,P=0.352)。
2.3 HER-2/neu基因扩增与胃癌临床病理学特征间关系
TCGA数据库和我院样品中,男性HER-2/neu扩增率高于女性,差异均具显著性(χ2=5.165,P=0.023及χ2=4.127,P=0.042);低、中病理分级的 HER-2/neu
扩增情况明显高于高病理级别,差异均具显著性(χ2=11.314,P<0.001及χ2=7.121,P=0.008)。此外,不同年龄、T分期、N分期、M分期及临床分期的胃癌HER2阳性率均无统计学差异,见表2。在性别、年龄、病理分期及TNM分期中,HER-2/neu扩增分布在TCGA数据库与我院样品间差异无统计学意义。
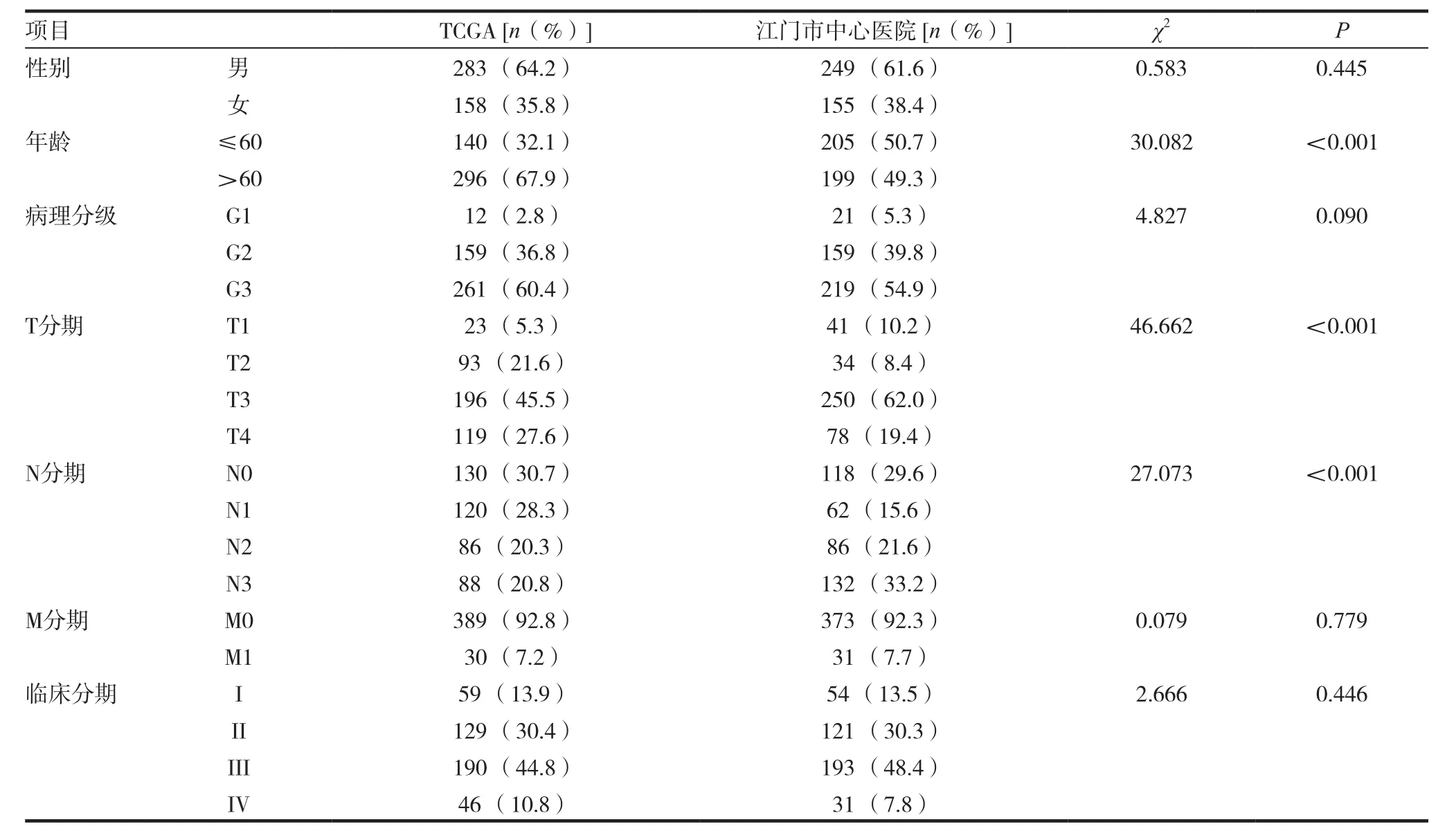
表1 TCGA及江门市中心医院胃癌患者的基本信息
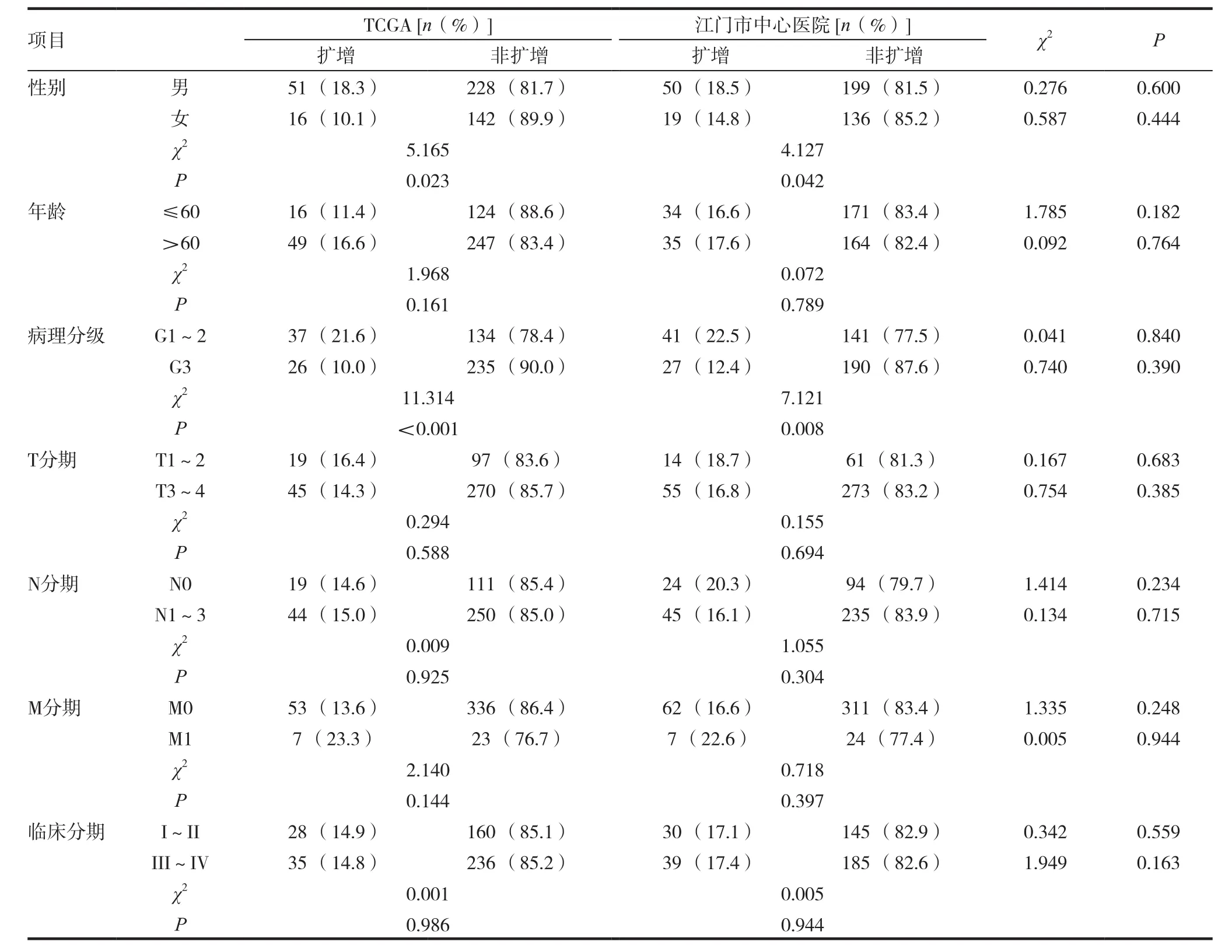
表2 TCGA及江门市中心医院胃癌患者的基本信息
2.4 HER-2/neu基因扩增与胃癌患者预后间关系
TCGA数据库和我院胃癌患者生存曲线的对比,见图1,其中HER-2/neu扩增患者的中位生存时间是26.4个月和38.8个月,HER-2/neu非扩增患者的中位生存时间是29.4个月和39.1个月,两群患者的生存预后差异无显著性(P=0.170和P=0.602)。

图1 TCGA胃癌患者生存预后情况
3 讨论
HER-2/neu的编码基因(又称 ERBB2),位于人染色体17q21,编码185kD的I型跨膜酪氨酸激酶,其基因扩增存在于乳腺癌、胃癌、卵巢癌、子宫内膜癌、结直肠癌和肺癌等恶性肿瘤[13-14]。HER-2/neu在胃癌及胃食管结合部癌的阳性率为4.4%~53.4%,均值为17.9%[15]; TCGA数据库中,HER-2/neu的阳性率为14.7%,我院样品HER-2/neu的阳性率为17.1%,两组数据差异无显著性,均符合文献报道[15-16],表明国内外胃癌中HER-2/neu的扩增情况较为一致。
HER-2/neu的扩增和过表达,可通过磷脂酰肌醇 3-激酶(phosphatidylinositol 3-kinase, PI3K)/蛋 白 激 酶 B(protein kinase B, PKB,又 称 Akt)及丝裂原活化蛋白激酶(mitogen-activated protein kinases, MAPK)途径影响肿瘤细胞的增殖、凋亡、粘附、分化及浸润等[17]。乳腺癌中HER-2/neu的扩增明确与差的病理临床特征相关[13],但在胃癌未见统一的结果。本研究显示,在TCGA数据库和我院样品中,HER-2/neu的扩增与患者的年龄、T、N、M分期及临床分期均不相关,但男性患者HER-2/neu扩增率高于女性;低病理级别胃癌HER-2/neu扩增率显著高于高级别的胃癌,表明HER-2/neu扩增与男性及胃癌高分化程度相关,符合文献报道[18],提示男性、分化较好的胃癌是曲妥珠单抗治疗的主要人群。
HER-2/neu扩增是胃癌重要的预后因素,HER-2/neu扩增患者的5年生存率较非扩增低,是胃癌患者预后的独立检测指标[19];也有文献报道[20],HER-2/neu的扩增与患者总生存时间及无复发生存时间均无关系。我们发现HER-2/neu的扩增情况不能区分患者的总生存时间,表明在综合临床分期、病理分级和靶向HER-2药物使用情况下,HER-2/neu的扩增不能作为判断患者预后的关键因素。是否在特定临床分期、病理分级及治疗手段下,HER-2/neu的扩增能作为胃癌患者预后判断指标,这需要我们进一步的研究。
