蒜头果油对小鼠的急性毒性试验研究*
2018-11-16王四海施蕊陈剑杨宇明王娟
王四海,施蕊,陈剑,杨宇明,王娟
(1.云南省林业科学院 云南珍稀濒特森林植物保护和繁育国家林业局重点实验室,云南森林植物保护与开发利用重点实验室,云南 昆明650201;2.西南林业大学 林学院,云南 昆明650224)
蒜头果(MalaniaoleiferaChun et S.Lee)为铁青树科(Olacaceae)蒜头果属(Malania)唯一的孑遗植物,是中国滇东南与桂西喀斯特山地特有的珍稀物种,现仅零星分布于云南东南部的广南、富宁县和广西西部的石灰岩山区。1980年蒜头果才被正式命名[1],1981年发现种仁油中富含神经酸,其巨大的经济开发价值得到初步认识[2]。蒜头果种仁富含高达51.9%-64.5%的油脂,种仁油中神经酸含量高达40%-67%[2-6]。蒜头果是目前发现含神经酸最高的植物,是最为理想的开发神经酸产品的资源植物[6],有着巨大的经济开发潜力[7]。
蒜头果分布狭域,被广泛认识的时间较短,尽管当地有食用蒜头果种仁油的记载,但使用范围较狭窄,使用量不大[8]。蒜头果种仁富含蒜头果蛋白[9],这种蛋白是一种高毒性植物蛋白[10],在当地也有误食蒜头果种子中毒的事件。蒜头果油和蒜头果蛋白都是从种仁中提取,因此蒜头果油在作为食品和保健品原料的安全性受到关注。为了测试蒜头果油的食用安全性,用昆明种小鼠进行了蒜头果油急性毒性试验,为蒜头果油的利用安全性提供依据。
1 材料与方法
1.1 试验药物和动物
蒜头果油由种仁机械压榨提取。昆明种小鼠适应性饲养结束后,选择状况良好的80只健康小鼠,体重为22.3-25.8g,雌雄各半,采用随机区组设计法分为4组,即:阴性对照组(简称:阴性组)、食用油对照组(简称:食用油组)、低剂量组和高剂量组,每组各20只,雌雄各半,使各组昆明小鼠体重差异不超过单性别小鼠平均体重的20%。昆明小鼠购于北京维通利华实验动物技术有限公司。
1.2 药物与剂量
根据《新资源食品管理办法》和《药物单次给药毒性研究技术指导原则》的要求,结合本供试品特性,阴性组、食用油组和高剂量组均按40mL/(kg·bw)的给药容积于24h内分别给予对应的药液3次,低剂量组则给予2次,使低、高剂量组终剂量分别达81.6g/(kg·bw)和122.4g/(kg·bw)(表1)。第1、2次给药间隔为3h50min至4h,第2、3次给药间隔为3h57min至4h3min。阴性组对照品为饮用水,食用油组对照品为金龙鱼食用调和油。
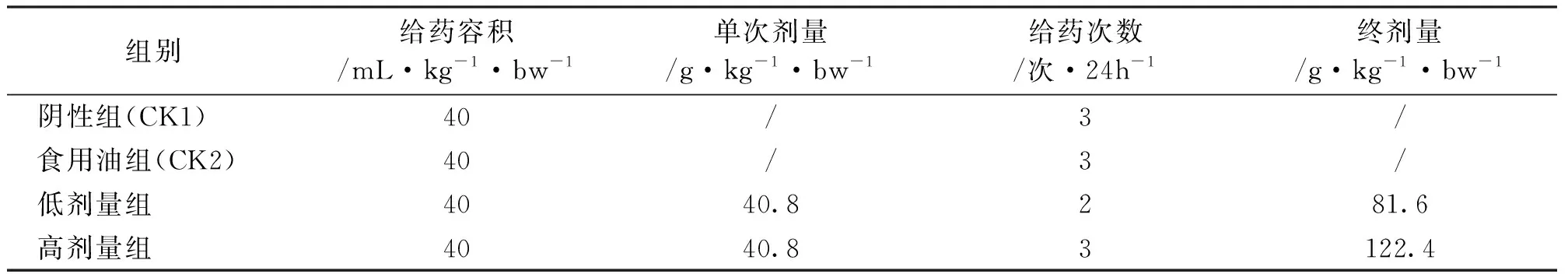
表1 各组剂量设置情况
注:剂量根据25℃时蒜头果油密度1.02g/mL计算。
1.3 指标观察方法
给药当天每次灌胃给药前、后均需观察小鼠一般症状和体征,其中给药后需立即连续观察小鼠反应约2.5h;给药之后每天观察小鼠一般症状和体征1-2次,连续观察14d。观察内容主要包括小鼠饮食、外观、行为、分泌物、排泄物、死亡情况及中毒反应症状及其起始时间、严重程度、持续时间、是否可逆及恢复时间等。
于给药当天给药前及给药后第1d、3d、5d、7d、10d、14d称重,并计算各组小鼠的体重增长幅度。对中途死亡的小鼠及观察期结束后的存活小鼠进行肢体解剖,观察小鼠各组织和器官的体积、颜色、质地等有无异常。把所有试验死亡的小鼠分别与剂量和死亡时间进行相关分析。
1.4 试验地点与数据处理
所有试验委托云南省药物研究所药物安全性评价中心完成。数据分析采用SPSS 17 .0统计软件进行处理。
2 结果与分析
2.1 一般症状和体征表现
阴性组给药当天和给药后连续观察14d,该组小鼠均未见明显异常。食用油组在第一次给药当天和第1d有20只相继出现软便、稀便或油样便,其中有5只(♀1和♂4)活动减少,2只(♀2)出现惊跳反射,1只(♂1)腹部肿胀;给药后第2d至第14d该组所有小鼠基本恢复正常,未见明显异常情况。低剂量组在第一次给药当天和第1d相继有18只(♀10和♂8)出现软便、稀便或油样便,有1只(♂1)在第4d至第8d仍出现油样便、腹部肿胀,第9d恢复正常,有2只(♀1和♂1)小鼠分别在给药后的第6d和第8d死亡,其余17只小鼠在给药后的第2d至第14d未见明显异常。高剂量组在给药后的当天、第1d和第2d相继20只出现软便、稀便或油样便,10只(♀6和♂4)活动减少,4只(♀2和♂2)出现惊跳反射;高剂量组给药后的第1d 1只(♂1)死亡,第2d 3只(♀1和♂2)死亡,第3d 1只(♂1)死亡,其余小鼠在给药后的第3d至第14d基本恢复正常,未见明显异常情况(表2)。所有死亡的小鼠肢体解剖都基本表现为形体消瘦,胃、肠粘膜充血,胃、肠胀气,直肠肠腔不同程度扩张,内有淡黄色质地坚硬的固体物质。
小鼠的死亡数量有明显的剂量-反应和时间-反应关系,其中死亡数量与剂量呈正相关,死亡时间与剂量呈负相关,即随着剂量的升高,小鼠的死亡数增加,且死亡时间提前(图1)。
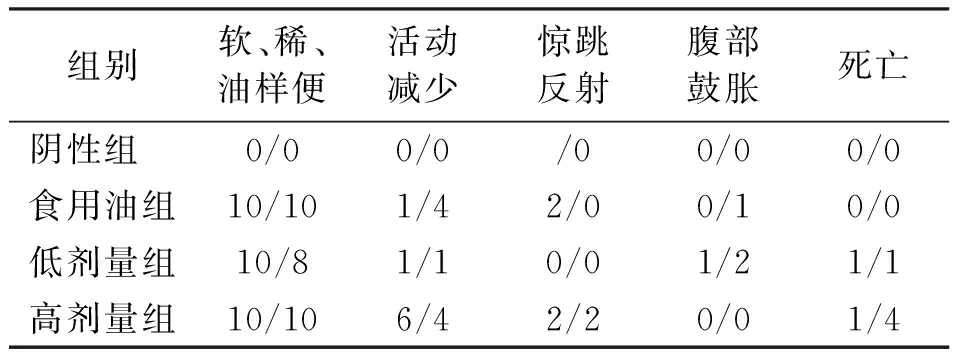
表2 出现异常反应小鼠数量(♀/♂)
注:表中仅为主要的异常反应,且包括整个观察过程中发生上述症状的小鼠。

图1 小鼠死亡数量分别与剂量和天数的相关关系
2.2 体重变化
雌性小鼠个体体重,与阴性组相比较,食用油组在给药后的第1d,体重显著减轻,低剂量组和高剂量组在给药后的第1d和第3d体重显著减轻;与食用油组相比较,低剂量组和高剂量组在给药后的第1d和第3d体重显著减轻(表3)。
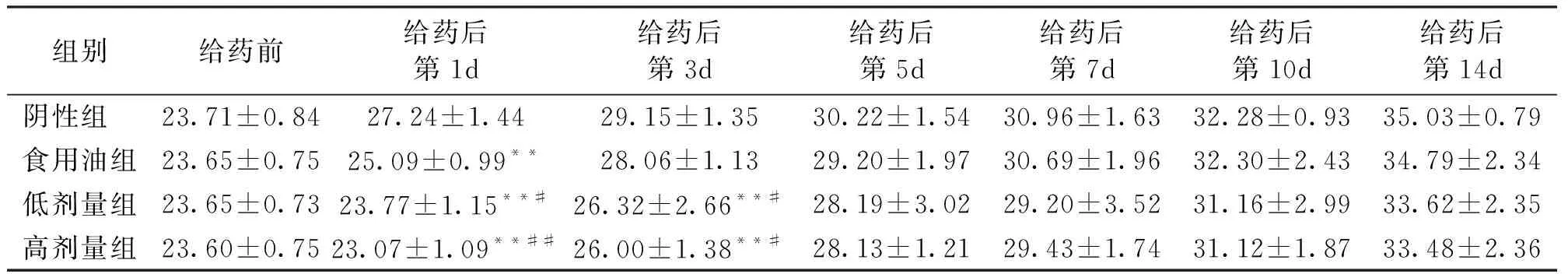
表3 雌性小鼠体重变化
注:表中值为平均值±标准差,**与阴性组比较有显著性差异(P<0.01),#/##与食用油组比较有显著性差异(P<0.05/0.01)。
雄性小鼠个体体重,与阴性组相比较,食用油组在给药后的第1d、第3d、第5d,体重与阴性组有极显著差异,在第7d、第10d有显著差异;低剂量组在给药后的第1d、第3d、第5d,体重与阴性组有极显著差异,在第7d、第10d、第14d有显著差异;高剂量组在给药后的所有天数都与阴性组的重量有极显著性差异。与食用油组相比较,低剂量组体重与其并没有表现出明显的差异性,但与高剂量组在第5d、第7d表现出极显著差异,在第10d、第14d表现出显著差异。雄性小鼠个体体重在高剂量组和低剂量组之间也表现出显著差异(表4)。
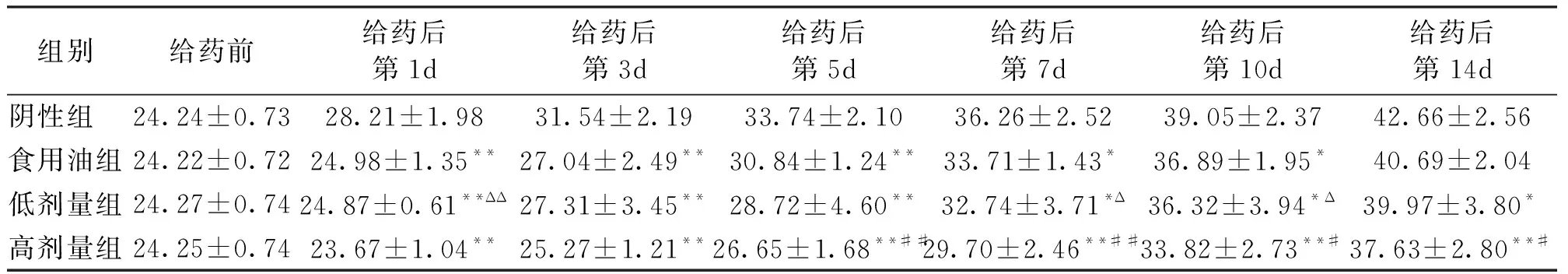
表4 雄性小鼠体重变化
注:表中值为平均值±标准差,*/**与阴性组比较有显著性差异(P<0.05/0.01),#/##与食用油组比较有显著性差异(P<0.05/0.01),Δ/ΔΔ与高剂量组比较有显著性差异(P<0.05/0.01)。
由表5可知,食用油组、低剂量组、高剂量组分别与阴性组比较,雌性小鼠体重增长在给药后第1d均有显著差异(P<0.01),均表现出体重增加缓慢,并且高剂量组为负增长;在给药后的第3d至第14d体重增长虽有差异但并不显著。低剂量组、高剂量组分别与食用油组比较,雌性小鼠体重增长在给药后第1d有显著差异(P<0.01),在给药后的第3d至第14d差异不显著。雌性小鼠体重增加在低剂量组和高剂量组之间始终没有显著性差异(P>0.05)。
由表6可知,雄性小鼠的体重增长在给药后的第1d与阴性组相比较都表现出显著差异(P<0.01),体重增长较慢,高剂量组表现出负增长;但是,在第10d低剂量组和高剂量组雄性小鼠体重增加幅度都高于阴性组,且差异显著(P<0.01)。与食用油组比较,只有高剂量组在第1d表现出体重明显减慢(负增长,P<0.01),在第10d体重增加,又明显大于食用油组(P<0.05)。雌性小鼠低剂量组的体重增加在第1d显著高于高剂量组(P<0.05),但在第10d又显著低于高剂量组(P<0.05)。
给药小鼠的体重增长幅度无论是雌性还是雄性在给药后的第1d都明显减慢,且高剂量组表现出负增长。在第3d至第14d体重增加变快,甚至有些时段体重增加幅度超过阴性组和食用油组,但在整个受试过程中给药小鼠体重总体上都低于阴性组和食用油组。
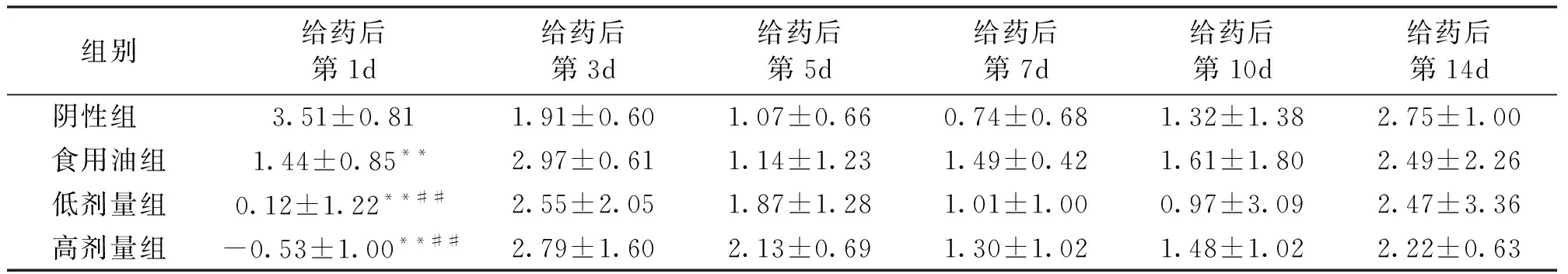
表5 雌性小鼠体重增长幅度
注:表中值为平均值±标准差,**与阴性组比较有显著性差异(P<0.01),##与食用油组比较有显著性差异(P<0.01)。
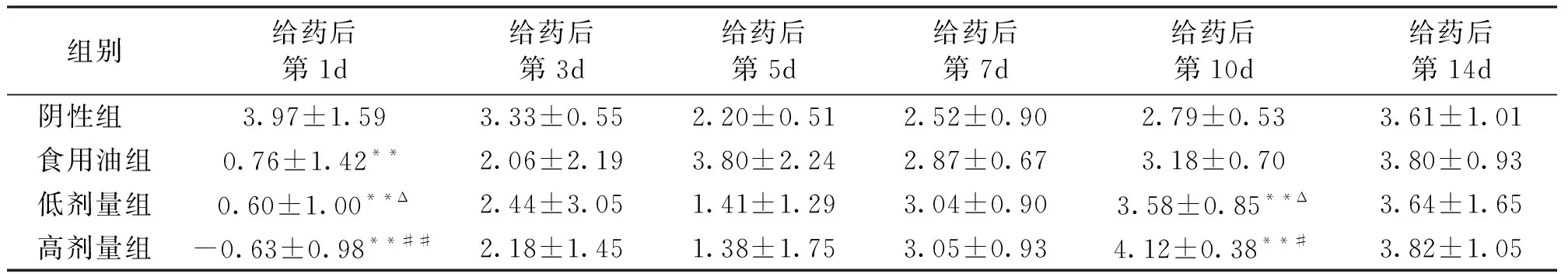
表6 雄性小鼠体重增长幅度
注:表中值为平均值±标准差,**与阴性组比较有显著性差异(P<0.01),#/##与食用油组比较有显著性差异(P<0.05/P<0.01),Δ与高剂量组比较有显著性差异(P<0.05)。
3 结论与讨论
试验期间,小鼠在一般症状、体征方面的异常主要包括软便、稀便和油样便、腹部鼓胀、活动减少、惊跳反射等,上述症状的出现可能主要与胃肠系统、神经系统功能紊乱相关;在粪便性状异常方面,食用油组小鼠出现油样便的时间较早(第1次给药后大部分小鼠开始出现),而蒜头果油各剂量组在第2次、第3次给药后才开始陆续出现,且大部分小鼠以软便或稀便为主,至给药后第2d和第3d,食用油组所有小鼠和高剂量组存活小鼠逐渐恢复正常,而低剂量组3只小鼠逐渐开始出现毒性反应症状,除个别小鼠缓慢恢复外,剩余2只小鼠死亡,其死亡原因与高剂量组中途死亡小鼠一样,可能也与胃肠道功能失调甚至障碍有关;同为油类物质,食用油也可使小鼠出现胃肠道系统功能失调相关症状,但其对胃肠功能的损伤为短暂性,停止药物后小鼠能在短时间内(约48h)恢复正常,而蒜头果油可对个别或少数小鼠神经性系统特别是胃肠系统功能产生程度较为严重的,甚至危及生命的消耗性损伤,最终使小鼠死亡。
根据小鼠肠腔不同程度的扩张,内有颜色和质地类似动物饲料的坚硬固体物质及小鼠出现的一系列胃肠系统症状,推测供试品可能引起小鼠肠壁肌肉运动功能紊乱、障碍,不能有力地推动肠道内容物通畅运行并排出体外,而使肠道内容物迅速或逐渐堆积,最终形成质地坚硬的固体物质堵塞肠道,即供试品可能在使小鼠出现胃肠功能紊乱、障碍后,继发出现类似临床运动障碍性肠梗阻的情况,从而导致小鼠死亡。蒜头果油24h内多次给药可使大多数小鼠出现胃肠系统功能失调相关症状,甚至使少数小鼠死亡,但多数小鼠可于停止给药72h后逐渐恢复正常。
给予食用油和蒜头果油对小鼠的体重均有明显影响,可使小鼠体重下降或增长缓慢,其中以雄性小鼠更为明显;但食用油对小鼠体重的影响明显小于蒜头果油,从给药后第5d开始,食用油组与阴性组雄性小鼠平均体重差距逐渐缩小并趋于相当,而至给药后第14d高剂量组雄性小鼠平均体重仍明显小于阴性组;给药后食用油组平均体重增长幅度虽有所波动,甚至在部分时间点小于给药组,但该组小鼠体重从未出现过负增长,而高剂量组给药后第1d雌、雄小鼠平均体重增长幅度均为负值,表明该组大多数小鼠体重给药后均出现下降。蒜头果油24h内多次给药可使大多数小鼠体重在短时间内下降或出现增长缓慢,其中以雄性小鼠较为明显。
在本实验条件下蒜头果油24h内多次灌胃给予小鼠,其最小致死量(MLD)为81.6g/(kg·bw),相当于神经酸含量为32.6-49.0g/(kg·bw),分别折合成人每日最大用量和小鼠等效剂量的约983和80倍;使用“查表法”[11]大致估算其LD50为126.8g/(kg·bw),相当于神经酸含量为50.7-76.1g/(kg·bw),分别折合成人每日最大用量和小鼠等效剂量的约1 528倍和124倍。蒜头果油具有较宽的安全剂量范围,但若在短时间内大量服用可能会致胃肠系统功能紊乱甚至发生障碍。
