剩余胚胎来源的囊胚冻融移植周期临床结局分析
2018-11-15邹敏李姣邵淑敏胡廉张洁张玲
邹敏,李姣,邵淑敏,胡廉,张洁,张玲*
(1.华中科技大学同济医学院生殖医学中心,武汉 430010;2.华中科技大学同济医学院计划生育研究所/生殖医学中心,武汉 430010)
随着胚胎体外培养系统的逐渐成熟,囊胚培养在辅助生殖技术中应用日益广泛。然而全部胚胎行囊胚培养仍存在无囊胚形成的风险,因此不少生殖中心对新鲜周期D3卵裂期胚胎的处理策略为根据胚胎形态学评分将最优质胚胎进行移植和/或冷冻,然后将剩余的胚胎进行囊胚培养,以筛选出更具发育潜能的胚胎,提高胚胎利用率。临床研究数据已经证明囊胚移植可提高胚胎种植率、临床妊娠率、活产率以及降低早期流产率[1-2]。那么这些剩余胚胎培养形成的囊胚发育能力又如何呢?本研究回顾性分析2015年1月至2017年12月本中心年龄<36岁的患者冻融移植周期临床资料,对比分析剩余胚胎来源的D5、D6囊胚及D3优质卵裂期胚胎的种植率、临床妊娠率、早期流产率,探讨剩余胚胎继续培养所形成的囊胚的发育潜能,同时为冻融移植周期胚胎的选择提供依据。
资料与方法
一、研究对象
2015年1月至2017年12月在华中科技大学同济医学院生殖医学中心进行冻融胚胎移植的患者。
纳入标准:(1)女方年龄<36岁;(2)移植的D3胚胎均为优质胚胎;(3)移植的囊胚符合以下条件:来源于D3移植和/或冷冻了形态学评分最优质胚胎后剩余的正常受精胚胎、D3胚胎卵裂球数≥4,D5或者D6囊胚形成评分≥3CC者。
排除标准:夫妻任何一方染色体异常及女方子宫畸形患者。
共纳入993个冻融移植周期,其中172个周期移植D5囊胚、111个周期移植D6囊胚、710个周期移植D3优质卵裂期胚胎。
二、方法
1.胚胎培养:采用商品化的G-seriesTM培养液(Vitrolife,瑞典)对胚胎进行序贯培养,受精卵置于G-1TMPLUS液滴中培养,至D3移植和/或冷冻质量最优质的胚胎后剩余的≥4细胞的所有正常受精胚胎转至 G-2TMPLUS液滴中培养至D5/D6。
2.胚胎冷冻及复苏:所有胚胎的冷冻及复苏严格按照玻璃化冷冻及复苏试剂盒(KITAZATO,日本)说明书操作,仅在平衡时间及洗涤时间稍作改进。囊胚冷冻前需激光打孔皱缩,除此之外囊胚与D3卵裂期胚胎冷冻及复苏操作步骤均相同。冷冻过程分两步:胚胎于1#平衡液(ES)中平衡6 min;转至2#玻璃化冷冻液(VS)中,快速装杆,该步骤应该在1 min内完成。复苏过程为4步:胚胎于37℃预温的1#解冻液(TS)中迅速复温,该过程在1 min内完成;复温的胚胎先后置于2#稀释液(DS)3 min、3#洗涤液(WS)5 min、4#WS 2 min。
3.胚胎评分标准:(1)根据Peter评分系统对卵裂期胚胎进行评分[3]。Ⅰ级:卵裂球大小均匀,形状规则,透明带完整,胞质均匀,无颗粒现象,碎片<10%;Ⅱ级:卵裂球大小稍不均匀,形状稍不规则,胞质有颗粒现象,碎片在10%~20%之间;Ⅲ级:卵裂球不均匀,形状不规则,胞质有明显颗粒现象,碎片在20%~50%之间;Ⅳ级:卵裂球严重不均匀,形状严重不规则,胞质有严重颗粒现象,碎片>50%。D3优质胚胎为卵裂球数目≥6个的Ⅰ、Ⅱ级胚胎。(2)按照Gardner评分系统对囊胚进行评分[4]。先根据囊胚腔的大小和孵出程度将囊胚分成1~6期,然后对其中3~6期囊胚的内细胞团(ICM)和滋养外胚层(TE)按细胞数目及排列进行评分:A级(细胞数目多,排列紧密)、B级(细胞数目较少,排列松散)、C级(细胞数目极少)。期别≥3期且ICM及TE评分均≥B级的囊胚为优质囊胚;期别≥3期且ICM及TE其中任何一类细胞群评分≥B级的囊胚为可利用囊胚;ICM及TE评分均为C的囊胚或者D6形成的期别<3期者为劣质囊胚。
4.内膜准备方法:(1)自然周期:在月经周期第8~10天起B超监测卵泡和内膜发育情况,当卵泡最大直径≥14 mm监测排卵,LH峰后肌注黄体酮;排卵后3~4 d行卵裂期胚胎移植或排卵后5 d行囊胚移植。(2)人工周期:在月经周期第3天开始使用戊酸雌二醇(Delpharm Lille,法国),10 d后每隔3~5 d行B超监测内膜厚度,当内膜厚度≥8 mm肌注黄体酮,3~4 d后行卵裂期胚胎移植或5 d后行囊胚移植;(3)降调+人工周期:在月经第2天皮下注射短效GnRH激动剂(Ferring,德国),28~30 d测量血清E2及LH水平,判断是否达成降调,B超评估内膜厚度。符合条件者开始人工周期方案。
5.胚胎移植:使用移植管(COOK,美国)及气密注射器(COOK,美国)一段式装管后,超声引导下于子宫腔中后部推出胚胎。
三、观察指标及判定标准
总结分析患者一般资料、助孕过程指标及临床结局。
囊胚形成率:形成的囊胚数/用于囊胚培养的D3卵裂期胚胎数×100%;可利用囊胚率:可利用的囊胚数/形成的囊胚数×100%;种植率:B超显示孕囊个数/移植胚胎个数×100%;临床妊娠率:B超显示有孕囊的移植周期数/移植周期数×100%;早期流产率:早期流产周期数/移植周期数×100%,早期流产为B超显示有孕囊后临床确认胚胎停育或者异位妊娠者。
四、统计学分析
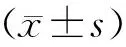
结 果
一、新鲜周期剩余D3胚胎继续培养的囊胚形成情况
基于新鲜周期D3移植和/或冷冻最优质胚胎后剩余胚胎行囊胚培养的囊胚培养策略,本中心2015年1月至2017年12月共有6 562枚D3剩余胚胎用于囊胚培养,囊胚形成率为53.75%(3 527/6 562),可利用率为67.54%(2 382/3 527)。
二、各组患者基本情况比较
根据冻融移植周期中移植胚胎的来源,将患者分为3组:D5囊胚组、D6囊胚组和D3卵裂期胚组。三组间女方年龄、不孕年限、不孕因素、内膜准备方案、子宫内膜厚度及形态等均无统计学差异(P>0.05)(表1)。
表1 三组患者基本情况比较[(-±s),n(%)]
注:组间相互比较,*P<0.05
三、各组临床结局比较
D3移植和/或冷冻最优质胚胎后剩余胚胎行囊胚培养形成的囊胚冻融移植周期的总临床妊娠率为62.54%、种植率为45.51%。
1.三组临床结局比较:D5囊胚、D6囊胚及D3卵裂期胚三组间复苏率、平均移植胚胎个数及早期流产率均无统计学差异(P>0.05);D5囊胚组移植的优质囊胚数显著高于D6囊胚组(P<0.05);D5囊胚组临床妊娠率及种植率显著高于D6囊胚组和D3卵裂期胚组(P<0.05);D6囊胚组临床妊娠率及种植率与D3卵裂期胚组无统计学差异(P>0.05)(表2)。
2.相同质量D5囊胚与D6囊胚移植临床结局比较:均为优质囊胚时,D5囊胚组临床妊娠率及胚胎种植率均显著高于D6囊胚组(P<0.05);当移植的2枚胚胎其中1枚为优质囊胚另外1枚为非优质可利用囊胚(优质+非优质可利用囊胚)时,D5囊胚组种植率显著高于D6囊胚组(P<0.05),而临床妊娠率无统计学差异(P>0.05);均为非优质可利用囊胚时,D5囊胚组临床妊娠率及种植率均高于对应质量的D6囊胚,但无统计学差异(P>0.05);移植的2枚胚胎中至少包含1枚劣质囊胚的情况,数据较少,未做统计学分析(表3)。
表2 三组冻融胚胎移植临床妊娠结局比较[(-±s),n(%)]
注:与D6囊胚组比较,*P<0.05;与其他两组比较,#P<0.05
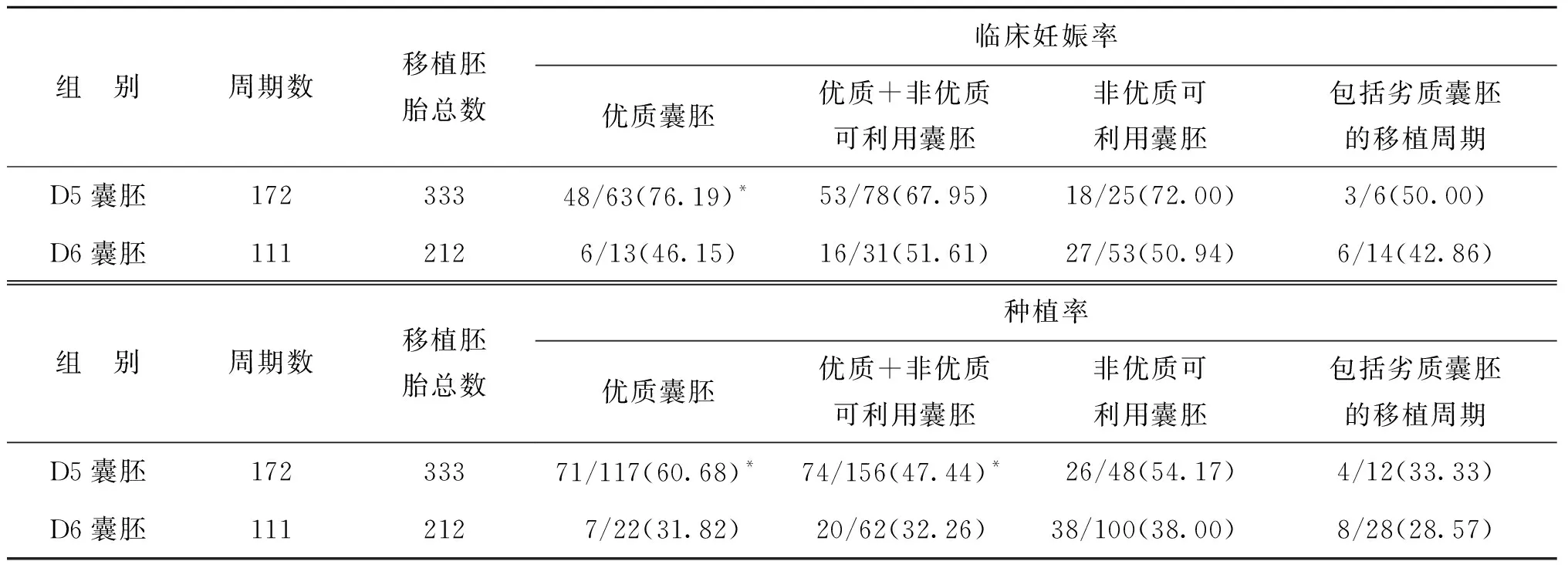
表3 相同质量D5囊胚及D6囊胚移植的临床结局比较[n(%)]
注:与对应质量D6囊胚组比较,*P<0.05
讨 论
目前临床根据D3胚胎形态学评分判断胚胎的发育潜能,然而实践显示形态学指标并不可靠,即使D3非优质胚胎也有可能形成囊胚。囊胚培养是更为可靠的胚胎筛选的手段。Kaartinen等[5]回顾性分析发现,按照标准需要废弃处理的D3劣质胚胎继续培养至囊胚后冷冻,复苏后移植获得24.6%的临床妊娠率及17.2%分娩率。王雅琴等[6]的研究显示D3卵裂球数在3~5个、胚胎碎片在5%~20%的胚胎行囊胚培养,囊胚形成率为33.6%,冻融移植周期临床妊娠率为40.5%。另有研究显示发育迟缓的D3胚胎囊胚形成率低于发育速度正常的D3胚胎,但是其形成的囊胚冻融移植周期临床妊娠率、种植率、孕周数及新生儿体重均与D3发育速度正常的胚胎形成的囊胚无显著差异[7]。因此对于这部分D3形态学评分较差的胚胎,囊胚培养可筛选出具有发育潜能的胚胎,从而避免胚胎的浪费,提高胚胎利用率。本研究结果证实,包括非优质胚胎及D3移植和/或冷冻形态学评分最优质的胚胎后剩余的次优质胚胎的囊胚形成率为53.75%,且67.54%的囊胚为可利用囊胚,极大地提高了胚胎的利用率。
有研究显示剩余胚胎培养所形成的囊胚具有极大的发育潜能,冻融周期其临床结局优于D3优质卵裂期胚胎。Shaw-Jackson等[8]将碎片≥20%、D3发育较慢(<6细胞)、胞浆内出现严重的颗粒现象、存在空泡、透明带异常、D2发育较快(>6细胞)、D2为3个均匀的卵裂球等非优质胚胎进行囊胚培养,发现形成的囊胚在冻融移植周期的临床妊娠率、种植率均高于D3优质卵裂期胚胎。许丽娟等[9]研究结果也显示D3优良胚胎冷冻后剩余的非优良胚胎进行囊胚培养,冻融移植周期D5囊胚临床结局优于D3优良胚胎及D6囊胚。他们用于囊胚培养的非优良胚胎包括细胞数≥4、碎片≤20%的2PN非优良胚胎,D2到D3发育阻滞的胚胎,正常发育的0PN或1PN胚胎。本研究结果与其一致,剩余胚胎形成的囊胚冻融移植周期临床妊娠率为62.54%、种植率为45.51%。其中D5囊胚临床妊娠率及种植率明显高于D3优质卵裂期胚胎和D6囊胚,而D6囊胚临床妊娠率及种植率与D3优质卵裂期胚胎的临床结局相当。
剩余胚胎行囊胚培养获得良好临床结局的原因可能在于:首先,部分发育潜能较差的卵裂期胚胎因不能形成囊胚而在囊胚培养过程中被淘汰;其次,囊胚的染色体正常率高于D3卵裂期胚胎,研究显示卵裂期胚胎中大约70%存在染色体异常的可能[10-11],而囊胚染色体异常率降至约40%[12-13]。D3形态学评分为优质的胚胎也有染色体异常的可能[14],囊胚培养可以筛除一部分异常胚胎;最后,正常生理状态下卵裂期胚胎在输卵管内移动,直到发育至囊胚才进入子宫腔内,因此囊胚移植更符合生理状态,与子宫内膜的同步性更好。因此D3剩余胚胎行囊胚培养一旦形成可利用囊胚,也可获得良好的临床结局。
D5囊胚临床结局优于D6囊胚,推测原因为囊胚发育速度的影响[15-16]。与D5囊胚相比,D6囊胚发育相对滞后,可能意味着胚胎质量更差或者存在异常的可能性更高[17]。本研究纳入的冻融移植周期中D5囊胚组的质量显著优于D6囊胚组,我们为此进一步对比分析了相同质量的D5囊胚与D6囊胚临床结局:优质D5囊胚临床妊娠率及胚胎种植率均明显高于优质D6囊胚;当移植的2枚胚胎其中1枚为优质囊胚另外1枚为非优质可利用囊胚时,D5囊胚种植率明显高于D6囊胚,临床妊娠率则无统计学差异;非优质可利用D5囊胚临床妊娠率及种植率均高于对应质量的D6囊胚,但无统计学差异。与武龙梅等[18]的研究结果一致,他们的研究显示优质D5囊胚临床结局显著优于D6囊胚。而谭巧等[19]的研究结果则显示冻融移植周期优质D5囊胚与优质D6囊胚临床结局无显著差异,非优质D5囊胚临床结局优于对应质量的D6囊胚。虽然不同的研究得到的结果不完全一致(可能与研究数据均偏少有关),但是所有的研究均显示D5囊胚临床结局优于D6囊胚,仅仅具体到不同质量时有些质量的D5囊胚临床妊娠率和/或种植率稍高于D6囊胚而无显著性差别。
综上所述,新鲜周期D3移植和/或冷冻后剩余的胚胎继续培养,可获得良好的囊胚形成率;所形成的囊胚在冻融移植周期中也可获得良好的妊娠结局;D5形成的囊胚具有更高的发育潜力,复苏时可优先选择,以便患者在最少的移植周期获得临床妊娠。
