攀枝花车前草中总黄酮的提取及其含量
2018-11-15晏子俊张良明陈彦清徐兴梦
晏子俊 张良明 陈彦清 袁 野 徐兴梦
(1 攀枝花市中心医院药学部,攀枝花,617067; 2 攀枝花市中心医院检验科,攀枝花,617067)
车前草(PlantagoasiaticaL.)为车前科多年草本植物车前的干燥全草,味甘而性寒,其作为常用的一味中药,最早记载于《神农本草经》并被列为上品[1]。车前草的化学有效成分主要包括挥发油、三萜及其苷类和黄酮类等[2-6],其黄酮类成分具有降血脂[7]、降血压[8]、降血尿酸[9]、抗炎[10]、抗氧化[11]、止咳[12]、杀虫[13]和清热利尿[14]等药理作用,近年来陈兰英等[14]通过探讨车前草对肾小球肾炎大鼠的保护作用机制,进一步得出车前草对肾小球肾炎大鼠的保护作用可能与消除氧自由基,避免脂质过氧化,减少肾小球纤维化相关;彭璇和李玉山[15]则探讨了车前草总黄酮治疗泌尿系结石可能的作用机制,并得出车前草治疗泌尿系结石的机制之一可能是其利尿兼促排作用。目前车前草的相关研究报道虽已很多,如有效成分[5-6,12,16]、提取[1,4]、药理活性[14-15,17]等方面的研究,但尚未见针对攀枝花车前草内总黄酮提取及其含量测定的相关报道。本实验选用超声波提取法,以芦丁作为对照品,采用紫外分光光度法分别测定并比较车前草叶、根内总黄酮的含量,为攀枝花车前草的合理应用提供依据。
1 仪器与试药
1.1 仪器 微型高速万能试样粉粹机(湖北省黄骅新兴电器厂);UV-VIS3150型紫外-可见分光光度计(日本岛津公司);T6新世纪紫外分光光度仪(北京普析通用仪器有限责任公司);KQ 2200 B型超声波清洗器(昆山市超声仪器有限公司);101-2B型恒温干燥箱(上海沪南电炉烘箱厂);SHZ-88-水浴恒温振荡器(金坛市国旺实验仪器厂);Milli-Q超纯水系统(美国Millipore公司);AB 204 s型电子分析天平(瑞士Mettler Toledo仪器公司)。
1.2 试剂 车前草(采自攀枝花仁和区);芦丁标准品(中国药品生物制品检定所);石油醚(分析纯,成都格雷西亚化学技术有限公司);亚硝酸钠(分析纯,成都格雷西亚化学技术有限公司);硝酸铝(分析纯,成都格雷西亚化学技术有限公司);氢氧化钠(分析纯,成都格雷西亚化学技术有限公司);95%乙醇(分析纯,成都市科龙化工试剂厂);蒸馏水(自制);其他试剂均为分析纯。
1.3 分析样品 参照文献[18]报道的研究方法。挖取新鲜车前草叶、根,洗净后于阳光下晾晒备用,分离出叶、根,烘箱内烘干后,置于粉碎机中粉碎。取一定量车前草粉末加入乙醇中浸泡,于恒温下振荡、减压、抽滤后,将提取液用石油醚萃取3次。将萃取液置于恒温水浴锅中浓缩,冷却至室温后,转移至容量中,定容,即得。
2 方法与结果
2.1 色谱条件 UV-VIS3150型紫外-可见分光光度计,紫外检测波长为510 nm,测定量为1.5 mL。
2.2 对照品溶液的制备 精密称取10.00 mg芦丁标准品至小烧杯内,加入适量60%乙醇溶液使其溶解后,转移到100 mL容量瓶内,用60%乙醇溶液稀释并定容至刻度,即得0.10 mg/mL的芦丁标准溶液。
2.3 供试品溶液的制备 精密吸取车前草样品液2 mL,置于10 mL的容量瓶后,加入70%乙醇溶液定容,即得供试品溶液。
2.4 专属性试验 将配好的芦丁标准溶液、供试品溶液各1 mL,按标准曲线项下的方法,以试剂空白为参比液,在450~600 nm范围内扫描,结果在510 nm波长处两者均有最大吸收。
2.5 线性关系考察 分别吸取0.00 mL、0.50 mL、1.00 mL、2.00 mL、3.00 mL、4.00 mL、5.00 mL的芦丁标准溶液(0.10 mg/mL)至25 mL容量瓶内,加入5%的亚硝酸钠0.70 mL,摇匀,静置6 min后,加入10%硝酸铝0.7 mL,摇匀,静置6 min后,再加入1 mol/L的氢氧化钠5 mL,摇匀,60%乙醇溶液溶剂定容至刻度,摇匀,静置12 min后,以试剂空白为参比液,在510 nm波长处比色测定各样品液吸光度(A)。以吸光度为纵坐标,以浓度为横坐标,绘制标准曲线(图1),经线性回归,得回归方程为:A=4.932 8C+0.005 2,r=0.999 9(n=7)。结果表明浓度在0~50 μg/mL范围时,与吸光度呈良好的线性关系。
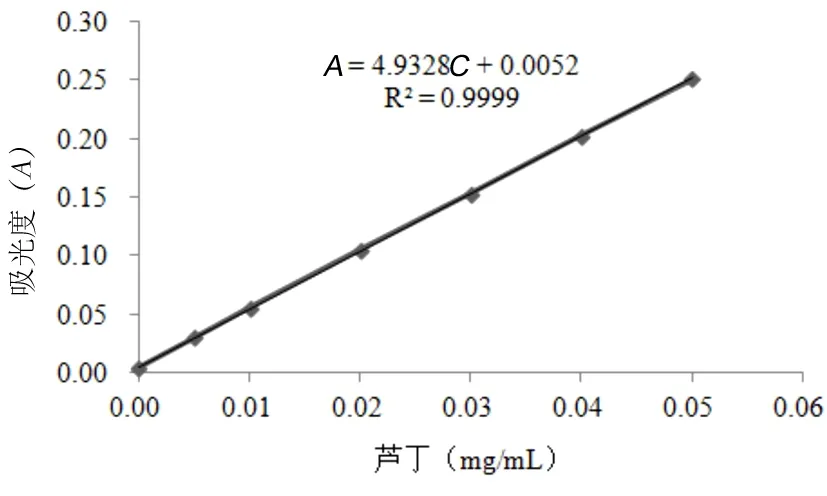
图1 芦丁标准曲线
2.6 中间精密度试验 取对照品溶液于510 nm处测定吸光度,于1 d内测定6次,得到日内精密度RSD值为0.36%(n=6),试验结果表明该测定方法的日内精密度良好。相同条件下,每日测定1次,连续测定5 d,得到日间精密度RSD值为0.75%(n=5),试验结果表明测定方法的日间精密度良好。
2.7 供试品溶液稳定性试验 取供试品溶液,分别于0 h、1 h、2 h、4 h、6 h、8 h、12 h、24 h在510 nm处测定其吸光度,其RSD为0.68℅(n=6)。试验结果表明该溶液稳定性良好,能满足测定的需要。
2.8 重复性试验 精密量取6份样品乙提取液,按标准曲线项下的方法,于510 nm处测定其吸光度,得到RSD值为0.84%(n=6),表明该方法的重现性好,符合分析测定要求。
2.9 回收率试验 分别取9份1 mL已知总黄酮浓度的车前草根、叶样品液,分别加入一定量芦丁标准溶液后,按标准曲线下的方法,于510 nm处测定其吸光度,代入回归方程计算回收率,车前草根和叶的平均回收率分别为98.95%和99.55,RSD分别为0.86%和0.53%。见表1、表2。

表1 车前草根的回收率
2.10 提取工艺的单因素试验
2.10.1 浸泡时间对黄酮提取的影响 以不同的浸泡时间(12 h、24 h、36 h)作为影响因素,测定其一定的稀释液吸光度,以吸光度为纵坐标,浸泡时间为横坐标得到趋势图。见图2。
浸泡24 h与浸泡12 h比较,浸泡24 h可明显提高车前草总黄酮的提取率,但当浸泡时间为36 h时,并未提高总黄酮提取率,反而有下降的趋势。因此,若仅考虑提取车前草中总黄酮的最佳浸泡时间应为24 h。

表2 车前草叶的回收率

图2 浸泡时间对黄酮提取的影响
2.10.2 溶剂系统对黄酮提取的影响 以不同的溶剂系统(乙醇浓度为55%、60%、65%、70%、75%、80%)作为影响因素,测定其一定的稀释液吸光度,以吸光度为纵坐标,乙醇浓度为横坐标得到趋势图。见图3。

图3 乙醇浓度对黄酮提取的影响
乙醇浓度为55%~70%时,车前草中总黄酮的提取率随乙醇浓度增高逐渐升高,而乙醇浓度为70%~80%时,总黄酮的提取率逐渐下降。因此,若仅考虑提取车前草中总黄酮的最佳乙醇浓度应为70%。
2.10.3 超声时间对黄酮提取的影响 以不同的超声时间(5 min、15 min、25 min、35 min)作为影响因素,测定其一定的稀释液吸光度,以吸光度为纵坐标,超声时间为横坐标得到趋势图。见图4。
超声时间在5 min、15 min、25 min、35 min处理下,25 min处理时更利于车前草中总黄酮的提取,而35 min时总黄酮提取率反而有所下降,可能原因是由于随着时间的延长,黄酮类化合物易被氧化,而导致提取率下降。因此,若仅考虑提取车前草中总黄酮的最佳超声时间应为25 min。

图4 超声时间对黄酮提取的影响
2.11 提取工艺的正交试验 上述分别讨论了各单因素对总黄酮提取率的影响,但实际操作中,各因素则是相互影响。为综合考查影响因素,本试验设计了以乙醇浓度、浸泡时间、超声时间等3个因素,每个因素取3水平[19]。见表3。L9(33)正交试验结果见表4。
影响提取车前草中总黄酮的3个因素(乙醇浓度、浸泡时间、超声时间)中,乙醇浓度的影响最大,各因素的影响顺序为:乙醇浓度>超声时间>浸泡时间。最佳提取条件是A3B2C3,即溶剂系统70%乙醇,浸泡时间36 h,超声时间35 min,其结果与单因素试验的考察结果有所差异。
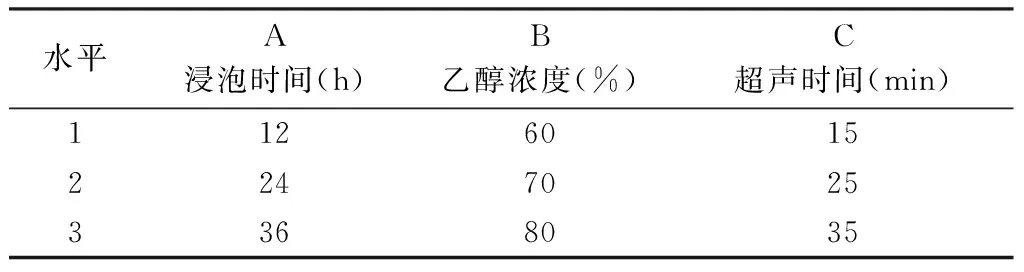
表3 正交试验各水平因素
2.12 提取物定性分析
2.12.1 紫外光谱分析 黄酮类化合物具有C6-C3-C6基本结构,故大多数黄酮类化合物在240~400 nm有2个紫外光谱吸收峰,分别在320~380 nm(光谱带I:B环取代基性质决定的)、240~270 nm(光谱带Ⅱ:环取代基性质决定的)2个区域出现;而芦丁标准溶液经过亚硝酸钠、硝酸铝和氢氧化钠处理后,光谱带I、带Ⅱ分别转移到450~510 nm、415~470 nm处,车前草提取的样品液图谱在510 nm左右的吸收峰基本与其相似[18]。见图5。

表4 车前草中总黄酮提取正交试验结果

图5 芦丁标准品和车前草提取物的紫外吸收光谱
2.12.2 显色反应 黄酮类化合物的碳架含有碱性氧原子,且大部分是酚性羟基衍生物,故其能与某些较强还原剂发生颜色反应、与某些金属离子发生络合反应[1]。故黄酮类化合物可进行如下定性鉴定:1)紫外显色反应:车前草提取液点在滤纸上,可见光下为灰黄色,紫外光下为灰褐色荧光斑点;2)浓氨水反应:车前草提取液点在滤纸上,置于氨水上方30 s后,紫外光下为极明显的黄褐色荧光斑点。3)三氯化铝反应:车前草提取液点在滤纸上,滴入1%三氯化铝乙醇溶液,吹干,可见光下为灰黄色,紫外光下为黄色荧光斑点。4)乙酸镁反应:方法同“3)三氯化铝反应”,但滴入1%乙酸镁甲醇溶液,紫外光下为黄色斑点。5)盐酸-镁粉反应:取1 mL车前草提取液置于试管内,加入适量镁粉、数滴浓盐酸后,泡沫处变为紫红色。
2.13 样品测定结果
2.13.1 车前草根、叶中总黄酮含量的测定 在最优条件下即70%乙醇浸泡36 h,超声时间35 min,对车前草叶、根进行总黄酮提取,于平行操作条件下分别测定其吸光度,代入回归方程,计算出其质量浓度。车前草叶、根总黄酮含量有差异,其中车前草根中总黄酮含量大于叶中总黄酮含量。见表5。

表5 车前草根、叶总黄酮含量
2.13.2 车前草中总黄酮含量的测定 精密吸取车前草样品液2 mL,置于10 mL的容量瓶后,按标准曲线下的方法,于510 nm处测定其吸光度,A=0.232,代入回归方程:A=4.932 8C+0.005 2,r=0.999 9(n=7),计算得到车前草样品中总黄酮的含量为1.54%。
3 讨论
车前草来源广泛,价格相对较低,不良反应也较小,是一种非常有前景的中草药,其黄酮类成分具有诸多药理活性作用[20],李明娟等[20]的进一步研究则表明,车前草中黄酮类各化合物的药理活性具有差异,故其黄酮类化合物的提取工艺、含量测定方法尤为重要,既要保证药效,也要有利于质量控制。
目前,国内外研究报道中草药中总黄酮类成分的提取方法主要有醇提法[8]、微波提取法[21]、双水相萃取分离法[22]、超临界流体提取法[22]、超声波乙醇浸提法[18]等,各提取方法均有其优缺点。而前期的预实验中发现,在提取攀枝花车前草中总黄酮时,超声波乙浸提法能最大限度提取到黄酮类成分,并且不破坏提取液样品中的黄酮类成分,原因可能是乙醇作为溶剂的同时,超声波可加快中草药中黄酮类成分进入乙醇溶剂,减少提取时间,增加了黄酮类成分的提取率,而且该方法还避免了高温对黄酮类成分的影响,即减少了对黄酮类成分的破坏。故参考预实验结果及相关研究报道[18,23],本试验选用超声波乙醇浸提法作为车前草中总黄酮的提取方法。
中草药中黄酮类成分的含量测定方法主要有紫外分光光度法[1,18]、一阶导数分光光度法[6]和高效液相色谱法[20]等。本试验选用了经典的紫外分光光度法测定黄酮类成分,方法学验证结果表明,该方法精密度和回收率均符合测定要求,并且该方法简单易行,测定结果准确可靠,可用于攀枝花车前草中总黄酮的质量控制。
本试验结果表明,正交试验得到车前草总黄酮的最优提取条件即70%乙醇浸泡36 h,超声时间35 min,测得攀枝花车前草内总黄酮的含量为1.54%,车前草根和叶的平均回收率分别为98.95%和98.18%。同一条件下,测得车前草根中总黄酮含量大于车前草叶中总黄酮含量,该结果与赵春[24]报道的研究结果一致。
总之,本试验用超声波乙醇浸提法首次对攀枝花车前草中总黄酮进行了提取,以芦丁作为对照品,采用紫外分光光度法测定了总黄酮的含量,具有一定的前瞻性,也为攀枝花车前草的进一步开发和研究奠定了基础。
