穿山龙水提物调控Keap1/Nrf2通路抗CCl4诱导小鼠急性肝损伤作用研究
2018-11-15刘利平陶旭锋许丽娜
刘利平 陶旭锋 韩 旭 许丽娜
(1 大连医科大学附属第一医院,大连,116011; 2 大连医科大学药学院,大连,116044)
近年来,肝脏疾病已经成为影响人类健康的最常见疾病之一,寻找有效的防治药物来应对因各种原因所致的肝损伤,也成为目前研究的热点。本研究中采用的四氯化碳(Carbon Tetrachloride,CCl4)诱导肝损伤模型是经典的急性肝损伤模型,并广泛用于保肝药物的筛选。穿山龙(DioscoreaNipponicaMakino),别名穿山薯蓣,为多年生缠绕草质藤本,其根茎是一种重要的中药材,具有舒筋活络、止咳化痰、祛风止痛等功效。本研究的目是评价穿山龙水提物对小鼠CCl4急性肝损伤的保护作用及其分子机制,为该天然产物的深入研究和开发提供实验依据。
1 材料与方法
1.1 材料
1.1.1 动物 昆明小鼠,体重(18~22)g,雄性,由大连医科大学实验动物中心提供,合格证号:SCXK(辽)2013-0003。
1.1.2 药物 穿山龙药材(购于云南千草源药业有限公司);水飞蓟素和羧甲基纤维素钠(CMC-Na)(购于Sigma公司)。
1.1.3 试剂与仪器 DAPI、Tris、SDS(购于Sigma公司);谷胱甘肽过氧化物酶(GSH-Px)、谷胱甘肽(GSH)、丙二醛(MDA)、超氧化物歧化酶(SOD)检测试剂盒(均购于南京建成生物工程研究所);谷胱甘肽巯基转移酶(GST)、Kelch样环氧氯丙烷相关蛋白-1(Keap1)、醌氧化还原酶-1(NQO1)、核因子E2相关因子2(Nrf2)、SOD1、SOD2、血红蛋白加氧酶-1(HO-1)、甘油醛-3-磷酸脱氢酶(GAPDH)一抗及二抗(均购于武汉三鹰生物技术有限公司);iNOS引物[购于英潍捷基(上海)贸易有限公司]。
AL104电子天平(METTLER TOLEDO,上海);98-1-B型电子调温电热套(天津市泰斯特仪器有限公司);R-501旋转蒸发仪(上海科升仪器有限公司);U-3010紫外可见分光光度计(HITACHI,日本);DYY-6C型电泳仪(北京市六一仪器厂);美国UVP凝胶成像系统(BioSpectrum系列,美国);7500实时定量PCR仪(Applied Biosystems,美国)。
1.2 方法
1.2.1 分组与模型制备 小鼠随机分为对照组(Control)、模型组(Model)、AEDN低剂量组、中剂量组、高剂量组和水飞蓟素阳性对照组,每组10只。小鼠第7天灌胃2 h后,对照组腹腔注射橄榄油,其余各组腹腔注射0.35% CCl4橄榄油溶液建立急性肝损伤模型。
1.2.2 药物提取方法 取穿山龙药材500 g,加入4 000 mL的水,于电热套中加热回流提取。大火煮沸,转小火煮约2 h,药液趁热过滤,滤液备用。以上实验过程重复4次,共制得滤液约15 000 mL。滤液用旋转蒸发仪反复蒸掉水分后,加入约4 200 mL 95%乙醇溶液,混匀,静置24 h。沉淀进一步旋蒸、浓缩后,于真空干燥器中干燥数天成粉末,即为穿山龙水提物(AEDN),用小型粉碎机磨成粉末状备用。
1.2.3 多糖含量测量方法 采用紫外-可见分光光度法对AEDN中多糖的含量进行测定。首先配制梯度浓度10~200 μg/mL的葡萄糖溶液作为标准品,加入20%苯酚溶液和4 mL浓硫酸显色,以空白试剂作参比,在490 nm处测A值,以吸光度A对葡萄糖标准品浓度C进行线性回归。配制浓度为150 μg/mL的AEDN样品,同法重复测定3次其吸光度值,标准曲线法计算穿山龙多糖含量。
1.2.4 给药方法 称取适量的AEDN和水飞蓟素,溶于0.5% CMC-Na溶液,研磨均匀后用于小鼠灌胃给药。对照组和模型组小鼠灌胃给予0.5% CMC-Na溶液,AEDN低、中、高剂量组小鼠按50 mg/kg、100 mg/kg和200 mg/kg灌胃给予AEDN,水飞蓟素阳性对照组按250 mg/kg灌胃给予水飞蓟素,连续灌胃给药7 d,实验期间各组小鼠正常进食、进水。
1.2.5 检测指标与方法 1)小鼠造模24 h后处死,解剖取肝脏。分别称取各小鼠的肝组织100 mg加入0.9%NaCl溶液匀浆,10 000 r/min离心10 min,取上清液4 ℃冷藏备用。按照试剂盒操作说明书,肝组织匀浆上清液测定其MDA、SOD、GSH和GSH-Px的水平,余下肝组织保存于-80 ℃冰箱。2)采用Western blot法测定各组小鼠肝组织中Keap1、Nrf2、SOD1、SOD2、GST、HO-1和NQO1蛋白的表达。称取于-80 ℃保存的肝组织100 mg,于装有1 mL预冷的RIPA裂解液的EP管中,用组织匀浆机制备肝组织匀浆。待肝组织充分裂解后,10 000 r/min 4 ℃离心10 min,取上清液即为肝组织总蛋白。以BCA蛋白浓度检测试剂盒测定各样本中的蛋白浓度。组织总蛋白稀释至10 μg/μL,与2×loading buffer(100 μl+4 μl β-巯基乙醇)按体积比1∶1混匀,煮沸5 min变性。取50 μg变性后的总蛋白上样,采用聚丙烯酰胺凝胶电泳(SDS-PAGE)在120V恒压下电泳,直至溴酚蓝到达胶底部,停止电泳。按湿法转膜将PVDF膜在甲醇中浸泡10 s后,将其和滤纸、凝胶一同放入转移缓冲液中浸泡后一起放入转膜器,冰水浴中,300 mA恒流转膜2~3 h。将载有目标蛋白质的PVDF膜放入5%脱脂奶粉中,摇床上室温封闭3 h。将PVDF膜放入目的蛋白相应的一抗中,4 ℃孵育过夜。取出膜后,以TTBS洗膜3次,10 min/次,再将膜放入二抗中,室温下摇床孵育2 h,TTBS洗膜3次,10 min/次。ECL试剂盒显色,采用动态积分模式进行拍照并用Gel-Pro 4.0软件对蛋白条带进行灰度分析。以GAPDH为内参蛋白,计算Keap1、Nrf2、SOD1、SOD2、GST、HO-1和NQO1的相对表达量。3)采用Real-time PCR法测定各组小鼠肝组织中iNOS mRNA的水平。称取肝组织100 mg,按试剂盒规定方法提取总RNA,以分光光度法测定其浓度后,将总RNA溶液稀释成0.5 μg/μL后按照试剂盒说明书进行逆转录,获得的cDNA保存于-20 ℃冰箱。引物由英潍捷基(上海)贸易有限公司设计和合成,序列见表1。按照试剂盒操作说明进行Real-time PCR反应。以GAPDH基因作为管家基因,用2-△△Ct法分析肝组织iNOS基因的相对表达。

表1 小鼠相关引物序列
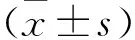
2 结果
2.1 穿山龙水提物的提取率及多糖含量的测定 本实验采用水提取醇沉淀的方法,2 000 g的穿山龙药材共制得192.83 g穿山龙水提物,提取率为19.64%。紫外可见分光光度法测定AEDN中多糖的含量为(53.03±0.70)%。
2.2 AEDN对CCl4诱导肝损伤小鼠肝组织氧化应激指标的影响 本研究测定了AEDN对CCl4诱导小鼠急性肝损伤肝组织中MDA、SOD、GSH和GSH-Px含量的影响,结果如图1所示。小鼠接受CCl4干预后,肝组织损伤导致其中MDA含量显著上升,SOD、GSH和GSH-Px的含量显著下降。给予AEDN(200 mg/kg)后,肝组织中MDA的含量降低(0.70±0.08 nmol/mg protein),差异有统计学意义(P<0.01);SOD、GSH和GSH-Px的含量升高,分别升高至(21.15±2.16)U/mg protein、(8.53±1.04)mg/g protein和(73.34±12.21)U,差异有统计学意义(P<0.01)。

图1 AEDN对CCl4作用下的小鼠肝组织生化指标的影响
注:与对照组比较,**P<0.01;与模型组比较,△P<0.05,△△P<0.01

图2 AEDN对CCl4诱导肝损伤小鼠Keap1和Nrf2蛋白表达的影响
注:与对照组比较,*P<0.05,**P<0.01;与模型组比较,△P<0.05,△△P<0.01
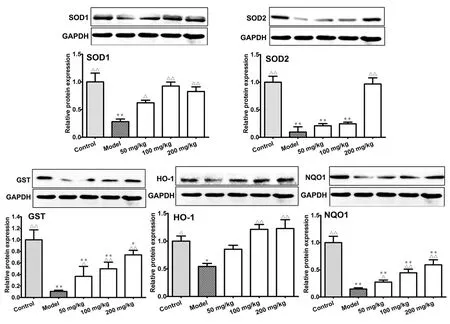
图3 AEDN对CCl4诱导下肝损伤小鼠氧化应激信号通路蛋白表达的影响
注:与对照组比较,*P<0.05,**P<0.01;与模型组比较,△P<0.05,△△P<0.01
2.3 AEDN对CCl4诱导小鼠肝损伤Keap1/Nrf2信号通路蛋白的影响 本研究采用Western blot法测定了AEDN对小鼠肝损伤氧化应激信号通路蛋白的影响。如图2所示,模型组中的Keap1蛋白表达升高,差异有统计学意义(P<0.01)、Nrf2蛋白表达下降,差异有统计学意义(P<0.01),给予AEDN(200 mg/kg)后,Keap1蛋白表达显著降低,差异有统计学意义(P<0.01),Nrf2蛋白表达升高,差异有统计学意义(P<0.05)。同时,AEDN能够显著上调SOD1、SOD2、GST和NQO1蛋白的表达水平,差异有统计学意义(P<0.01)。见图3。
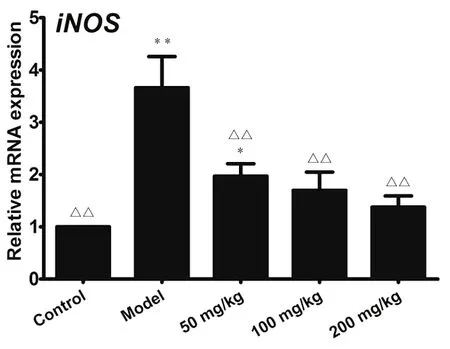
图4 AEDN对CCl4诱导肝损伤小鼠肝组织iNOS水平的影响
注:与对照组比较,*P<0.05,**P<0.01;与模型组比较,△△P<0.01
2.4 AEDN对CCl4诱导小鼠肝损伤iNOS的影响 本研究采用了Real-time PCR法测定肝组织iNOS的水平,结果如图4所示,与对照组比较,模型组中iNOS水平显著上调,AEDN 3个剂量均能显著降低肝组织中iNOS mRNA的表达水平,差异有统计学意义(P<0.01)。
图5 苯酚-硫酸显色法的紫外-可见光扫描光谱图
注:A葡萄糖对照品,B穿山龙水提物
3 讨论
AEDN中含有多糖、水、蛋白质和各种盐类等,但因本研究采用了水提醇沉法进行了初步除杂,因此水提物中的主要成分为多糖。图5是葡萄糖对照品和AEDN样品经苯酚-硫酸显色法显色后,进行紫外-可见光扫描的光谱图。由图可以看出,AEDN的紫外扫描图与葡萄糖标准品相似,且最大吸收波长均在490 nm处。因此,AEDN经苯酚-硫酸法显色后,以490 nm作为检测波长。
近年来随着对CC14诱导的急性肝损伤的分子作用机制不断深入和广泛的研究,发现氧化应激是药物对其发挥保肝作用主要分子机制之一[1]。MDA是脂质过氧化的终末降解产物,可与胞质、膜蛋白或某些酶结合成聚合体,损害细胞膜结构,引起肝细胞变性、坏死[2]。急性肝损伤时,肝组织缺血缺氧,脂质过氧化作用增强,MDA水平升高[3]。SOD是由金属辅酶和蛋白质构成的金属酶,SOD1是SOD的最主要亚型,具有抗氧化、抗炎、抗衰老和维护基因组DNA的稳定等功能,同时通过其催化产物H2O2参与调节细胞的生长代谢[4]。SOD2易受促炎性因子、辐射、氧化应激等因素的诱导,继而大量表达,维持线粒体内氧自由基的动态平衡,减轻氧化应激损伤[5]。SOD能特异地与超氧化物阴离子(O-2)发生歧化反应,清除O-2,保护机体不受自由基损害。GSH-Px是机体内广泛存在的一种重要的过氧化物分解酶,特异地催化GSH对过氧化物的还原反应,能清除过氧化物代谢产物,阻断脂质过氧化链锁反应,从而起到保护细胞膜结构和功能完整的作用。本研究中AEDN降低了肝组织中MDA水平、升高肝组织中SOD、GSH和GSH-Px含量,缓解了急性肝损伤时的氧化应激反应。
为进一步探讨AEDN抗急性肝损伤作用,我们对其作用的分子机制进行了深入研究。在对氧化应激过程中,Keap1/Nrf2是一条重要的调控通路。Keap1是Kelch家族中的一种阻逷蛋白,正常状态下存在于胞质的肌动蛋白细胞骨架上,是Nrf2的负性调节蛋白[6]。Nrf2属于Cap-n-Collar(CNC)调节蛋白家族,是细胞抗氧化应激中的关键转录因子,在生理状态下与胞质中的Keap1结合处于非活性状态。当机体受到其他亲核试剂刺激或处于氧化应激状态时,Nrf2与Keap1解离,Nrf2磷酸化后转入细胞核与抗氧化反应元件(ARE)结合,启动ARE调控的下游Ⅱ相代谢酶及抗氧化蛋白基因的表达,提高机体的抗氧化应激能力[7]。本研究发现AEDN能显著下调肝损伤后肝组织Keap1的蛋白表达,上调Nrf2的蛋白表达。
HO-1、NQO1、GST等是Nrf2下游调控的重要靶蛋白,肝损伤时NQO1、HO-1的表达降低,与Nrf2呈正相关性[8-10]。GST为一种不含硒的GSH-Px,是体内最重要的Ⅱ相代谢酶之一,可保护DNA和蛋白质免受损害,达到解毒目的。GST在肝小叶中分布均匀,且分子量较小,在肝损伤后能快速、特异性的反应肝细胞的损伤状态[11]。血红蛋白加氧酶(HO)是血红蛋白分解代谢的限速酶,HO-1是HO的氧应激诱导型,在急性肝损伤中可被诱导大量表达,一方面通过血红蛋白的3种酶解产物,清除自由基,抗氧化;另一方面,减轻脂质过氧化,降低含半胱氨酸的天冬氨酸蛋白水解酶-3(Caspase-3)活性和TNF-α水平,抗细胞凋亡、抗炎,发挥保肝护肝作用[12]。在CC14诱导的急性肝损伤中,HO-1 mRNA的表达下调[13]。NQO1是一种黄素蛋白酶,能以NAD(P)H为电子供体,还原醌类及其衍生物,并使其毒性降低,保护机体的氧化应激损伤,作为Ⅱ相代谢酶之一,在机体的解毒代谢中发挥重要作用[14]。本研究发现AEDN能上调肝损伤后肝组织中SOD1、SOD2、HO-1、NQO1、GST蛋白的表达。
iNOS为一氧化氮合酶(NOS)的诱导型,是产生NO的限速酶。生理状态下NO有一定的保护肝脏的作用,病理状态下,激活后的iNOS产生大量的NO,高浓度NO可引起肝脏损伤,其机制一方面与NO自身的细胞毒性有关,另一方面与NO激活中性粒细胞的粘附作用和氧化应激等有关[15-16]。AEDN显著下调肝损伤所致iNOS mRNA水平的异常增高,缓解氧化应激。
本研究发现AEDN能够显著下调肝组织中MDA水平、iNOS mRNA表达水平和Keap1的蛋白表达,显著上调GSH、GSH-Px、SOD、SOD1、SOD2、HO-1、NQO1、GST和Nrf2的蛋白表达水平。以上结果表明AEDN具有较好的抗CCl4诱导的急性肝损伤作用,这种作用可能是通过调控Keap1/Nrf2信号通路降低氧化应激损伤作用实现的。
