丹参酚酸B调节缺氧损伤乳鼠心肌细胞TLR4-NFκB-TNFα炎性反应通路的量效时效关系研究
2018-11-15郭丽丽刘瑞华吴广均张盈颖
张 云 张 婷 郭丽丽 刘瑞华 吴广均 张盈颖
(1 中国中医科学院广安门医院免疫研究室,北京,100053; 2 中国中医科学院广安门医院药剂科,北京,100053; 3 中国中医科学院广安门医院新药研发中心,北京,100053)
Toll样受体4(TLR4)是一种跨膜信号转导受体,在免疫细胞、内皮细胞、心肌细胞、肝细胞和神经胶质细胞等表面广泛存在表达[1-2]。TLR4主要通过核转录因子(NFκB)诱导炎性反应递质和炎性反应因子的产生释放激活炎性反应的发生[3-4]。研究发现阿托伐他汀通过抑制TLR4和NFκB信号通路改善结肠炎大鼠的肠道炎性反应[5]。鱼腥草素钠显著抑制LPS刺激的牛乳腺上皮细胞TLR4的表达和NF-κB的激活,且抑制TNF-α、IL-1β和IL-6的产生[6]。我们前期的实验研究也发现,丹参酚酸B能显著抑制TLR4-NF-κB-TNF-α炎性反应通路,从而保护缺氧损伤和炎性反应损伤心肌细胞[7-8]。本文在前期工作基础上进一步深入研究SalB保护缺氧损伤心肌细胞的量效和时效关系。阐明SalB治疗缺血性疾病的作用机制并为临床合理用药提供科学依据。
1 材料与方法
1.1 材料
1.1.1 细胞 出生1~3 d Sprague-Dawley乳鼠购自北京维通利华实验动物中心,经中国中医科学院广安门医院伦理委员会批准用于实验研究。颈动脉放血处死后,立即用75%乙醇消毒皮肤开胸摘取心脏,留取心尖至心室部分,D-HANKS液清洗后剪成1 mm3小块,每只心脏加入2 mL混合消化液进行多次消化,收集乳鼠心肌细胞。详细方法参照文献[7-8]。
1.1.2 药物 丹参酚酸B对照品(Salvianolic acid B):购自四川先欣生化技术研究所,面积归一化法检测纯度为98.90%,货号XXB-SMI-004。
1.1.3 试剂与仪器 低糖DMEM培养基:美国Hyclone产品,货号SH3002101B;D-HANKS:TBD Science产品,货号HA2004Y;Ⅱ型胶原酶:Sigma公司产品,100 mg/支,货号C6885;0.25%胰酶:美国Hyclone产品,货号SH3004201;TLR4和NFκB引物(赛百盛生物技术公司合成);Trizol 100 mL(Invitrogen,Cat No.15596-026,USA);SYBR green PCR master Mix(ABI,Cat No.4309155,UK);反转录试剂盒(MBI,Cat No.K1622,USA);兔抗大鼠TLR4和NFκB多克隆抗体(Santa Cruz,货号分别是:sc-30002和sc-33022);TNFα ELISA检测试剂盒:美国RB公司产品,货号3R080。SANYO CO2培养箱;OLLYMPUS IX-70型倒置显微镜;超净工作台;MULTISKAN MK3全自动多功能酶标仪(Thermo,USA)及缺氧培养装置。
1.2 方法
1.2.1 分组与模型制备 心肌细胞共分为5组,分别为:正常组;缺氧模型组;SalB大剂量组;SalB中剂量组;SalB小剂量组。采用缺氧装置系统,将细胞置于充满95%N2密封装置内,采用无糖D-Hanks液代替DMEM培养基。血气分析表明常氧和缺氧细胞培养液中氧分压分别为200 mmHg和21 mmHg,达到所需要的缺氧条件。
1.2.2 给药方法(或干预方法) SalB大、中、低剂量浓度分别为10-5mol/L、10-6mol/L和10-7mol/L。预防给药是指SalB加入培养基后6 h再置于缺氧装置6 h后收集标本;同时给药是指SalB加入培养基后立即置于缺氧装置6 h后收集标本;后给药是指细胞置于缺氧装置6 h后加入SalB干预6 h再收集标本。
1.2.3 检测指标与方法 qRT-PCR检测方法:冲洗刮取并离心收集心肌细胞,加入0.5 mL Trizol混合,按Trizol说明抽提总RNA。总RNA的反转录、引物设计和RT-PCR的扩增条件都与前期的实验研究一致,具体内容参见文献[9]。免疫组化及ELISA法:免疫组化法检测爬片细胞TLR4和NFκB蛋白,ELISA法检测培养上清液中TNFα浓度,均严格按照说明书操作。
2 结果
2.1 丹参酚酸B调节缺氧心肌细胞TLR4 mRNA的量效和时效作用 与正常组比较,缺氧各组心肌细胞TLR4 mRNA表达显著升高(P<0.01或P<0.05)。与缺氧组比较,丹参酚酸B预防给药大、中、小剂量组TLR4 mRNA表达均显著下降(P<0.01或P<0.05)。丹参酚酸B同时给药大、中剂量组TLR4 mRNA表达显著下降(P<0.05)。丹参酚酸B后给药各组TLR4 mRNA表达差异无统计学意义(P>0.05)。见表1。

表1 SalB不同给药浓度和时间对心肌细胞TLR4 mRNA表达量的调节
注:与正常组比较,*P<0.05,**P<0.01;与缺氧组比较,△P<0.05,△△P<0.01
2.2 丹参酚酸B调节缺氧心肌细胞NFκB mRNA表达的量效和时效作用 与正常组比较,缺氧各组心肌细胞NFκB mRNA表达显著升高(P<0.01或P<0.05)。与缺氧组比较,丹参酚酸B预防给药大、中、小剂量组NFκB mRNA表达均显著下降(P<0.01或P<0.05)。丹参酚酸B同时给药大、中剂量组NFκB mRNA表达显著下降(P<0.05)。丹参酚酸B后给药各组NFκB mRNA表达差异无统计学意义(P>0.05)。见表2,图1。

表2 SalB不同给药浓度和时间对心肌细胞NFκB mRNA表达量的调节
注:与正常组比较,*P<0.05,**P<0.01;与缺氧组比较,△P<0.05,△△P<0.01
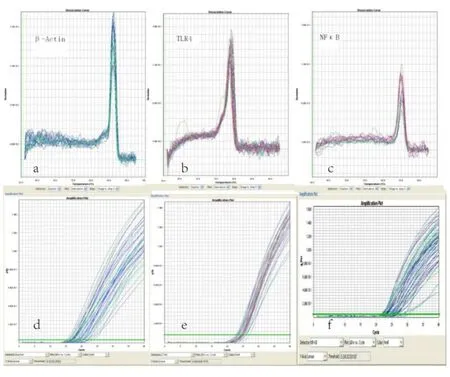
图1 RT-PCR法检测TLR4和NFκB mRNA溶解曲线和扩增曲线图
注:a为β-actin溶解曲线,b为TLR4溶解曲线,c为NFκB溶解曲线,d为β-actin扩增曲线,e为TLR4扩增曲线,f为NFκB扩增曲线
2.3 丹参酚酸B调节缺氧心肌细胞TLR4蛋白表达的量效和时效作用 与正常组比较,缺氧各组心肌细胞TLR4蛋白表达面积均显著升高P<0.01)。和缺氧组比较,丹参酚酸B预防给药大、中、小剂量组TLR4蛋白的表达面积均显著下降(P<0.01或P<0.05)。丹参酚酸B同时给药大、中剂量组TLR4蛋白的表达面积显著下降(P<0.05)。丹参酚酸B后给药各组TLR4 mRNA表达差异无统计学意义(P>0.05)。见表3,图2。
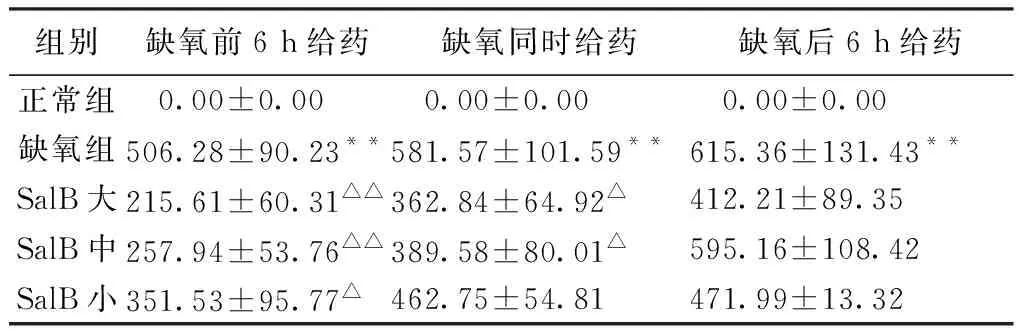
表3 SalB不同给药浓度和时间对心肌细胞TLR4蛋白表达量的调节(μm2)
注:与正常组比较,*P<0.05,**P<0.01;与缺氧组比较,△P<0.05,△△P<0.01
2.4 丹参酚酸B调节缺氧心肌细胞NFκB蛋白表达的量效和时效作用 与正常组比较,缺氧各组心肌细胞NFκB蛋白表达面积均显著升高(P<0.01)。和缺氧组比较,丹参酚酸B预防给药大、中、小剂量组NFκB蛋白的表达面积均显著下降(P<0.01或P<0.05)。丹参酚酸B同时给药大、中剂量组NFκB蛋白的表达面积均显著下降(P<0.05)。丹参酚酸B后给药各组NFκB mRNA表达差异无统计学意义(P>0.05)。见表4。
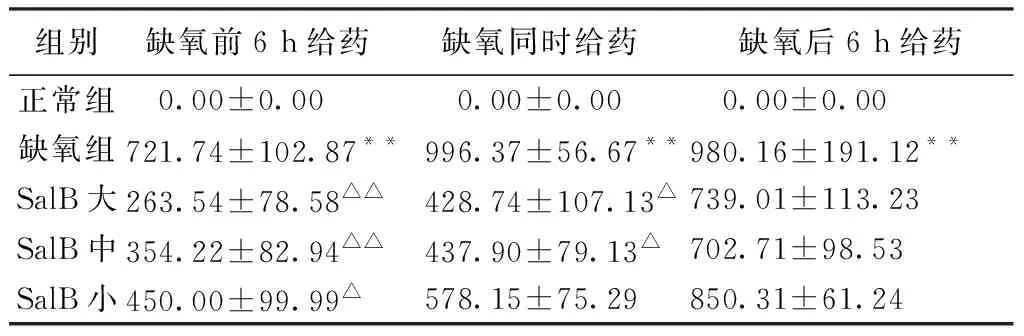
表4 SalB不同给药浓度和时间对心肌细胞NFκB蛋白表达量的调节(μm2)
注:与正常组比较,*P<0.05,**P<0.01;与缺氧组比较,△P<0.05,△△P<0.01
2.5 丹参酚酸B调节缺氧心肌细胞TNFα表达的量效和时效作用 与正常组比较,缺氧各组细胞上清液中TNFα含量均显著升高(P<0.01)。和缺氧组比较,丹参酚酸B预防给药大、中、小剂量组TNFα含量均显著下降(P<0.01或P<0.05)。丹参酚酸B同时给药大、中剂量组TNFα含量均显著下降(P<0.05)。丹参酚酸B后给药各组TNFα含量差异无统计学意义(P>0.05)。见表5。

表5 SalB不同给药浓度和时间对心肌细胞TNFα表达量的调节(nmol/mL)
注:与正常组比较,*P<0.05,**P<0.01;与缺氧组比较,△P<0.05,△△P<0.01
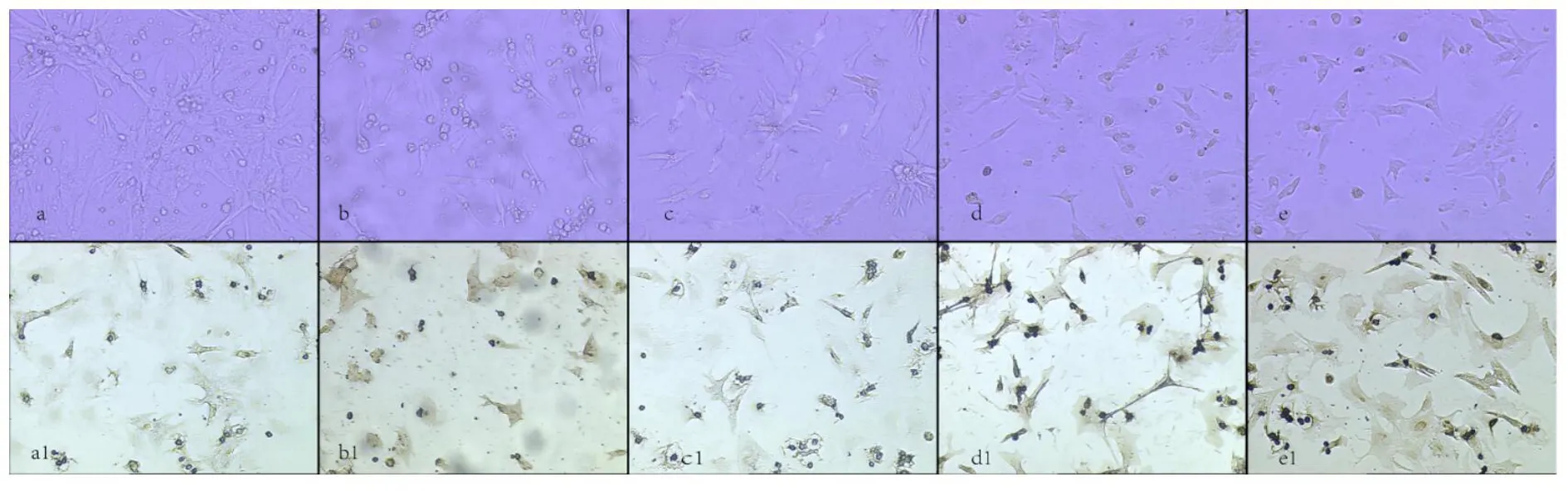
图2 SalB缺氧前6 h预防给药各组心肌细胞培养状态及细胞爬片TLR4免疫组化染色图
注:a为正常组,b为模型组,c为SalB大剂量组,d为SalB中剂量组,e为SalB小剂量组。a1、b1、c1、d1、e1为各组对应的细胞爬片TLR4免疫组化染色图。可见正常组细胞形态完整,无着色;模型组细胞固缩坏死,着色深;SalB大、中、小剂量组较模型组细胞形态相对完整,着色明显变浅
3 讨论
缺氧损伤是某些缺血性疾病的主要病理损伤因素,且伴随疾病的发生、发展和转归的全过程。如重要脏器心脑肾的缺血性疾病:冠心病、急性心肌梗死、脑梗死、肾动脉狭窄和肾动脉硬化等。缺氧诱导肾上皮细胞TLR4和NF-κB的表达,引起细胞凋亡、炎性反应因子TNF-α释放和肾小管间质纤维化。糖蛋白Slit2可以抑制TLR4和NF-κB的表达减轻炎性反应和纤维化的发生[10]。缺氧的脂肪细胞TLR4受体表达上调8.8倍、NF-κB信号激活、炎性反应因子释放。本研究发现缺氧损伤乳鼠心肌细胞在缺氧后6 h TLR4和NF-κB mRNA和蛋白的表达均显著增加,细胞上清液中TNF-α含量也显著升高[11]。据此,我们推断缺氧状态下TLR4-NF-κB-TNF-α炎性反应通路明显激活,是缺氧状态下炎性反应损伤的主要机制。
活血化瘀中药丹参被广泛应用于心脑血管疾病和糖尿病肾病等动脉粥样硬化的预防和治疗[12-13]。丹参酚酸B是丹参中含量最丰富的生物活性化合物。SalB可呈剂量依赖性地降低缺血再灌注引起的神经功能损伤,治疗局灶性脑缺血再灌注损伤[14]。SalB还能增加缺血缺氧干细胞的存活率[15]。SalB对脑缺血再灌注的保护作用与抑制血小板活化和下调NF-κB通路相关。我们课题组前期的研究工作发现,SalB能保护缺氧损伤和炎性反应损伤心肌细胞,其作用机制与抑制TLR4-NF-κB-TNF-α炎性反应通路相关[7-8]。但目前未见关于SalB对缺氧损伤心肌细胞保护作用的量效和时效关系研究报导。
本研究发现SalB对缺氧损伤乳鼠心肌细胞TLR4-NF-κB-TNF-α炎性反应通路的抑制作用存在明显的量效和时效关系。大、中剂量组较小剂量组效果显著。缺氧前预防给药和缺氧同时给药较缺氧后给药效果显著。因此,我们认为临床应用丹参酚酸B或丹参类制剂(如丹红注射液,丹七片、丹参滴丸等)治疗缺血性疾病宜早期、足量和全程给药为佳,以便更好地发挥其抗炎和保护缺氧损伤组织细胞的作用。
本研究是细胞实验,干扰混杂因素少,实验结果具有可靠性。今后还需要进一步进行动物实验和临床实验研究,需要考虑到病和证的对应和结合,丹参主要对应的是血瘀证。
