肠愈宁对溃疡性结肠炎大鼠炎性因子及钙卫蛋白释放的影响
2018-11-15王海强郑丽红刘朝霞王静滨梁国英刘金狄张月涛
王海强 郑丽红 朱 峰 刘朝霞 王静滨 张 杨 梁国英 刘金狄 张月涛
(1 黑龙江中医药大学附属第一医院,哈尔滨,150040; 2 黑龙江中医药大学附属第二医院,哈尔滨,150001; 3 黑龙江中医药大学,哈尔滨,150040)
溃疡性结肠炎(Ulcerative Colitis,UC)属于炎症性肠病之一,其发病机制尚不明确,临床症状表现为腹痛、腹泻、里急后重、黏液脓血便等[1]。目前,临床上治疗UC主要以糖皮质激素和水杨酸制剂为主,代表药有柳氮磺胺吡啶和美沙拉嗪,但是不良反应大,无法长期服用。现代医学研究表明,免疫失衡在UC发生过程中起关键作用,过度活化的效应细胞产生的抗体、炎性反应介质、细胞因子引起炎性病变导致组织破坏[2]。二硝基氯苯模型是一个典型的胃肠道迟发变态反应模型,其原理为长期存在的外源性抗原或机体自身抗原激活机体的免疫系统,产生细胞免疫反应,直接诱发或加重UC[3]。
本科室经历了近10多年的临床和实验课题研究,在方法中归纳出清热解毒,健脾燥湿法治疗本病,并经过反复摸索研制出经验方剂肠愈宁颗粒,在临床实践中肠愈宁颗粒治疗UC取得了良好的疗效,而且其安全性良好。本实验用DNBS诱导SD大鼠UC模型,研究UC大鼠在肠愈宁颗粒干预下CP在结肠黏膜、血清中的表达的变化和差异,同时结合相关炎性介质进一步阐明肠愈宁颗粒对UC进行有效的阻断和治疗,并提供科学的理论依据
1 材料与方法
1.1 材料
1.1.1 动物 清洁级SD大鼠60只,均为雄性,体重(250±15)g,由黑龙江中医药大学动物实验中心提供。实验动物许可证号:SCXK(黑)-2014-0003。
1.1.2 药物 2、4-二硝基氯苯(DNCB):由上海安诺方胺化学品公司生产。肠愈宁颗粒(白头翁,黄连,黄零,赤石脂,焦白术等)组成。由江苏天阴药业生产。柳氮磺胺吡啶(SASP)(上海三维制药有限公司,生产批号:07051)。用前研碎,用生理盐水配置成混悬液。
1.1.3 试剂与仪器 VICTOR X3酶标仪,美国PerkinElmer公司;BI-496 2000医学图像分析系统,成都泰盟科技有限公司;BT 25S型电子分析天平,德国Sartorius公司;HWS24恒温水浴锅,上海一恒科学仪器有限公司;电泳仪,上海精密仪器仪表有限公司,高速台式离心机,科大创新股份有限公司,凝胶成像分析系统。OML-QPA型生物组织切片机,湖北欧美莱医疗科技有限责任公司。
1.2 方法
1.2.1 分组与模型制备 采用二硝基氯苯乙酸复合法制备大鼠UC模型。将60只SD大鼠随机分成实验组50只和正常组10只。实验组大鼠背部剃毛后,用2% 2,4-二硝基氯苯丙酮溶液滴背部,1次/d,每只鼠5滴/次,连续14 d致敏。15 d向肛内约6 cm处的结肠腔内用1% 2,4-二硝基氯苯乙醇液保留灌肠0.35 mL,于16 d在同部位注入0.1%乙酸溶液2 mL,准确计时15 s后,再用5.0 mL生理盐水冲洗。造模前后均给予大鼠高脂饮食。17 d随机抽取2只造模大鼠处死,取其结肠标本,病理检查确认有充血,水肿及典型溃疡形成即为造模成功。
1.2.2 给药方法 各观察组均于造模后1 d给予相应药物灌胃,连续两周。在建立UC病变动物模型的同时,肠愈宁高剂量组、中剂量组、低剂量组(CYN-L,CYN-M,CYN-G)分别灌服相当于生药量为1 g/mL、2 g/mL、4 g/mL的肠愈宁顆粒溶液10 mL/(kg·d)。柳氮磺胺吡啶对照组(SASP):灌服相当于生药量为0.2 g/(kg·d)柳氮磺胺吡啶悬浊液10 mL/(kg·d),药物均溶于质量分数为0.5% CMC溶液,超声溶解。而空白对照组、模型对照组给予等量生理盐水灌胃10 mL/(kg·d),在第31天处死大鼠并取材。
1.2.3 检测指标与方法 疾病活动指数(Disease Activity Index,DAI)参考文献[4]的方法,分别观察大鼠体重、大便性状及血便变化,具体计分标准见表1。

表1 大鼠DAI评分标准

表2 结肠黏膜损伤程度(CMDI)评分标准
结肠黏膜损伤程度(CMDI)及病理学评价:实验结束后,腹主动脉取血之后,立即解剖结肠,沿肠系膜纵轴剪开肠腔,用生理盐水清洗干净。参考文献[5]的标准,对各组结肠黏膜损伤程度进行评分比较。于病变处剪取0.6 mm×2.5 mm组织块,立即置于10%福尔马林固定液中固定,24 h后进行石蜡包埋,连续切片,进行HE染色,光学显微镜下观察结肠黏膜形态。见表2。
血清IL-1β、TNF-α和CP的活性检测:从大鼠腹主动脉取不抗凝血3~5 mL,静置凝固后,4 ℃离心机内,3 500 r/min离心12 min,取上层血清,采用双抗夹心法ELISA测定大鼠血清中IL-1β、TNF-α和CP的含量,按照试剂盒说明书规范操作。在检测波长450 nm处读板,通过标准曲线,利用回归方程计算含量。
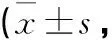
表3 肠愈宁对UC大鼠DAI评分的影响分)
注:与正常组比较**P<0.01,*P<0.05;与模型组比较△P<0.05,△△P<0.01
Western blot检测肠组织CP的表达:取病变最明显2.0 cm×3.0 cm处,加裂解液用玻璃匀浆器将其磨碎,离心,后取上清液,送-80 ℃冰箱冷藏。BCA法测定总蛋白浓度,将提取的蛋白25 μg电泳,恒压90 V电泳至浓缩胶下部,恒压125 V电泳至分离胶底部;在恒流50 mA湿转60 min,封闭2 h后,加入1∶3 000稀释的鼠抗CP抗体,摇床上振摇2 h,再加入1∶5 000稀释的抗鼠和抗羊IgG,摇床上振摇1 h,Western blot荧光显影仪进行扫描,曝光。应用Image J 1.8.0软件对蛋白条带进行灰度分析,计算条带灰度值。
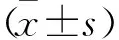
2 结果
2.1 肠愈宁对UC大鼠DAI评分的影响 造模开始后,和正常组比较,造模组大鼠在造模几日之后出现稀便,觅食不主动,肛周污浊,食量减少,持续稀便,而后部分大鼠体重降低,有血便且肉眼可见,说明结肠出现不同程度的损伤和出血。肠愈宁颗粒低、中剂量组症状缓解缓慢,食量较少,扎堆、稀便及血便症状缓解不明显;肠愈宁高剂量组、SASP组随着给药时间的延长,症状明显好转,大部分大鼠稀便症状消失,基本恢复正常,食量正常,活跃,粪便呈灰褐色颗粒状,体重略有回升。不同时间点大鼠的DAI分值。见表3。
2.2 肠愈宁颗粒对UC大鼠结肠长宽及CMDI评分的影响 末次给药次日(造模后22 d),正常组、模型组与各给药组在结肠长度上并无显著性差异。见表4。正常组大鼠肉眼观察结肠黏膜无明显水肿、糜烂和溃疡形成。模型组大鼠肠壁可见明显的充血、水肿,结肠略微缩短;沿肠系膜纵向剖开可见肠壁黏膜,局部有糜烂、出血,并可找到明显的溃疡灶,病变主要累及远端结肠,CMDI评分升高(P<0.01)。SASP组和肠愈宁颗粒各剂量组大鼠肠黏膜病变较模型对照组明显好转,呈溃疡愈合改变。结肠各指数均明显降低(P<0.01或P<0.05)。
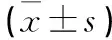
表4 肠愈宁颗粒对UC大鼠结肠长宽及CMDI评分的影响
注:与正常组比较**P<0.01,*P<0.05;与模型组比较△P<0.05,△△P<0.01
2.3 肠愈宁颗粒对UC大鼠结肠组织病理学的影响 光学显微镜下观察各组结肠组织病的理切片。见图1。正常对照组黏膜上皮完整,结构清晰,腺体整齐排列,杯状细胞丰富,隐窝形态正常,炎细胞无浸润,黏膜下层及肌层未见异常。模型组大鼠结肠黏膜缺失明显,固有层内腺体结构紊乱,杯状细胞减少,并有大量炎性细胞浸润,包括淋巴细胞、浆细胞、单核细胞;并伴有明显水肿。SASP组和肠愈宁颗粒各剂量组的损伤程度均较模型组不同程度降低,可见大鼠结肠黏膜病变减轻,溃疡愈合,腺体排列尚规则,存在少量炎性细胞浸润且肠愈宁颗粒高剂量组与SASP组效果相当。
2.4 各组大鼠血清IL-1β、TNF-α及Calprotectin(CP)的比较 与空白对照组比较,模型组大鼠血清IL-1β、TNF-α以及CP的表达量显著上升(P<0.05或P<0.01);而各剂量观察组以及阳性药组血清IL-1β、TNF-α及CP的表达均有不用程度的降低(P<0.05或P<0.01)。见图2。
2.5 肠愈宁对肠组织中CP表达的影响 Western blot检测结果表明,模型组大鼠肠组织中CP的表达较空白组显著升高(P<0.05)。见图3。给药后,各组CP表达发生改变,肠愈宁组较模型组CP表达明显降低,差异有统计学意义(P<0.05)。且具有剂量依赖性,阳性药组的调节作用要稍优于肠愈宁组。

图1 肠愈宁颗粒对UC大鼠结肠组织病理学的影响HE×200
注:A:正常组;B:模型组;D:CYN-low;E:CYN-medium;F:CYN-high;C:SASP5
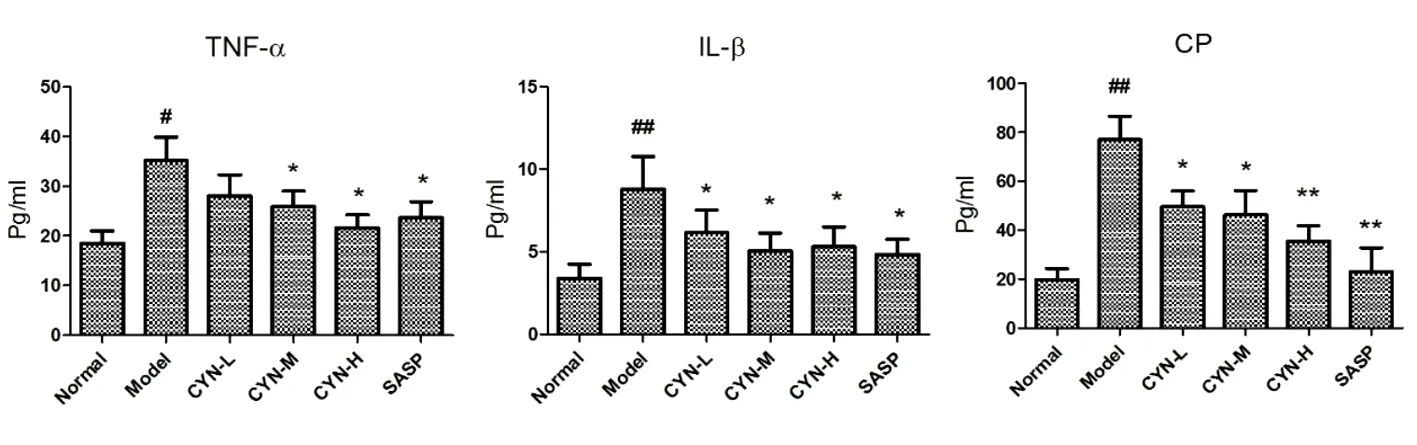
图2 各组大鼠血清IL-1β、TNF-α及Calprotectin(CP)的比较
注:##P<0.01,#P<0.05 vs normal group;**P<0.01,*P<0.05 vs model group
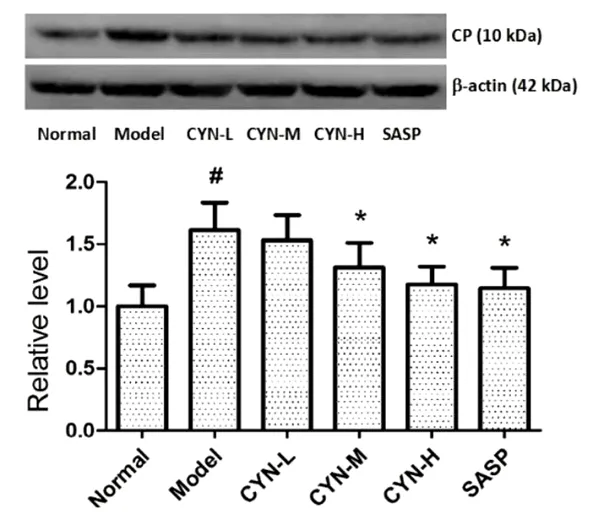
图3 肠愈宁对肠组织中CP表达的影响
注:##P<0.01,#P<0.05 vs normal;*P<0.05,**P<0.01 vs model
3 讨论
目前,对于UC西药尚缺乏强有效的干预手段,UC的西药治疗如美沙拉嗪、4-氨基水杨酸等虽对病情有所控制,不良反应较大。其次是皮质类固醇,是临床治疗急性暴发型和重度溃结患者的首选药物,长期应用易产生不良反应且不能防止复发。再次是免疫抑制剂,对常规药物治疗无效的UC有一定疗效,但对肝、肾及骨髓有毒性[6]。而中医药治疗溃结体现了较明显的优势,近些年中医药治疗溃结疗效显著,却无明显不良反应,体现出中药治疗溃结的优越性。我们经过近20余年的临床和实验研究总结出经验方肠愈宁颗粒。肠愈宁颗粒组方源自金元医家刘完素的名方白术黄芪汤(《素问病机气宜保命集·泻痢论》),结合我科名中医治疗UC的临床经验配药而成,在临床应用取得了良好的效果,有效率达90%以上,而且安全性良好[7]。本研究复制了的UC大鼠模型,并通过宏观和微观角度考察了UC大鼠肠道炎性反应,实验结果显示,肠愈宁颗粒调节了肠道异常免疫反应,使肠黏膜炎性反应和溃疡基本消除。佐证了肠愈宁颗粒的有效性。
UC病因和病机尚不明确,但免疫异常被公认为在炎症性肠病(Inflammatory Bowel Disease,IBD)中发挥着决定性的作用,包括细胞因子、炎性反应递质以及免疫调节等方面[8]。溃结与结肠癌的发生存在一定的因果关系,所以被WHO列为难治之病[9]。细胞因子可分为抗炎性细胞因子和促炎性细胞因子两类,正常人群中两类因子处于平衡状态,有研究表明,当抗炎性细胞因子异常减少或促炎性细胞因子异常增多可导致二者平衡被打破,进而促使肠道黏膜炎性反应的发生[10]
肿瘤坏死因子(Tumor Necrosis Factor,TNF)TNF-α不仅具有抗肿瘤的活性,并且还能介导和调节机体的免疫反应、炎性反应、代谢等。TNF-α通过促进内皮细胞粘附分子上调、趋化中性粒细胞发挥凝血酶原效应的作用,进而参与UC的发生,活动期UC,在血浆和粪便中均能检测到TNF-α的表达,且水平升高[11]。IL-1β属内分泌型细胞因子,可由多种细胞产生,如巨噬细胞、单核、内皮细胞和中性粒细胞等。在免疫炎性反应中有重要作用。IL-1β具有较多的生物学活性,可以诱导淋巴因子的产生,活化T细胞、诱导急性期炎性反应免疫、蛋白质合成等。UC活动期IL-1β的表达上调,间接提示它对UC的发病起重要作用。
钙卫蛋白(Calproteetin,CP)是一种杂合性的钙结合蛋白,来源于中性粒细胞和活化巨嗜细胞胞质,可作为一种炎性标志物。其具有抗蛋白酶活性和耐热性,在外界环境中和肠腔可长期保持稳定而不被细菌和酶破坏,其主要生物学功能包括抗微生物活性、调节免疫作用、参与细胞信号传递、抗增殖和诱导细胞凋亡、炎性反应中调节蛋白等[12]。国外研究表明钙卫蛋白的稳定性要好于以前的生物标记物,其浓度在UC活动期显著增加[13]。UC的研究,是目前免疫疾病防治研究的重点,依然存在着许多未解决的问题。钙卫蛋白作为调节蛋白在UC的防治中的相关研究极少。
本实验通过免疫印迹检测(Western blot)结肠组织CP,同时酶联免疫法(Euzy Melinked Immunosorbent Assay,ELISA)检查相关炎性介质TNF-α、IL-1β。结果表明模型组大鼠TNF-α、IL-1β的表达明显高于空白对照组,说明促炎细胞因子参与了UC的发病。经过肠愈宁颗粒治疗两周后,实验大鼠血清IL-1β、TNF-α的表达较模型组显著减少。表明肠愈宁颗粒治疗UC的机制可能是通过抑制促炎因子IL-1β、TNF-α的表达,进而调整了促炎因子与抗炎因子的平衡。此外,在血清和肠组织中,肠愈宁颗粒组的CP的含量比较模型组有显著的降低。本研究从细胞免疫和CP调节角度阐述肠愈宁颗粒影响UC的发病机制。本文可以为进一步研究肠愈宁颗粒治疗UC的机制以及UC药物的开发提供理论依据。
