雌激素通过雌激素受体α上调载脂蛋白M的表达
2018-11-15魏江于洋罗光华张俊徐宁张晓膺苏州大学附属第三医院综合实验室江苏常州3003瑞典Lund大学临床化学系S85
魏江,于洋,罗光华,张俊,徐宁,张晓膺(.苏州大学附属第三医院综合实验室,江苏常州3003;.瑞典Lund大学临床化学系S-85)
载脂蛋白M(ApoM)主要存在于高密度脂蛋白(HDL)中,少部分存在于低密度脂蛋白(LDL)和极低密度脂蛋白中[1]。其有8股反向β折叠片段,从而形成疏水性结合域,这样就与一些亲脂小蛋白分子结合,如视黄醇、肉豆蔻酸及1-磷酸鞘氨醇(S1P),从而发挥相应作用。ApoM能促进前β-HDL颗粒形成及成熟,而β-HDL的主要功能是促进细胞内胆固醇的外流,从而发挥其抗动脉粥样硬化功能[2]。ApoM是S1P的主要载体,并调节S1P的代谢,维持机体内皮细胞结构和功能的完整性[3]。ApoM与S1P结合具有抗炎作用[4]。加入外源性的ApoM-S1P抑制肿瘤坏死因子-α的诱导内皮细胞炎症作用[5]。作者前期研究发现,雌激素能体内外上调ApoM的表达,但具体机制尚不清楚[6]。本研究将进一步探讨雌激素调节ApoM基因转录的具体分子机制。
1 材料与方法
1.1 材料 HepG2肝癌细胞株和人乳腺癌细胞系(MCF-7)购自美国ATCC公司;DMEM培养基、无酚红DMEM培养基、RPMI-1640培养基、胎牛血清、活性炭处理的胎牛血清和LipofectamineTM2000转染试剂购自美国Gibco公司;雌二醇和牛血清清蛋白结合雌激素(E2-BSA)购自美国 Sigma公司;雌激素受体α(ER-α)拮抗剂MPP购自英国Tocris公司。质粒pGL3-basic和双荧光报告系统购自美国Promega公司;Gel Extraction Kit试剂盒和质粒提取试剂盒购自美国OMEGA公司的;LightShift®Chemiluminescent凝胶电泳迁移实验(EMSA)试剂盒购自美国Pierce公司;染色质免疫共沉淀(CHIP)试剂盒购自美国Thermofisher公司。总RNA提取试剂盒K352购自上海申能博彩科技有限公司。首链cDNA合成试剂盒购自立陶宛Ferments公司。引物及探针均由上海生工生物工程有限公司合成。兔抗人ApoM多克隆抗体由瑞典隆德大学临床化学系制备。抗人单克隆抗体和辣根标记羊抗兔免疫球蛋白(IgG)二抗购自美国Santa Cruz公司。ECL化学发光检测试剂盒购自北京康为世纪生物科技有限公司。总蛋白提取试剂盒购自上海炎彬化工科技有限公司。
1.2 方法
1.2.1 细胞培养 细胞培养按常规培养HepG2细胞,用含10%活性炭处理的胎牛血清的无酚红DMEM稀释消化后离心的细胞,按5×104μL-1孔接种至6孔培养板,常规培养24 h后,用磷酸盐缓冲溶液(PBS)洗涤3次,再加入无酚红DMEM培养基继续培养24 h,第3天PBS洗涤后,加入含不同浓度17β-雌二醇共价衍生物(E2-BSA)的无酚红DMEM培养基,继续培养24 h后,提取细胞总RNA及蛋白待测。拮抗剂试验与浓度试验与之类似,区别为第3天洗涤后,加入雌二醇(10 μmol∕L)或 E2-BSA(100 nmol∕L)及 ER-α MPP(1 μmol∕L),继续培养 24 h,提取细胞总 RNA 待测。
1.2.2 逆转录-聚合酶链反应(RT-PCR)和荧光定量PCR RT-PCR步骤按照Ferments公司试剂盒及其说明书进行。荧光定量PCR在LightCycler荧光定量PCR仪上完成。本研究所需引物及探针见表1。反应条件为95℃3min;95℃5s,60℃15s,共40个循环;40℃1min。
1.2.3 蛋白免疫印迹法(Western blotting)检测ApoM的表达 将蛋白与十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)蛋白上样缓冲液混匀,置100℃5 min进行蛋白变性,冰上放置。取变性样本10 μL上样(总蛋白上样量20 μg),电泳,以250 mA电流2 h转移至聚偏氟乙烯(PVDF)膜上。含3%BSA的加吐温-20磷酸盐缓冲溶液(PBST)缓冲液中室温封闭1 h后,用ApoM多克隆抗体4℃孵育过夜,1×PBST洗膜3次后,加二抗室温孵育2 h后,采用增强化学发光法(ECL)发光检测。
1.2.4 pCDNA3.1-ER-α表达载体的构建 以人全序列基因为模板,设计含Xho I和EcoR I酶切位点的引物。从MCF-7细胞中抽提总RNA,RT-PCR扩增ER-α基因。PCR 条件:94 ℃ 5 min;94℃ 30 s,54 ℃ 30 s,72 ℃2 min,30个循环;72℃ 10 min;16℃ 保存。1% 琼脂糖凝胶电泳分离目的基因。将ER-α回收产物和pCDNA3.1载体用限制性内切酶Xho I与EcoRI进行双酶切,1%琼脂糖凝胶电泳检测,并用Gel Extraction Kit试剂盒进行产物回收。将ER-α目的基因片段和pCDNA3.1载体进行连接,并将连接产物转化感受态细胞大肠杆菌DH5α,接种于氨苄抗性的LB固体培养基上进行筛选。挑取单克隆,提取质粒,经Xho I和EcoRI酶切进行鉴定。鉴定正确的质粒送上海生物工程有限公司测序验证。
1.2.5 ApoM启动子区(野生型和点突变型)荧光素酶表达载体(pGL3-ApoM)的构建 (1)根据基因信息学设计预测了ApoM启动子区可能存在不同ER-α结合位点,设计了扩增引物,分别添加了BglⅡ和HindⅢ酶切位点(表2)。以全基因组为模板,PCR方法获得不同长度ApoM启动子片段。PCR条件:94℃5 min;94℃30 s,65 ℃ 30 s,72 ℃ 2 min,30 个循环;72 ℃ 10 min;16℃保存。扩增产物经双酶切后连接入pGL3-basci载体中,阳性克隆经酶切鉴定及DNA测序鉴定。(2)点突变载体的构建,设计欲定点突变的引物。正义引物:5′-TTAATAAACTCTAATATACTCACTGCCCAAATTTTGT TTGTTTTT-3′,反义引物:5′-AAAAACAAACAAAACAG TGAGTATATTAGAGTTTATTAA-3′。以构建好的ApoM P3质粒做模板,PCR扩增目的基因。PCR条件:94℃5 min;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 7 min,18 个循环;72℃10 min;16℃保存。扩增产物经DpnI酶酶切后连接入pGL3-basci载体中,阳性克隆经酶切鉴定及DNA测序鉴定。将测序正确的重组质粒分别命名为P1、P2、P3和 P4。
1.2.6 细胞转染和双荧光素酶活性检测 (1)细胞转染:将 MCF-7按 2×104μL-1接种于24孔板,培养24 h后,用Lipofectamine 2000试剂盒进行转染。对照组pGL-3-BASIC、pcDNA3.0和pRL-SV40共转染。实验组为不同启动子区长度的pGL-3-ApoM、pcDNA3.0-ER-α和pRL-SV40共转染。(2)荧光素酶活性测定:转染48 h后,加入裂解液裂解细胞,收集上清液,并用于荧光素酶活性测定,按照试剂说明书进行操作。荧光素酶相对活性用荧光素酶活性∕海肾荧光素酶活性的比值(Luc∕RL)表示;每组同时转染3孔,进行3次独立检测,计算Luc∕RL 的平均值。
1.2.7 EMSA 利用上述构建ApoM启动子区P3位点报告基因及点突变基因为探针分析ER-α与ApoM启动子的结合活性。依照美国Pierce公司试剂盒操作说明进行,等量细胞核提取物(5 μg)与生物标记的凝胶寡核苷酸探针或冷探针在20℃以下孵育30 min,反应混合物经6.5%聚丙烯酰胺凝胶在预冷0.5×Tris-硼酸(TBE)缓冲液中4℃、100 V电泳1 h。用半干电转移法转移至尼龙膜上。用封闭液室温封闭膜15 min;加放辣根过氧化物酶耦联的链亲和素,室温孵育15 min,加放化学发光底物室温孵育2 min,暗室中X射线胶片曝光。
1.2.8 染色质免疫共沉淀技术(CHIP-PCR) 按照Piece Agarose CHIP Kit试剂盒说明进行操作。选取MCF-7细胞常规培养48 h,加入终浓度1%的甲醛,37℃交联固定DNA与蛋白质10 min。收集细胞用裂解缓冲液重悬,冰上放置15 min,每5分钟涡旋混匀1次。离心取上清液,将获得的5 μL上清液作为Input组存于-80℃备用。另取45 μL加入ER-α抗体,4℃孵育过夜处理,离心收集沉淀。与Input组同时用5 mmol∕L氯化钠65℃解交联4 h,DNA纯化后溶于30 μL洗脱液中。针对ApoM上游启动子区设计特异性引物,扩增包含ER-α识别序列片段,以确定ER-α与ApoM的结合;正义引物:5′-TTGGGCAACAGAACGAGACT-3′,反义引物:5′-TATCCCATGGACTGCCACAA-3′
1.3 统计学处理 应用GraphPad 6.0统计软件进行数据分析。计量数据以表示,组间比较采用one-way ANOVA检验。P<0.05为差异有统计学意义。
2 结 果
2.1 不同浓度的E2-BSA作用于HepG2细胞后ApoM mRNA和蛋白水平变化 不同浓度的E2-BSA作用于HepG2细胞24 h后,ApoM组的mRNA和蛋白水平与0 mol∕L E2-BSA比较呈浓度依赖性升高,其中100 nmol∕L的E2-BSA显著上调了ApoM的表达,差异均有统计学意义(P<0.05)。见图1。
2.2 MPP抑制试验 MPP抑制了E2和E2-BSA对HepG2细胞中ApoM的上调作用。见图2。
2.3 ER-α基因载体构建及其重组质粒鉴定 从MCF-7细胞提取总RNA,以其逆转录反应获得的cDNA为模板,扩增ER-α。PCR扩增产物进行1%琼脂糖凝胶电泳,结果显示,大约在2 000 bp的位置可见特异性目的条带,与预期结果一致。见图3 A。将PCR目的片段回收后,将pcDNA3.1空载体双酶切,经连接和转化后挑取单克隆提取质粒进行菌落PCR鉴定和Xho I与Eco-RI双酶切鉴定。结果显示,在2 000 bp位置可见特异性目的条带。经测序比对,结果一致,说明ER-α基因已成功克隆至pCDNA3.1-载体上。见图3 B。
2.4 ApoM荧光素酶报告载体的构建及其重组质粒鉴定 PCR扩增ApoM启动子非编码区基因片段产物经琼脂糖凝胶电泳显示,其基因片段大小与预计相符,分别为 3 060 bp,2 207 bp、1 740 bp、1 189 bp(P1、P2、P3、P4)左右的清晰条带,表明已经获得ApoM启动子非编码基因片段。见图4 A、B。将PCR目的片段回收后,将pGL3-Basic空载体双酶切,经连接和转化后挑取单克隆提取质粒进行菌落PCR鉴定和经内切酶BglⅡ与Hind Ⅲ进行双酶切。结果显示,在 3 060、2 207、1 740、1 189 bp(ApoM P1、P2、P3、P4)上相应的位置可见特异性目的条带。经测序比对,结果一致,说明ER-α基因已成功克隆至pGL3-Basic-载体上。见图4 C。
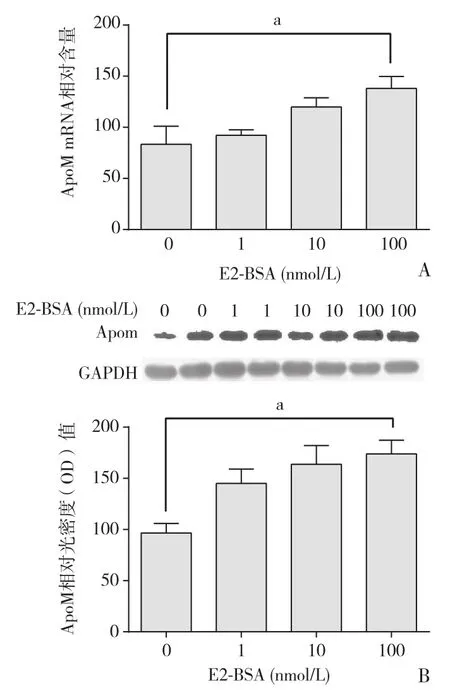
图1 E2-BSA作用于HepG2细胞对ApoM mRNA和蛋白的影响
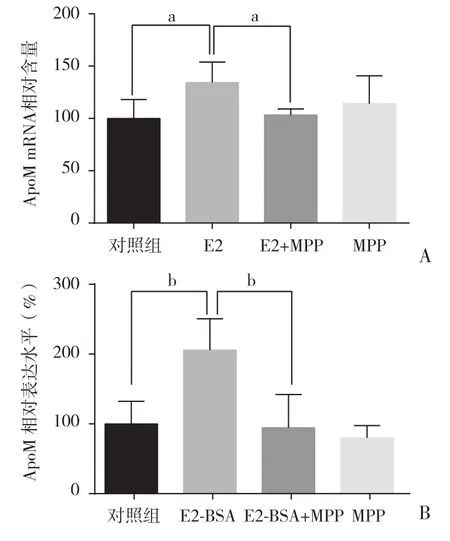
图2 不同雌激素和MPP作用于HepG2细胞对ApoM mRNA的影响
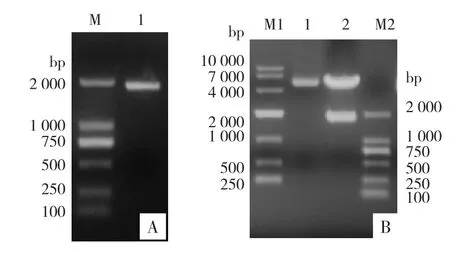
图3 ER-α基因载体构建及重组ER-α质粒的鉴定
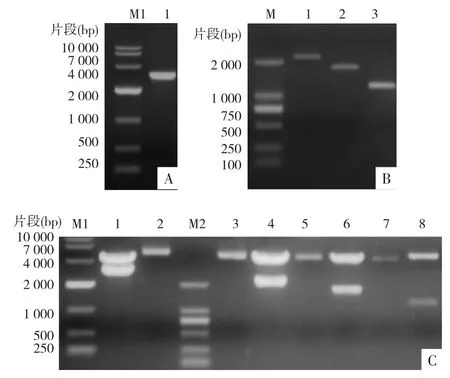
图4 重组ApoM质粒的构建
2.5 双荧光素酶报告系统检测ER-α对ApoM启动子活性的影响 ER-α和不同ApoM启动子片段共转染MCF-7细胞的荧光素酶实验。结果显示,ApoM启动子P3位置[-1 580~ -1 575 bp(-GGTCA)]比 P1、P2和 P4有更高的荧光素活性,而突变的P3荧光素酶活性则显著下降。这一结果说明ApoM启动子P3位置[-1 580~-1 575 bp(-GGTCA)]存在着 ER-α 结合位点。见图5。
2.6 EMSA验证ER-α与ApoM启动子序列的结合活性 只加入核蛋白作为阴性对照(图6,泳道1)。EMSA结果显示,生物素标记的探针可与核蛋白结合(图6,泳道2),而在冷竞争中复合物消失(图6,泳道3),在突变竞争中,可观察到核蛋白与DNA形成的复合物(图6,泳道4),加入抗ER-α抗体后,复合物的条带减弱,且在泳道后出现另一条复合物带(图6,泳道5)。以上结果提示ER-α与ApoM存在着相互作用。
2.7 CHIP-PCR验证ER-α与ApoM的启动子区结合采用CHIP-PCR验证细胞内ApoM启动子区存在着ER-α的结合位点。将抗ER-α抗体与裂解后的核蛋白结合,用RT-PCR对ApoM启动子P3区进行扩增。抗ER-α抗体组ApoM的表达水平是阴性对照组(IgG)的12倍,这提示内源性 ER-α直接与 ApoM启动子(-1 676、-1 519 bp)结合。见图7。
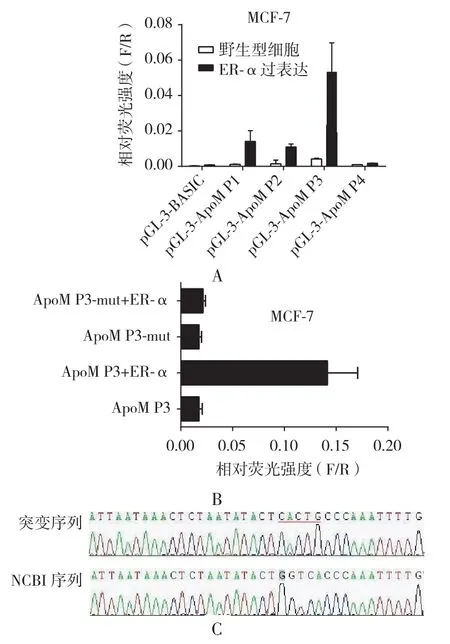
图5 双荧光酶报告系统分析ER-α对ApoM启动子活性的影响
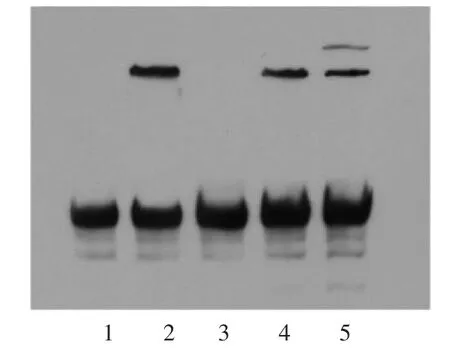
图6 EMSA验证ER-α与ApoM启动子结合活性
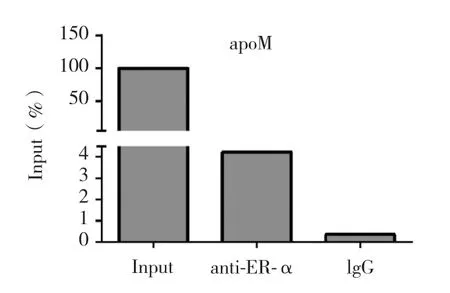
图7 CHIP-PCR验证ER-α与ApoM启动子区结合
3 讨 论
作者前期研究发现,雌激素通过ER能在体内外上调ApoM的表达,但具体机制尚不清楚[6]。ER分为2大类,即经典的ER-α、ER-β及以G蛋白耦联雌激素受体为代表的膜雌激素受体。本研究结果显示,E2-BSA(不能通过细胞膜)能以剂量依赖性上调ApoM的表达,说明雌激素可以通过膜表面的ER来调节ApoM的表达,这与以前的观点相反。以前的观点认为膜表面的ER只是介导雌激素快速的非基因效应[7]。也有研究报道膜表面ER参与了基因的转录。定点突变了所有膜表面ER受体,但其他ER并不受影响。结果发现,雌激素未能调节所有组织中相应基因的表达[8]。作者通过应用MPP分别与雌激素和E2-BSA共同作用于HepG2细胞,结果发现MPP能抑制激素上调HepG2细胞ApoM mRNA效应。这意味着ER-α介导了雌激素对ApoM转录调节。ApoM是前β-高密度脂蛋白胆固醇(β-HDL)颗粒形成及成熟的必要条件[2],ApoM还可以与S1P结合,通过S1P受体维持内皮细胞结构和功能的完整性[4-5,9],因此,从ApoM方面也可以解释雌激素抗动脉粥样硬化的作用为了进一步探讨ER-α调节ApoM的分子机制,作者采用荧光素酶报告系统和点突变技术对ApoM启动子区可能的ER-α结合位点进行了检测,结果发现在ApoM 启动子区(-GGTCA-,-1 580~-1 575 bp)是 ApoM转录活化的基本要素,且将该区域进行点突变则消除了这一转录活性。经典的雌激素反应元件(GGTCA nnn TGACC,n代表任意碱基)是一回文结构元件,这是由13个反向重复的碱基对,和在重复序列中的3个任意替换的碱基。本研究中发现,ApoM启动子GGTCA(-1 580~-1 575 bp)是经典的雌激素反应元件的半个部分。多项研究表明,雌激素是通过非完整或一半雌激素反应元件来调节目的基因的表达,这些反应元件紧挨或远离一半回文结构[10-12]。作者应用EMSA和CHIPPCR进一步验证ER-α通过蛋白-DNA交联的方式与ApoM结合。其他核因子受体也通过与ApoM启动子区结合来调节ApoM的表达[13-14]。VENTECLEF等[14]应用DNA亲和沉淀及染色质免疫共沉淀技术证实在ApoM启动子区(-33~-21 bp)存在肝核因子-4的结合位点。已有多项研究报道,ER-α与LDL和HDL紊乱紧密联系,从而ER-α在脂代谢中的重要作用[15-17]。
本研究结果显示,雌激素通过ER-α与ApoM启动子区结合位点结合,从而上调ApoM的表达,为进一步深入研究雌激素与ApoM的抗动脉粥样硬化奠定了基础。
