燥湿苦参汤联合NB-UVB治疗寻常性银屑病及对Th17和Treg及其相关因子表达的影响
2018-11-15张连云谭晓慧赵敏朱蓓蓓
张连云,谭晓慧,赵敏,朱蓓蓓
(新疆医科大学附属中医医院,新疆 乌鲁木齐 830099)
寻常性银屑病(psoriasis vulgaris)是一种常见的慢性炎症皮肤疾病,主要由皮损部位炎症细胞浸润及毛细血管扩张而导致的表皮过度增殖[1-2]。其发病机制,主要是由于CD4+T淋巴细胞免疫功能的异常,活化的Th(T细胞亚群)细胞发挥了关键作用[3]。银屑病发病过程中存在Th1/Th2细胞平衡的失调,主要表现为Th1细胞的优势应答[2-3]。另外2种T细胞亚群Th17与调节T细胞(regulatory T cell, Treg)也在银屑病的发病机制中发挥了重要的免疫效应[4-5]。以往常以免疫抑制剂或糖皮质激素等西医药物对寻常型银屑病进行治疗,其不良反应较大,且复发率较高[6]。紫外线照射是临床治疗皮肤病的一种常用疗法,其中窄谱中波紫外线(narrow bound ultra violet b light, NB-UVB)穿透性强,皮肤损伤小,致癌性低,因而被广泛应用于银屑病的治疗[7]。近年来,中西医结合疗法在寻常型银屑病的治疗中取得较大进展。中医学认为银屑病的病根在于湿邪,因此临床治疗应以利湿清热为主。基于上述中医学思想,一些学者自拟了如退银汤[8]、燥湿苦参汤[9]、青黛丸等[10]汤剂,并将其运用于寻常型银屑病的临床治疗,取得较好的疗效。燥湿苦参汤含苍术、黄柏、薏苡仁等主要药剂,可清利湿热、通经消肿[9]。本研究以燥湿苦参汤联合NB-UVB治疗寻常型银屑病患者,并比较治疗前后患者的外周血Th17细胞比例及其特异性转录因子—孤儿受体转录因子(related orphan receptor, RORγt mRNA)、分泌因子—白细胞介素17(Interleukin-17, IL-17),Treg细胞的比例及其特异性转录因子—叉头状转录因子(fork head transcription factor, Foxp3 mRNA)、分泌因子—转化生长因子(transform growth factor-β, TGF-β)的表达水平,分析中西医结合疗法对寻常性银屑病患者临床疗效及免疫效应的影响,现报道如下。
1 资料与方法
1.1 一般资料
选取2014年6月-2015年12月新疆医科大学附属中医医院收治的资料齐全的寻常性银屑病患者。
1.1.1 纳入及排除标准 纳入标准[8]:①临床症状符合寻常型银屑病的诊断标准[1];②皮损面积≥10%且病情严重程度评分(psoriasis area and severity index,PASI)≥10分的中、重度患者;③入院前3个月内未曾使用皮质激素类、免疫抑制剂等药物;④对本研究知情且同意。本研究获该院伦理委员会批准实施。排除标准:①妊娠及处于哺乳期的妇女;②合并严重内科疾病及其他系统疾病者;③合并红斑狼疮、天疱疮、皮肌炎及风湿关节炎等自身免疫性疾病者;④不配合治疗、中途退出者;⑤对退银汤及紫外线过敏者。
1.1.2 分组 根据上述纳入及排除标准,共有126例患者符合要求,按照入院顺序随机分为中医对照组、NB-UVB对照组及研究组,每组各42例。中医对照组:男性25例,女性17例;年龄17~62岁,平均(38.3±5.7)岁;病程2个月~16年,平均(49.4±11.4)个月。NB-UVB对照组:男性23例,女性19例;年龄20~64岁,平均(39.7±6.1)岁;病程5个月~15年,平均(51.1±10.6)个月;研究组:男性25例,女性17例;年龄22~68岁,平均(39.1±6.4)岁;病程8个月~14.5年,平均(50.4±10.1)个月。3组一般资料比较,差异无统计学意义(P>0.05),具有可比性。另选取40例体检者为健康对照组,男性23例,女性17例;年龄18~58岁,平均(39.1±5.9)岁。
1.2 治疗方法
中医对照组内服燥湿苦参汤,方剂包括:蒲公英、土茯苓、乌梢蛇、薏苡仁各30 g,苍术、金银花、白鲜皮各20 g,萆薢、连翘、猪苓各15 g,苦参、泽泻各10 g。以上方剂每方煎煮2次,内服,2次/d,每次100 ml。连服6 d,停1 d,疗程12周。研究组在此基础上对皮损局部进行NB-UVB照射,2次/周,UVB峰值311 nm。初始剂量0.5 J/cm2,每次照射在前1次剂量上增加10%~20%,直至患者出现红斑反应,疗程12周。NB-UVB对照组仅进行NB-UVB照射治疗,照射治疗方法同研究组。
1.3 临床疗效评价
治疗过程中,每4周进行复诊,评价PASI评分、记录不良反应。临床疗效指数按皮损范围、严重程度进行评分,在PASI评分系统里,病情严重程度按无、轻度、中度、重度、极重度分别计0~4分。疗效指数(%)=(治疗前PASI评分-治疗后PASI评分)/治疗前PASI评分×100%。临床疗效的判断方法为:痊愈,疗效指数≥90%;显效,疗效指数60%~89%;好转,疗效指数20%~59%;无效,疗效指数<20%。有效率=(痊愈例数+显效例数)/总数×100%。
1.4 试剂与仪器
异硫氰酸荧光素(FITC)标记-抗人CD3单克隆抗体、藻红蛋白青色素5.1(PC5)标记-抗人CD4单克隆抗体(美国Beckman公司),ELISA试剂盒(美国R&D公司),细胞裂解液(日本TaKaRa公司),EPICSXL型流式细胞仪(美国Coulter公司)。
1.5 血清细胞因子检测
受检者清晨空腹静脉采血6 ml,分为2份。其中一份置于肝素钠抗凝管中,用于Treg细胞、Th17细胞的检测。另一份置于EDTA抗凝管中用于逆转录聚合酶链反应(reverse transcription-polymerase chain reaction, RT-PCR)和酶联免疫吸附测定(enzyme-linked immuno sorbent assay, ELISA)。
1.5.1 检测Th17、Treg细胞的表达 先以密度梯度离心法对血液标本进行外周单个核细胞分离,然后将处理好的单核细胞加入异硫氰酸荧光素(FITC)标记-抗人CD3单克隆抗体10 μl,藻红蛋白青色素5.1(PC5)标记-抗人CD4单克隆抗体5 μl,充分混匀,进行Th 17细胞的胞外染色。以RPMI 1640培养体系重悬细胞,然后依次进行固定破膜(Intraprep-ⅡPermeabilization破膜液)。将破膜后的细胞悬液平均分成2管,其中一管作为对照加入IL-17同型-PE 5 μl,另一管加入IL-17-PE 5 μl,室温避光孵育20 min,并以PBS清洗后待检。取2支试管,分别设为对照管和样本管,分别加入100 μl肝素钠抗凝的外周血,每管加FITC标记抗人CD4抗体10 μl,PC5标记抗人CD25抗体5 μl,避光孵育20 min后加入溶血剂进行溶血。然后依次进行Treg细胞的固定破膜,对照管加入PE标记抗人Foxp3同型5 μl,样本管加入PE标记抗人Foxp 3 5 μl,室温避光孵育20 min,并以PBS清洗后待检。最后以EPICSXL型流式细胞仪检测标本,每份标本检测细胞数5 000个以上,在前向和侧向散色光的散点图中对淋巴细胞群进行圈定,CD3、CD4双阳性细胞中IL-17-PE的表达量即Th17的表达,CD4、CD25双阳性细胞中Foxp3-PE的表达量即Treg细胞的表达。
1.5.2 检测 Foxp3、ROR γt mRNA 的表达 首先根据GeneBank公司公布的PTEN基因序列设计合成Foxp3、RORγt的正反向引物(见表1)。序列由百奥迈科生物技术有限公司合成。
然后以Trizol法对外周血单核细胞进行RNA的提取,以紫外分光光度计检测RNA标本的纯度。然后合成逆转录cDNA,RT-PCR扩增目标DNA35个循环后,取产物5 μl进行琼脂糖电泳(恒定50 mV,20 mA,30 min)并进行凝胶成像系统扫描,检测基因与内参照条带(β-actin,正向引物:5'-TCATGAAGTGTGAGGTTGACATCCGT-3',反向引物:5'-CCTAGAAGCATTTGCGGTGCACGAT G-3')灰度值的比值则为该基因mRNA的表达水平。
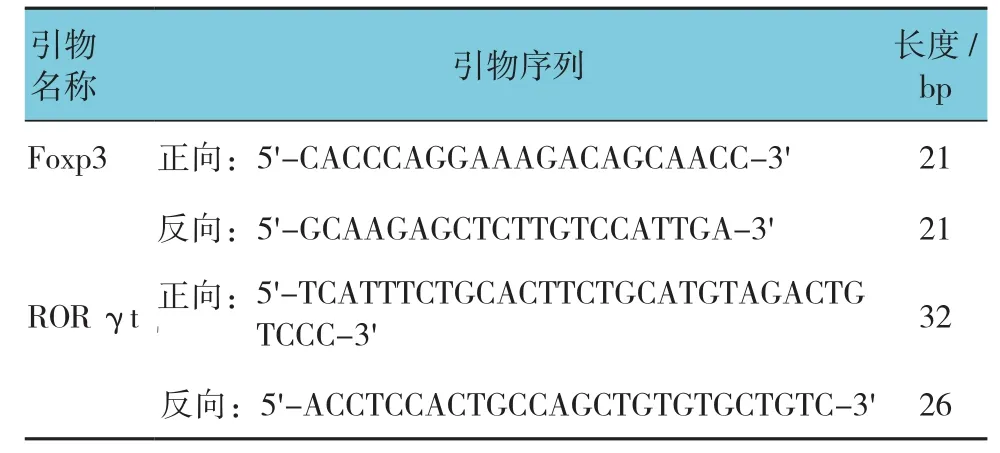
表1 引物序列
1.5.3 检测IL-17、TGF-β的表达 血清IL-17、TGF-β的检测均以ELISA法进行。
1.6 统计学方法
数据分析采用SPSS 15.0统计软件,计量资料以均数±标准差(±s)表示,两两比较行配对t检验,多组间比较采用方差分析,不同时间点比较采用重复测量方差分析,计数资料用%表示,比较用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 临床疗效比较
2.1.1 3组PASI评分比较 3组治疗前、治疗4、8及12周后的PASI评分比较,采用重复测量设计的方差分析,结果:①不同时间PASI评分有差异(F=12.095,P=0.000),治疗8和12周后,各组的PASI评分依次下降;②3组PASI评分有差异(F=14.080,P=0.000),研究组评分低于中医对照组与NB-UVB对照组;③3组的PASI评分变化趋势有差异(F=23.523,P=0.000)。见表 2。
2.1.2 3组痊愈、显效例数及总有效率比较 3组治疗4、8及12周的痊愈、显效例数及总有效率依次升高,其中12周治疗结束后研究组的总有效率高于中医对照组与NB-UVB对照组,差异有统计学意义(χ2=9.612,P=0.022)。中医对照组与NB-UVB对照组治疗后各时间比较,差异无统计学意义(P>0.05),但中医对照组的有效率较高。见表3。
2.2 Th17、Treg细胞的表达
4组Th17、Treg细胞表达的比较见表4。与健康对照组比较,3组治疗前外周血Th17细胞的比例均升高,而Treg细胞的比例降低,差异有统计学意义(P<0.05)。治疗12周后,3组的Th17表达均较治疗前下降,Treg表达较治疗前升高,差异有统计学意义(P<0.05);其中,研究组Th17表达下降及Treg表达升高的程度高于中医对照组与NB-UVB对照组(t=5.881、6.052、5.632 和 6.011,P=0.018、0.000、0.016和0.001),其治疗后的表达与健康对照组差异无统计学意义(P>0.0.5)。
表2 3组 PASI评分比较 (n =42,±s)
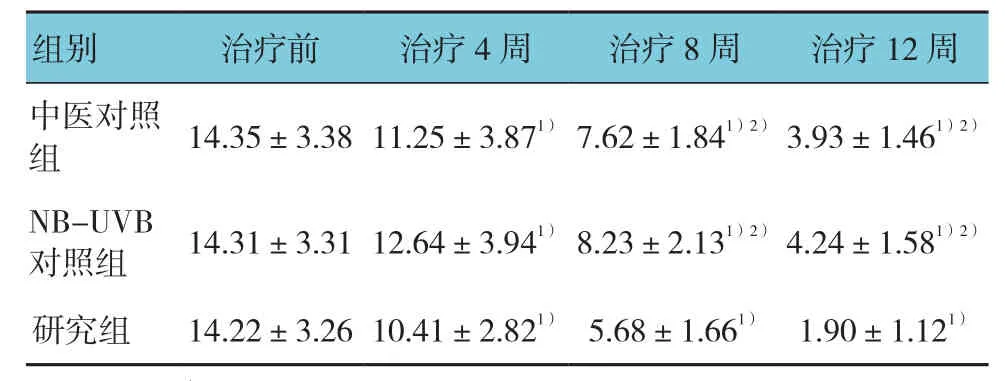
表2 3组 PASI评分比较 (n =42,±s)
注:1)与治疗前比较,P <0.05;2)与研究组比较,P <0.05
组别 治疗前 治疗4周 治疗8周 治疗12周中医对照组 14.35±3.38 11.25±3.871) 7.62±1.841)2) 3.93±1.461)2)NB-UVB对照组 14.31±3.31 12.64±3.941) 8.23±2.131)2) 4.24±1.581)2)研究组 14.22±3.26 10.41±2.821) 5.68±1.661) 1.90±1.121)
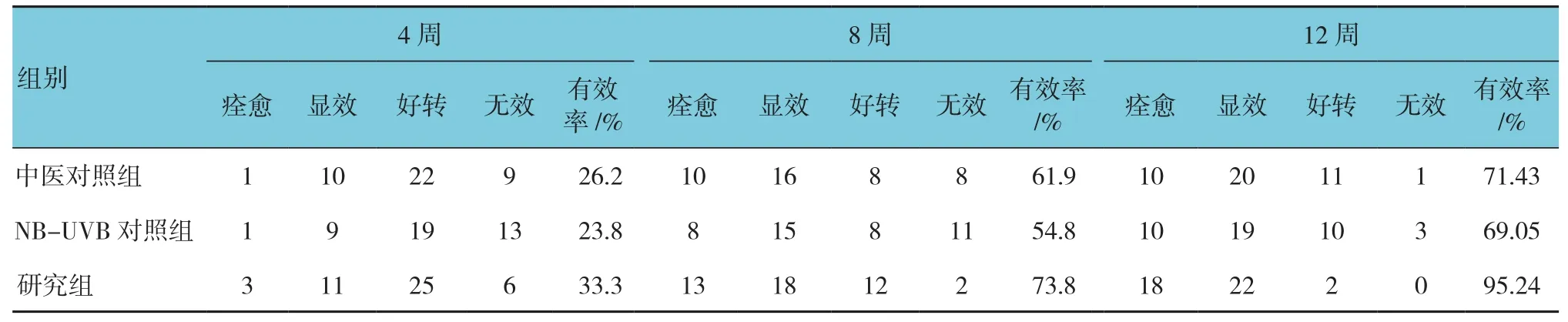
表3 3组临床疗效比较(n =42)
表4 各组治疗前后外周血中Th17、Treg细胞的表达比较(%,±s)
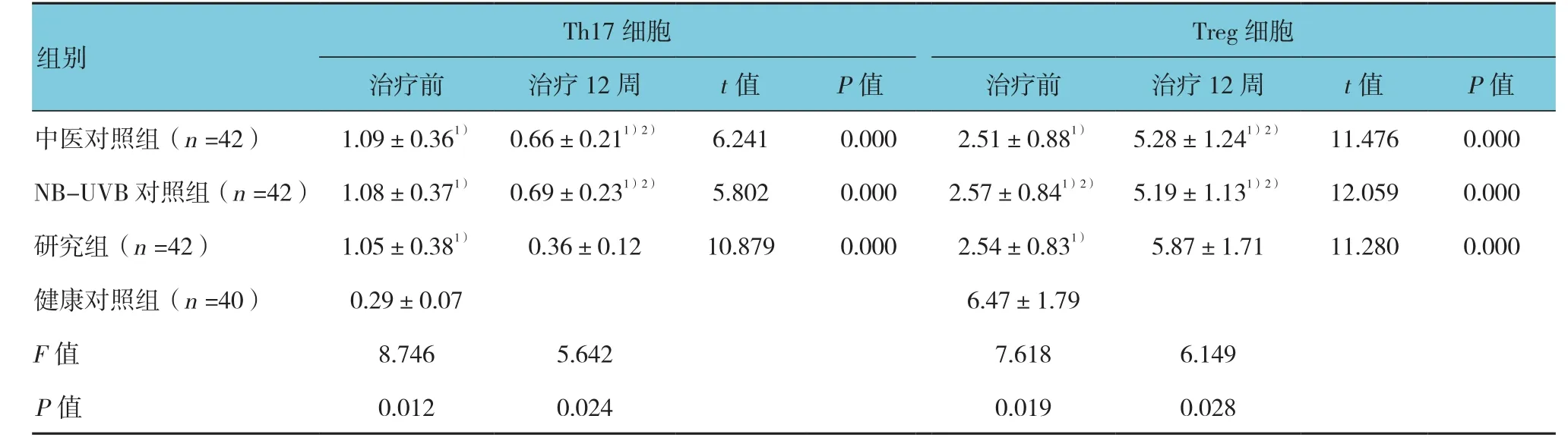
表4 各组治疗前后外周血中Th17、Treg细胞的表达比较(%,±s)
注:1)与健康对照组比较,P <0.05;2)与研究组比较,P <0.0.5
Treg细胞治疗前 治疗12周 t值 P值 治疗前 治疗12周 t值 P值中医对照组(n =42) 1.09±0.361) 0.66±0.211)2) 6.241 0.000 2.51±0.881) 5.28±1.241)2) 11.476 0.000 NB-UVB 对照组(n =42) 1.08±0.371) 0.69±0.231)2) 5.802 0.000 2.57±0.841)2) 5.19±1.131)2) 12.059 0.000研究组(n =42) 1.05±0.381) 0.36±0.12 10.879 0.000 2.54±0.831) 5.87±1.71 11.280 0.000健康对照组(n =40) 0.29±0.07 6.47±1.79 F值 8.746 5.642 7.618 6.149 P值 0.012 0.024 0.019 0.028 Th17细胞组别
2.3 转录因子的表达
与健康对照组比较,3组治疗前RORγt mRNA的水平均升高,而Foxp3 mRNA的水平降低,差异有统计学意义(P<0.05)。治疗12周后,3组的RORγt mRNA表达均较治疗前下降,Foxp3 mRNA表达较治疗前升高,差异有统计学意义(P<0.05);其中,研究组ROR γt mRNA表达下降的程度高于中医对照组与NB-UVB对照组(t=5.881和 6.052,P=0.011和 0.26);3组 治 疗 后 Foxp3 mRNA表达与健康对照组差异无统计学意义(P>0.05)。见表 5。
2.4 分泌因子的表达
与健康对照组比较,各组治疗前IL-17水平均升高,而TGF-β水平降低,差异有统计学意义(P<0.05)。治疗12周后,3组的IL-17表达均较治疗前下降,TGF-β较治疗前升高,差异有统计学意义(P<0.05);其中,研究组IL-17下降及TGF-β升高的程度高于中医对照组与NB-UVB对照组(t=7.055、7.642、9.963和9.481,P=0.008、0.002、0.000和0.000),其治疗后与健康对照组差异无统计学意义(P>0.05)。见表6。
表5 各组治疗前后的Foxp3、ROR γt mRNA的表达比较(±s)

表5 各组治疗前后的Foxp3、ROR γt mRNA的表达比较(±s)
注:1)与健康对照组比较,P <0.05;2)与研究组比较,P <0.0.5
Foxp3治疗前 治疗12周 t值 P值 治疗前 治疗12周 t值中医对照组(n =42) 0.85±0.201) 0.73±0.131)2) 3.260 0.002 0.41±0.081) 0.47±0.06 3.888 NB-UVB对照组(n =42) 0.88±0.171) 0.75±0.151)2) 3.716 0.000 0.41±0.081) 0.49±0.07 4.877研究组(n =42) 0.84±0.211) 0.69±0.11 4.101 0.000 0.41±0.081) 0.48±0.06 4.537健康对照组(n =40) 0.61±0.06 0.52±0.05 F值 7.564 6.555 22.424 3.886 P值 0.024 0.019 0.000 0.164 ROR γt组别P值0.000 0.000 0.000
表6 各组治疗前后IL-17、TGF-β的表达比较(pg/ml,±s)
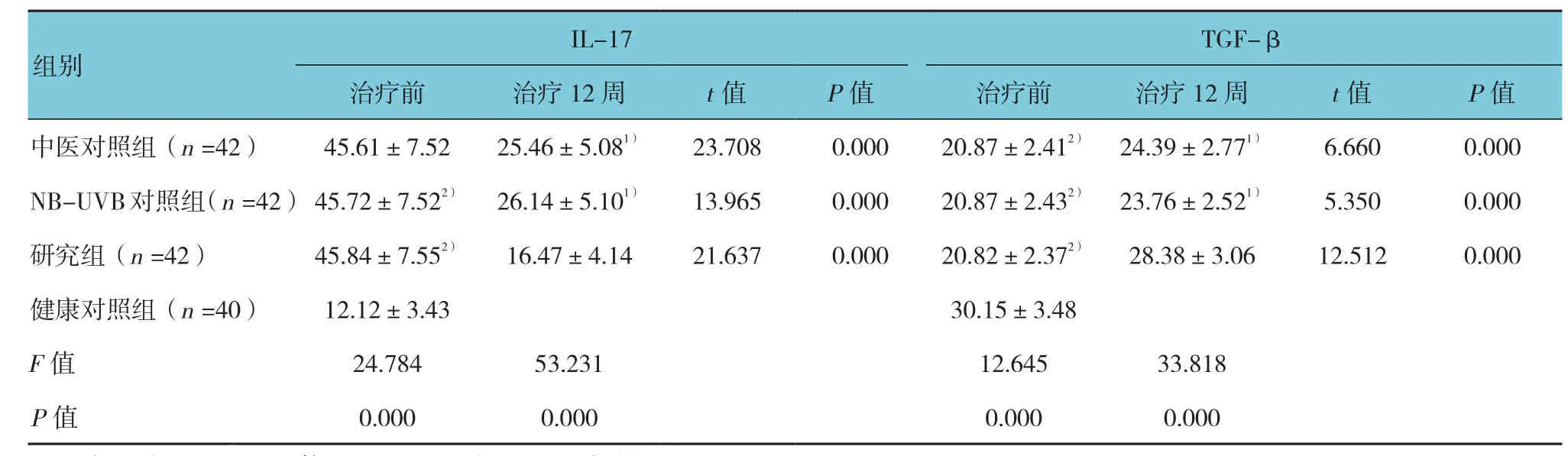
表6 各组治疗前后IL-17、TGF-β的表达比较(pg/ml,±s)
注:1)与研究组比较,P <0.0.5;2)与健康对照组比较,P <0.05
TGF-β治疗前 治疗12周 t值 P值 治疗前 治疗12周 t值 P值中医对照组(n =42) 45.61±7.52 25.46±5.081) 23.708 0.000 20.87±2.412) 24.39±2.771) 6.660 0.000 NB-UVB对照组(n =42) 45.72±7.522) 26.14±5.101) 13.965 0.000 20.87±2.432) 23.76±2.521) 5.350 0.000研究组(n =42) 45.84±7.552) 16.47±4.14 21.637 0.000 20.82±2.372) 28.38±3.06 12.512 0.000健康对照组(n =40) 12.12±3.43 30.15±3.48 F值 24.784 53.231 12.645 33.818 P值 0.000 0.000 0.000 0.000 IL-17组别
2.5 不良反应
中医对照组4例(4/42,9.5%)患者在第1周内出现轻微腹泻,考虑与退银汤方剂中的清热药有关。NB-UVB对照组3例(3/42,7.1%)患者出现轻微的光照副反应。研究组也有4例(4/42,9.5%)存在轻微腹泻反应,此外还有2例患者出现轻微的光照副反应,主要表现瘙痒感。3组均未出现血、尿、肝肾功能异常,不良反应发生率差异无统计学意义(χ2=0.050,P=0.840)。
3 讨论
CD4+CD25+Treg细胞是一种免疫性抑制细胞,是机体天然免疫的重要组成部分,在防止自身免疫性疾病方面发挥重要作用[11-12]。Fox3转录因子特异性表达于Treg细胞,主要对Treg细胞发育及发挥功能的过程起调控作用。Treg细胞约占正常人外周血CD4+T细胞的5%~10%,主要依靠分泌TGF-β因子来介导免疫反应。TGF-β因子主要发挥Treg细胞的免疫耐受性的诱导和维持功能[13-14]。Th17是一种有别于Th1与Th2的Th细胞亚群,主要以分泌IL-17为特征,可诱导自身免疫性脑脊髓炎(EAE)等多种自身免疫性疾病。RORγt是调控Th17细胞分化的关键转录因子,主要诱导IL-17的基因表达[15-16]。在不同的细胞因子环境中,天然的初始CD4+T细胞可通过上述不同途径向Treg细胞或Th17细胞分化,两者存在动态平衡关系,并且在功能上相互拮抗。低剂量的TGF-β可诱导初始CD4+T细胞向Th17细胞分化,促进IL-17、IL-6等相关细胞因子的分泌,诱导角质形成细胞过度增殖、中性粒细胞聚集,引起皮损部位炎症细胞大量浸润、毛细血管扩张,进而导致表皮过度增殖[17];上述过程也被认为是银屑病发病的重要原因[17]。另一方面,高剂量的TGF-β又可抑制Th17细胞的分化,促进Treg细胞的分化,抑制Th17细胞的增殖和功能来维持免疫耐受,从而抑制炎症反应。
本研究比较寻常性银屑病患者治疗前后的外周血Th17细胞比例及其特异性转录因子RORγt mRNA、分泌因子IL-17,Treg细胞的比例及其特异性转录因子Foxp3 mRNA、分泌因子TGF-β的表达水平。结果表明,相对于健康对照组,银屑病患者的外周血Th17细胞、RORγt mRNA、IL-17的表达均显著升高,而Treg细胞、Foxp3 mRNA、TGF-β的表达则显著降低,这与国内外的相关研究结果一致[15-19]。上述结果证实,银屑病患者外周血及皮损区的Th17、Treg细胞及其相关细胞因子均存在异常表达,表现为Th17细胞的过度分化和优势应答,以及Treg细胞数量与功能的缺失。银屑病患者Th17细胞的优势应答可介导血清高炎症反应[15,17,19],但Treg细胞的低表达导致其免疫抑制功能减弱,从而无法阻止炎症的发展,再次验证Th17/Treg的表达失衡是银屑病的发病的重要原因。
中医学认为寻常性银屑病属“白疕”,其外在病因主要为皮肤及肌肉的纹理遭受风寒湿热的侵入,而内在原因则为饮食行为不规律、情绪不良等[8-9]。因此,临床治疗应以清热凉血、通畅血脉、养阴补虚润燥为主。本研究的中医对照组以燥湿苦参汤单用治疗中重度寻常型银屑病,12周后,其PASI评分下降,有效率超过80%,说明燥湿苦参汤对于寻常型银屑病具有确切疗效,可显著改善其临床症状。燥湿苦参汤方剂中的苍术、黄柏、薏苡仁具有清热排湿的作用,与土茯苓一起服用可解毒除湿消肿,促进经脉通畅;另外,萆薢、猪苓可祛除体内湿邪之毒,而联合泽泻则可促进其排出体内;此外,白鲜皮、金银花、连翘除具有清热解毒之效外,还可祛除风寒,并具有良好的止痒效果,缓解患者皮肤瘙痒症状[9]。可见,燥湿苦参汤主要是从“除湿解毒”方面达到治疗寻常型银屑病的理想疗效的。
NB-UVB是紫外线照射的一种,其穿透性强,皮肤损伤小,致癌性低,因而被广泛应用于银屑病的治疗[16]。本文NB-UVB对照组仅进行NB-UVB照射治疗,其治疗后各指标与中医对照组均无统计学差异,但均稍差于中医对照组。说明NB-UVB照射治疗的疗效基本与燥湿苦参汤相当。
近年来,中西医结合疗法受到医学工作者的推崇,在寻常性银屑病的治疗中发挥越来越重要的作用[6]。本文研究组以燥湿苦参汤方剂结合NB-UVB照射的中西医结合疗法治疗中重度寻常性银屑病,其治疗后的PASI评分低于中医对照组,总有效率高于中医对照组与NB-UVB对照组,说明湿苦参汤方剂结合NBUVB对于寻常性银屑病的治疗效果比两者单用更佳。此外,3组患者治疗后的Th17细胞的相关因子表达均较治疗前下降,而Treg细胞相关因子表达较治疗前升高,差异有统计学意义,说明湿苦参汤方剂结合NB-UVB可抑制Th17细胞亚群抗原的传递过程,抑制Th17细胞的分化,促进Treg细胞的分化,从而恢复Treg/Th17细胞的动态平衡。当Treg细胞的数量与功能恢复正常时,患者的免疫耐受性得到增强,从而介导其对银屑病的免疫作用,达到理想的临床疗效。
