美托洛尔对急性心肌梗死大鼠心肌损伤及c-fos信号通路的影响
2018-11-15徐燕
徐燕
(北京王府中西医结合医院 心内科,北京 100049)
急性心肌梗死(acute myocardial infarction, AMI)是冠状动脉突发持续缺血缺氧而造成的心肌坏死急症,严重影响患者身心健康[1]。有关研究认为[2],原癌基因c-fos与心血管疾病密切相关,c-fos是细胞响应外界刺激最先表达的基因,其编码蛋白c-fos不能直接发挥作用,只有与c-Jun蛋白结合成激活蛋白转录因子1(activator protein transcription factor-1, AP-1),才能激活靶基因的转录表达。突发心肌缺血时,c-fos能即刻快速表达,它在将刺激转换为胞内信号过程中发挥很重要的作用[3]。MAPK家族成员ERK1/2(extracellular regulated protein kinases 1/2)是将胞外刺激信号传递到胞内的共同通路,ERK1/2自我磷酸化后可通过磷酸化Elk-1(Ets-like protein-1),进而诱导c-fos的转录[4]。美托洛尔是临床常用选择性β1-受体阻滞药,其能降低心脏做功从而减少心肌需氧,在治疗AMI时,它能有效缓解胸痛,缩小梗死面积,延缓心力衰竭进程,但目前关于美托洛尔治疗AMI的具体作用机制尚不完全明确[5-6]。本研究通过复制AMI大鼠模型,在AMI大鼠服用美托洛尔后检测ERK1、ERK2、c-fos的表达情况,探究美托洛尔减轻AMI大鼠心肌损伤的分子机制。
1 材料与方法
1.1 实验材料
1.1.1 实验动物 SPF级SD雄性大鼠150只,平均体重(328±20)g,购自北京维通利华公司。
1.1.2 主要试剂和仪器 酒石酸美托洛尔(英国阿斯利康制药公司,批准文号:国药准字H32025390)。肝素钠注射液(南京新百药业有限公司,批准文号:国药准字H32025851)。RNA提取试剂盒(美国 Invitrogen公司)。buffer、dNTPs、RNase抑制剂、M-MLV[宝生物工程(大连)有限公司]。蛋白提取试剂(南京凯基生物公司)。c-Fos、ERK1/2、p-ERK1/2兔抗大鼠IgG溶液(一抗溶液)(美国Sigma公司)。碱磷酶标记山羊抗兔IgG溶液(二抗溶液)(美国Sigma公司)。实时荧光定量聚合酶链反应(qRT-PCR)仪(美国Beckman Couhe公司),GIS-2020数码图像分析系统(上海精密仪器仪表有限公司)。
1.2 动物模型复制
本研究参考尹倪等[7]方法复制AMI模型。从150只大鼠中随机取128只复制AMI模型,用1%戊巴比妥钠(40 mg/kg)腹腔麻醉,仰卧固定于手术台后气管插管,连接SAR-830小动物呼吸机(美国CWE公司)辅助呼吸。于胸部4、5肋间开胸,在肺动脉圆锥和左心耳间下方1~2 mm处迅速结扎左冠状动脉前降支,缝合伤口,撤走呼吸机。12导联同步记录心电图仪监测大鼠心电图示Ⅰ、Ⅱ、Ⅲ、aVR、aVL、aVF导联ST段抬高≤0.5 mV,确定复制模型成功。为防止感染,术后3 d内腹腔注射青霉素。剩余22只行假手术,仅在左冠状动脉前降支穿线而不结扎,其他操作同上。
1.3 分组与给药处理
128只大鼠中成功复制90只,死亡38只,将符合AMI模型的90只AMI大鼠随机分为模型组、肝素组及美托洛尔组,每组各30只。另外22只行假手术的大鼠为假手术组。美托洛尔组在术后24 h直接灌胃给予0.1%美托洛尔生理盐水10 mg/(kg·d),肝素组皮下注射给予肝素1 250 u/kg,模型组和假手术组直接灌胃给予等量生理盐水,所有组均为10 ml/kg,1次/d。
1.4 超声心动图检测
术后48 h和4周,将大鼠用1%戊巴比妥钠(40 mg/kg)腹腔麻醉,仰卧固定,采用高分辨率超声仪检测大鼠心率(heart rate, HR)、射血分数(ejection fraction, EF)、短轴缩短率(fractional shortening, FS)、左心室舒张末期内径(left ventricular end-diastolic dimension, LVIDd)、左心室收缩末期内径(left ventricular end-systolic dimension, LVIDs)各值,测量3次,求取平均值。
1.5 心脏标本的处理
术后4周超声检测结束后处死大鼠,剖胸取出心脏,用于制作心脏标本。每组大鼠的心脏标本随机分为两部分:液氮冻存与灌注4%多聚甲醛固定,将心脏标本沿左室长轴垂直方向切成3份,取中间部分制作成Masson病理切片,然后用显微镜图像处理系统扫描切片,依次量取左室截面外周长、瘢痕弧长与内周长,心肌梗死面积(%)=2×瘢痕弧长/(外周长+内周长)×100%。
1.6 TUNEL法检测心肌凋亡细胞
每组剖胸取出心脏后,用PBS洗净血液,浸没于4%多聚甲醛中,过夜,用30%蔗糖使心脏脱水下沉,接着在冷冻下进行切片,TUNEL染色后,用荧光显微镜观察并拍照。
1.7 qRT-PCR检测c-fos、ERK1、ERK2 mRNA表达
以GAPDH作为内参基因,用NCBI Primer Blast设计定量引物序列(由上海生工生物工程股份有限公司合成),引物序列见表1。

表1 引物序列
每组4只液氮冷冻保存的心脏组织,利用Trizol法提取RNA,经琼脂糖凝胶电泳检测其完整性,并用紫外分光光度计检测其纯度及浓度。取1.0μg总RNA,加入 Oligo(dT)1.0μl,加入13μl RNase-free H2O,混匀后,于85℃金属浴中保温5 min使RNA变性,然后放在冰上1 min以防RNA复性;然后继续加入 4.0μl 5×buffer、2.0μl 10 mmol/L dNTPs、0.5μl RNase抑制剂、0.5μl M-MLV,混匀后30℃保温10 min,42℃保温1 h,85℃保温10 min。合成cDNA第一链后,取5μl cDNA(稀释20倍)为模板,加入10μl 2×SYBR Green qPCR Super Mix、0.5μlGAPDH(c-fos、ERK1或ERK2)正反向引物、4.0~20μl ddH2O,在qRT-PCR仪上扩增。反应条件:95℃ 30 s预变性,95℃ 5 s,60℃ 35 s,扩增40个循环。实验进行3次生物学重复。采用 2-ΔΔCt法分析 qRT-PCR 结果,ΔCt=(Ct目的基因-Ct内参基因)±s;ΔΔCt=(ΔCt目的基因-ΔCt内参基因)±s。
1.8 Western blot检测
每组取4只大鼠心脏组织,充分研磨后使用组织蛋白提取试剂提取蛋白质。每组样品取50μl,用Lowry法进行蛋白定量,调节好蛋白浓度;将胞浆蛋白通过SDS-PAGE分离上清液,把分离的蛋白质转印到硝酸纤维素膜上;将膜在1×TBS中浸泡10 min后,在5%牛血清蛋白溶液中封闭1 h,用1×TTBS洗涤2次,接着将膜分别置于在1︰100的c-Fos、ERK1/2、p-ERK1/2兔抗大鼠IgG溶液(一抗溶液)中,4℃孵育过夜;次晨将膜依次用1×TBS、1×TTBS快速清洗后,转移到1︰1 000碱磷酶标记山羊抗兔IgG溶液(二抗溶液)中在室温下孵育2 h,依次用1×TTBS、1×TBS清洗后,用新配制的显色液进行显色,待出现清晰的条带后终止,最后使用GIS-2020数码图像分析系统扫描并分析蛋白杂交条带。
1.9 统计学方法
数据分析采用SPSS 20.0统计软件,计量资料符合正态分布以均数±标准差(±s)表示,多组间比较采用单因素方差分析,差异有统计学意义后,两组间均数比较采用SNK-q检验,P<0.05为差异有统计学意义。
2 结果
2.1 模型成功复制
从150只大鼠中随机取128只复制AMI模型,成功复制90只,死亡38只,且多在复制后24 h内死亡;其余22只大鼠行假手术,死亡2只。将复制成功的90只大鼠随机分为模型组、肝素组和美托洛尔组,每组各30只。AMI大鼠行肉眼观察及心电图检测发现,结扎左冠状动脉前降支后,结扎处下方心肌颜色即刻变浅,局部心肌活动变缓,心电图各肢体导联ST段抬高≤0.5 mV,为复制模型成功的表现。
2.2 美托洛尔对AMI大鼠左心室功能的影响
AMI术后48 h和4周,与假手术组、模型组比较,肝素组和美托洛尔组大鼠心率下降(P<0.05)。术后48 h,与假手术组比较,模型组、肝素组和美托洛尔组大鼠心脏EF、FS值均下降(P<0.05)。术后4周,与模型组比较,肝素组和美托洛尔组大鼠心脏EF、FS值均提高(P<0.05)。术后48 h,与假手术组比较,模型组、肝素组和美托洛尔组大鼠心脏LVIDd、LVIDs均增大(P<0.05)。术后4周,与模型组比较,肝素组和美托洛尔组大鼠心脏LVIDd、LVIDs均降低(P<0.05)。美托洛尔组超声心动图各指标与肝素组间的差异无统计学意义(P>0.05)。假手术组未出现心肌梗死,与模型组比较,肝素组和美托洛尔组大鼠心肌梗死面积减小(P<0.05)。见表2。
表2 各组大鼠超声心动图检测结果(±s)
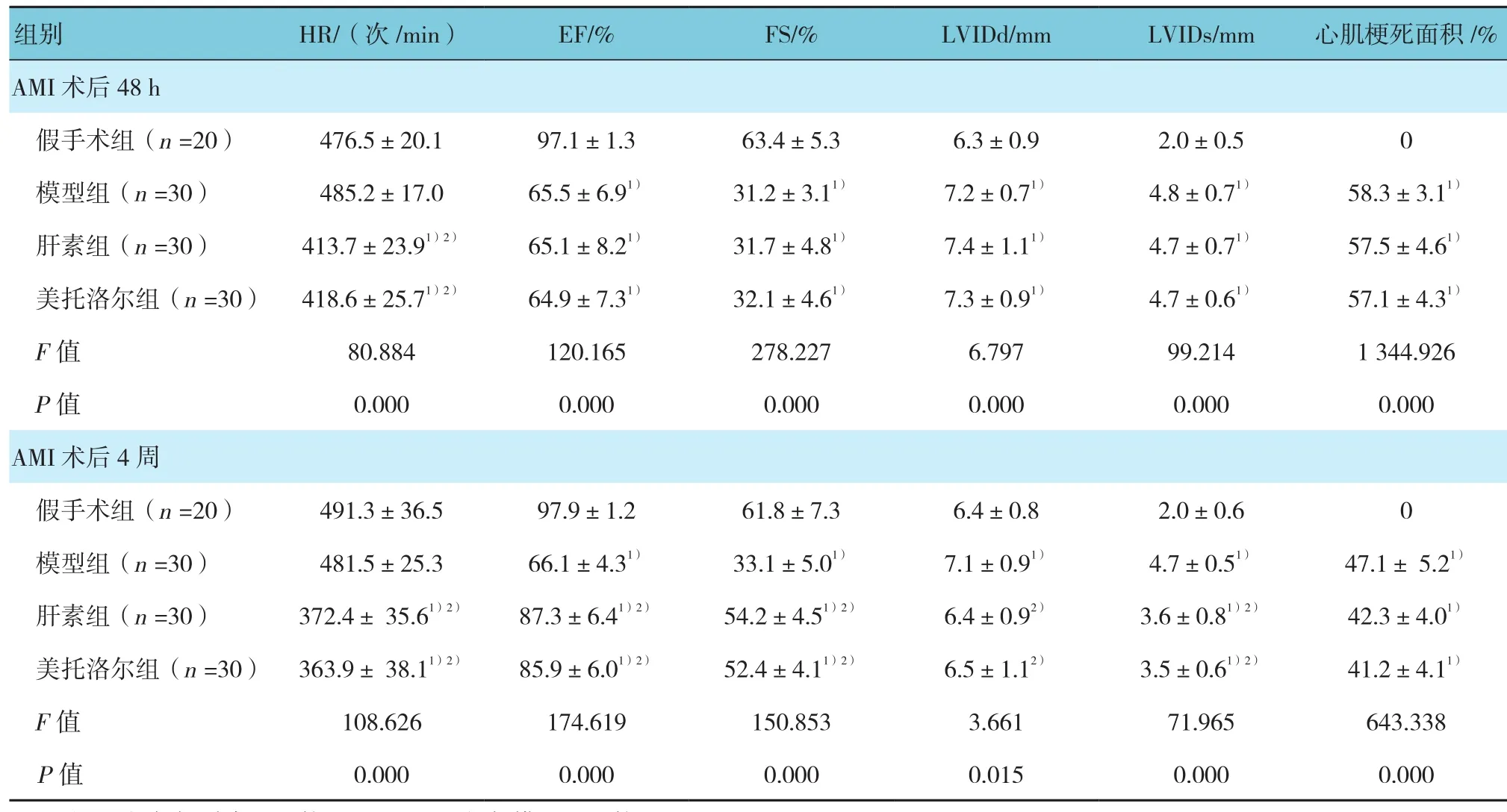
表2 各组大鼠超声心动图检测结果(±s)
注:1)与假手术组比较,P <0.05;2)与模型组比较,P <0.05
组别 HR/(次/min) EF/% FS/% LVIDd/mm LVIDs/mm 心肌梗死面积/%AMI术后48 h假手术组(n =20) 476.5±20.1 97.1±1.3 63.4±5.3 6.3±0.9 2.0±0.5 0模型组(n =30) 485.2±17.0 65.5±6.91) 31.2±3.11) 7.2±0.71) 4.8±0.71) 58.3±3.11)肝素组(n =30) 413.7±23.91)2) 65.1±8.21) 31.7±4.81) 7.4±1.11) 4.7±0.71) 57.5±4.61)美托洛尔组(n =30) 418.6±25.71)2) 64.9±7.31) 32.1±4.61) 7.3±0.91) 4.7±0.61) 57.1±4.31)F值 80.884 120.165 278.227 6.797 99.214 1 344.926 P值 0.000 0.000 0.000 0.000 0.000 0.000 AMI术后4周假手术组(n =20) 491.3±36.5 97.9±1.2 61.8±7.3 6.4±0.8 2.0±0.6 0模型组(n =30) 481.5±25.3 66.1±4.31) 33.1±5.01) 7.1±0.91) 4.7±0.51) 47.1± 5.21)肝素组(n =30) 372.4± 35.61)2) 87.3±6.41)2) 54.2±4.51)2) 6.4±0.92) 3.6±0.81)2) 42.3±4.01)美托洛尔组(n =30) 363.9± 38.11)2) 85.9±6.01)2) 52.4±4.11)2) 6.5±1.12) 3.5±0.61)2) 41.2±4.11)F值 108.626 174.619 150.853 3.661 71.965 643.338 P值 0.000 0.000 0.000 0.015 0.000 0.000
2.3 美托洛尔对AMI大鼠心肌损伤的影响
用显微镜观察Masson染色结果,红色代表正常心肌细胞,蓝色代表胶原纤维。术后4周,假手术组心肌细胞分布整齐,胶原增生不多。与假手术组比较,模型组大鼠心肌梗死边缘的细胞杂乱分布,间质中大量胶原增生,心肌纤维化水平升高。与模型组比较,肝素组和美托洛尔组蓝色胶原减少,心肌纤维化水平降低。见图1。
2.4 美托洛尔对AMI大鼠心肌细胞凋亡的影响
TUNEL结果显示,AMI术后4周,与假手术组比较,模型组大鼠心肌梗死周边细胞的凋亡率增加(P<0.05)。与模型组比较,肝素组和美托洛尔组大鼠心肌梗死周边细胞的凋亡率降低(P<0.05)。见图2。

图1 AMI大鼠4周后心肌细胞(Masson染色×200)
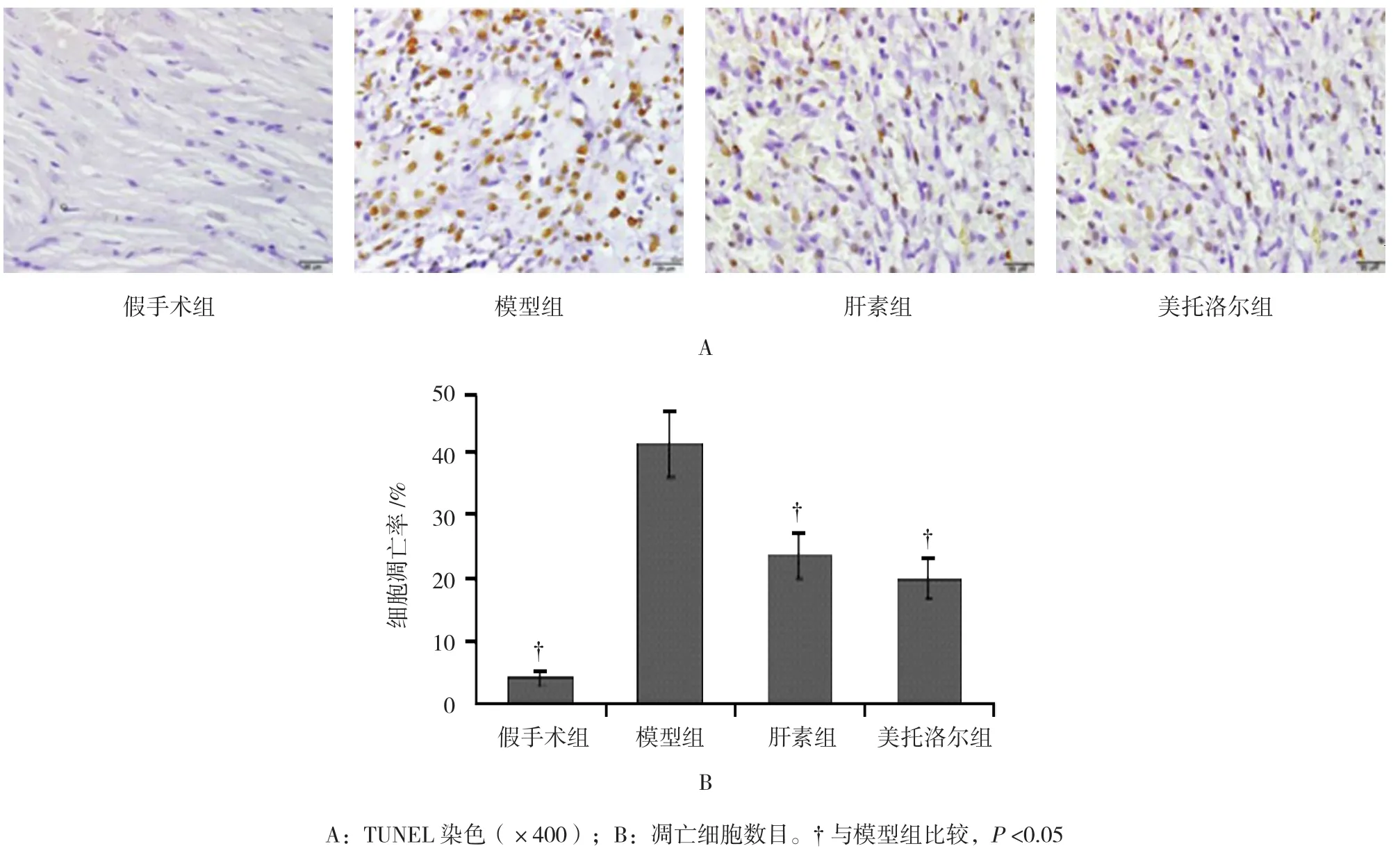
图2 美托洛尔对AMI大鼠4周后心肌细胞凋亡的影响
2.5 美托洛尔对AMI大鼠心肌细胞c-fos、ERK1、ERK2 mRNA表达的影响
qRT-PCR结果显示,AMI术后4周,模型组大鼠心肌细胞c-fos、ERK1、ERK2 mRNA表达高于假手术组(P<0.05);肝素组、美托洛尔组大鼠心肌细胞c-fos、ERK1、ERK2 mRNA表达低于模型组(P<0.05)。见图3。
2.6 美托洛尔对AMI大鼠心肌细胞c-fos、ERK1/2及磷酸化ERK1/2蛋白表达的影响

图3 AMI大鼠4周后心肌细胞c-fos、ERK1、ERK2 mRNA表达
Western blot结果显示,AMI术后4周,ERK1/2蛋白表达各组间比较差异无统计学意义(P>0.05)。模型组大鼠心肌细胞c-fos、p-ERK1/2蛋白表达高于假手术组(P<0.05)。肝素组、美托洛尔组大鼠心肌细胞 c-fos、p-ERK1/2 蛋白表达低于模型组(P<0.05)。见图4。

图4 AMI大鼠4周后心肌细胞c-fos、ERK1/2、p-ERK1/2蛋白表达
3 讨论
AMI是一种很常见的心血管急症,虽在西方国家最为常见,但其在中国发病率逐年上升。世界卫生组织(WHO)预测,到2020年AMI将成为全球第一大导致死亡原因[8]。临床上常用β-受体阻滞剂治疗AMI,其能拮抗儿茶酚胺与β-肾上腺素受体竞争性结合,从而阻断兴奋和激动的传递[9-11]。美托洛尔作为一种选择性β1-受体阻滞药,在治疗AMI时能降低心脏做功,减少心肌需氧,进而减轻心肌损伤程度[12-13]。本研究发现AMI术后左心室相关指数发生一系列的变化,4周后Masson和TUNEL结果显示:肝素、美托洛尔治疗后心肌蓝色胶原减少,心肌纤维化水平降低,且大鼠心肌梗死周边细胞的凋亡率降低,说明美托洛尔可以缓解AMI大鼠的心肌损伤程度。
c-fos是一种原癌基因,在细胞受到刺激后能即刻最先表达,其编码的核磷蛋白c-fos不能单独起作用,只有与c-Jun蛋白结合成异源二聚体AP-1,才能活化目标基因。c-fos基因在正常的心肌、血管内皮和平滑肌中广泛存在,参与细胞正常的生长发育过程,在应激反应下有一定的组织保护作用,但其过度表达可导致AP-1下游基因肿瘤坏死因子的表达,造成细胞凋亡过度[14-16]。研究发现[17],c-fos异常表达可能是动脉粥样硬化、心肌肥厚以及高血压的病因之一。大量研究表明[18],在突发心肌缺血时,c-fos表达上升,转入核内后与c-Jun结合成AP-1调节反向基因表达,将外界信号转换入胞内长时间的细胞行为变化。c-fos启动子区主要有cAMP反应组件(CRE)、血清反应组件(SRE)与sis诱导组件(SIE),MAPK家族成员ERK1/2与细胞的增殖、分化密切相关,是将胞外刺激信号传递到胞内的共同通路,ERK1/2自我磷酸化后可通过磷酸化Elk-1,从而促进三元复合物SRE/SRF/Elk-1的形成,进而诱导c-fos的转录,其中SRF是血清反应因子,因此ERK1/2的表达及磷酸化是c-fos表达的先决条件之一[19-21]。
本研究首先复制AMI大鼠模型,超声显示AMI模型大鼠左心室指数发生显著的变化,qRT-PCR结果显示心肌组织中c-fos、ERK1、ERK2 mRNA的表达增加,这说明AMI后大鼠心脏的左心室出现了重塑现象。AMI大鼠服用肝素、美托洛尔后,与模型组相比,左心室心率降低,相关指数EF、FS、LVIDd、LVIDs发生变化程度较小,心肌组织中蓝色胶原减少,心肌纤维化水平降低,细胞凋亡率下降,同时c-fos、ERK1、ERK2 mRNA表达较低,c-fos蛋白表达水平、ERK1/2的磷酸化水平同样很低,且差异有统计学意义,这说明肝素、美托洛尔可以降低c-fos、ERK1、ERK2的表达及ERK1/2的磷酸化,抑制信号在该通路上的传递。本研究结果进一步表明美托洛尔可减轻AMI大鼠后心肌损伤程度,其作用机制可能与p-ERK1/2-cfos相关途径受到抑制有关。
综上所述,本研究通过结扎大鼠左冠状动脉前降支创建AMI模型,采用美托洛尔治疗后,AMI大鼠的心肌损伤程度减轻,c-fos、ERK1、ERK2的表达水平及ERK1/2的磷酸化水平下降,暗示美托洛尔作用机制可能与p-ERK1/2-c-fos相关途径受到抑制有关。然而AMI大鼠的心肌损伤发生、发展的相关因素很多、相关机制复杂,美托洛尔缓解心肌损伤的作用机制还需继续深入的探究。
