miR-375靶向Sp1调控骨肉瘤细胞增殖凋亡
2018-11-14汤峰林朱浩明张亚峰杨惠林
汤峰林 丁 涛 朱浩明 张亚峰 张 钦 陆 淼 杨惠林
(南京医科大学附属无锡市人民医院骨科,江苏 南京 214000)
骨肉瘤是一种常见的恶性肿瘤,具有发病率高、恶性程度高、发展速度快、预后差等特点〔1〕。据统计,骨肉瘤患者截肢后5年内的生存率仅有20%〔2〕。治疗骨肉瘤的方法以手术为主,放化疗辅助治疗〔3〕。随着小分子标志物在癌症治疗中的应用,寻找治疗骨肉瘤的有效小分子标志物是目前研究的热点。MicroRNAs(miRNAs)是一种广泛存在于真核生物体内的小分子RNA,由20~25个核苷酸组成〔4〕。miRNA与肿瘤的发生和发展具有密切关系。miRNA-375在宫颈癌、肝癌、胃癌、乳腺癌等多种肿瘤中异常表达,且能够影响癌细胞的生长〔5~7〕。本研究收集了骨肉瘤组织及对应的瘤旁组织,RT-PCR检测组织中miRNA-375的表达,并通过细胞转染的方法探讨miRNA-375对骨肉瘤细胞增殖凋亡的影响。
1 材料与方法
1.1组织及细胞 选取2011年7月至2014年12月在南京医科大学附属无锡市人民医院骨科、无锡市中医医院骨科和苏州大学附属第一医院骨科三家医院确诊切除的骨肉瘤患者的骨肉瘤组织及对应的瘤旁组织各50例,男28例,女22例,年龄50~60岁。所有患者在术前未接受放化疗,组织标本采集经过患者及家属同意。人骨肉瘤细胞MG-63购自于中科院细胞库。
1.2主要仪器及试剂 680型酶标仪购自美国Bio-rad公司;Attune NxT流式细胞仪购自美国Thermo;胎牛血清购自美国Gibco;噻唑蓝(MTT)、青链霉素、RPMI1640培养基、胰蛋白酶均购自美国Sigma;活化的含半胱氨酸的天冬氨酸蛋白水解酶(酶切Caspase)-3单克隆抗体、酶切Caspase-9单克隆抗体、甘油醛-3-磷酸脱氢酶(GAPDH)单克隆抗体均购自美国Abcam公司;二喹啉甲酸(BCA)蛋白浓度检测试剂盒购自碧云天生物技术研究所。
1.3RT-PCR检测组织中miR-375表达 取骨肉瘤组织放置研钵中,在液氮中研磨成粉状,加入1 ml Trizol裂解液,充分研磨后放在室温下裂解10 min。在裂解液中加入氯仿,每1 ml Trizol中加入200 μl氯仿,剧烈震荡20 s,12 000 r/min,4℃离心15 min,移液枪吸取水相层至新的EP管中,加入等体积异丙醇混合均匀,在室温下静置20 min,12 000 r/min,4℃离心15 min,弃上清。加入冰预冷的75%乙醇重悬RNA沉淀,10 000 r/min,4℃离心5 min,吸除上清液,放置于超净工作台中干燥后,加入焦碳酸二乙酯(DEPC),放在-80℃保存。紫外分光光度计检测提取的RNA浓度及纯度。反转录试剂盒说明书合成miR-375的cDNA。实时定量PCR试剂盒分析miR-375水平。以GAPDH为内参,采用2-△△CT测定值分析组织中miR-375表达水平。GAPDH上游引物:5′-CGGAGTCAACGGATTTGGTCGTAT-3′,下游引物:5′-AGCCTTCTCCATGGTGGTGAAGAC-3′;miR-375上游引物:5′-AGCCGTTTGTTCGTTCGGCT-3′,下游引物:5′-GTGCAGGGTCCGAGGT-3′。
1.4细胞培养 人骨肉瘤细胞MG-63用含有10%胎牛血清、1×106U/ml青霉素、1×105U/ml链霉素的RPMI1640培养液培养,培养条件:37℃,饱和湿度,5% CO2培养箱。观察细胞融合度达到90%时,用0.25%胰蛋白酶消化传代细胞,按照1∶3比例接种至细胞培养瓶中培养。
1.5细胞转染 取培养至对数生长期的骨肉瘤细胞MG-63,胰蛋白酶消化后,用细胞培养液悬浮细胞,以5×103个细胞/孔接种到6孔细胞培养板中培养过夜,观察融合度达到60%时,吸除细胞培养液,用不含胎牛血清的细胞培养液继续培养1 h。按照Lipofectamine2000转染试剂说明书将miR-375 模拟物(miR-375 mimics组)和mimics control(阴性对照组)转染至MG-63中,培养6 h后,更换为含胎牛血清的完全培养液继续培养48 h。同时设立空白对照组,只加入转染试剂。转染后48 h,RT-PCR 检测转染后细胞中miR-375表达水平,步骤参照1.3。
1.6MTT检测细胞增殖 骨肉瘤细胞MG-63转染后,调整细胞浓度为3×105个/ml,以每孔100 μl细胞悬浮液接种至96孔细胞培养板中培养48 h后,加入50 μl浓度为5 mg/ml的MTT溶液,放在37℃环境中孵育反应4 h,倒掉上清液,加入二甲基亚砜溶液150 μl充分混合后,轻度震荡反应10 min,观察结晶物完全溶解后,酶标仪检测490 nm的吸光度(OD值),同时设置调零组,调零组中不加入细胞,每组设置8个复孔,取平均值。计算细胞存活率。细胞存活率=(转染组OD值-调零组OD值)÷(空白对照组OD值-调零组OD值)。
1.7碱性磷酸酶酶标仪读数法检测碱性磷酸酶活性 取转染48 h后的骨肉瘤细胞MG-63,胰蛋白酶消化后,1 000 r/min离心10 min,弃上清液,按照碱性磷酸酶活性检测试剂盒检测细胞中碱性磷酸酶活性。
1.8流式细胞术检测细胞凋亡 取转染48 h后的骨肉瘤细胞MG-63,加入胰蛋白酶消化细胞,磷酸盐缓冲液(PBS)重悬洗涤细胞2次,收集1×106个细胞,用冰预冷的PBS重悬2次,1 000 r/min,4℃离心10 min,用 200 μl结合缓冲液重悬细胞,混合后,分别加入5 μl碘化丙啶(PI)和5 μl膜联蛋白(Annexin)-V ,在避光环境下,室温静置15 min ,加300 μl缓冲液,流式细胞仪观察细胞凋亡情况。
1.9Western印迹检测细胞中酶切Caspase-3、酶切Caspase-9表达 收集转染48 h后的骨肉瘤细胞,加入蛋白抽提试剂,放置冰上裂解20 min,4℃,12 000 r/min离心20 min。取蛋白上清液,根据BCA蛋白浓度检测试剂盒对提取的蛋白样品定量。取蛋白样品与4倍上样缓冲液按照3∶1的比例混合,100℃煮沸5 min。加入到聚丙烯酰胺凝胶上样孔中,每孔加50 μl,电泳初始电压为80 V,观察溴酚蓝进入分离胶与浓缩胶边缘时,调整电压为120 V至电泳结束。取出蛋白凝胶,4℃将蛋白转印至硝酸纤维素膜上,转膜电流为220 mA。经5%脱脂奶粉37℃封闭1 h后,放在一抗(500倍稀释,4℃过夜)、二抗(1 000倍稀释,37℃孵育1.5 h)中反应后,滴加显色液,以GAPDH为内参,分析蛋白表达水平。
1.10靶基因预测 利用靶基因预测软件The miRBase(http://www.mirbase.org/)、TargetScan(http://www.targetscan.org/)、PicTar(http://pictar.mdc-berlin.de/)预测miR-375 的靶基因可能为特化蛋白(Sp)1。通过常规方法构建野生型(wt)-Sp1和突变型(mut)-Sp1荧光素酶基因载体,分别将这两种质粒与miR-375 mimics、mimics control混合共同转染到骨肉瘤细胞中,分别计为wt+miR-375 mimics、mut+miR-375 mimics、wt+阴性对照、mut+阴性对照。放置37℃,5%CO2培养箱中培养48 h后,利用双荧光素酶报告基因试剂盒检测双荧光素酶活性。同时用RT-PCR和Western印迹检测过表达miR-375后的骨肉瘤细胞中Sp1的水平,步骤同1.5,1.9。
1.11统计学处理 采用SPSS22.0软件进行t检验、单因素方差分析。
2 结 果
2.1miR-375在骨肉瘤组织中的表达 骨肉瘤组织中miR-375的表达水平(0.19±0.21)明显低于瘤旁组织(0.52±0.16),差异有统计学意义(t=8.84,P<0.01)。
2.2转染后细胞中miR-375表达 阴性对照组中miR-375表达水平(0.98±0.12)与空白对照组(1.00±0.08)相比差异无统计学意义(P>0.05)。miR-375 mimics组(1.52±0.20)与空白对照组相比明显升高(P<0.01)。
2.3各组细胞增殖及碱性磷酸酶比较 阴性对照组细胞存活率(98.82%±5.20%)及碱性磷酸酶活性〔(2.30±0.30)金氏单位/g〕与空白对照组〔99.80%±1.20%,(2.32±0.20)金氏单位/g〕相比差异无统计学意义(P>0.05)。miR-375 mimics组细胞存活率(58.23%±12.3%)与空白对照组相比明显降低(P<0.01)。miR-375 mimics组细胞碱性磷酸酶活性〔(4.17±1.5)金氏单位/g〕与空白对照组相比明显升高(P<0.01)。
2.4细胞凋亡检测结果 阴性对照组细胞凋亡率及细胞中酶切Caspase-3、酶切Caspase-9与空白对照组相比差异无统计学意义(P>0.05)。miR-375 mimics组与空白对照组和阴性对照组相比明显升高(P<0.05)。见表1,图1。
2.5靶基因预测结果 见图2。wt+miR-375 mimics荧光素酶活性〔(4.92±1.25)金氏单位/g〕明显低于mut+miR-375 mimics〔(10.33±1.74)金氏单位/g,P<0.01〕。miR-375 mimics组细胞中Sp1 mRNA及Sp1蛋白表达(0.49±0.31,0.10±0.24)均明显低于空白对照组(0.98±0.02、0.63±0.09)和阴性对照组(0.92±0.11、0.59±0.13),见图3。

表1 各组细胞凋亡率、酶切Caspase-3、9比较
与空白对照组比较:1)P<0.05;与阴性对照组比较:2)P<0.05

图1 Western印迹结果图

图2 miR-375 靶基因预测结果
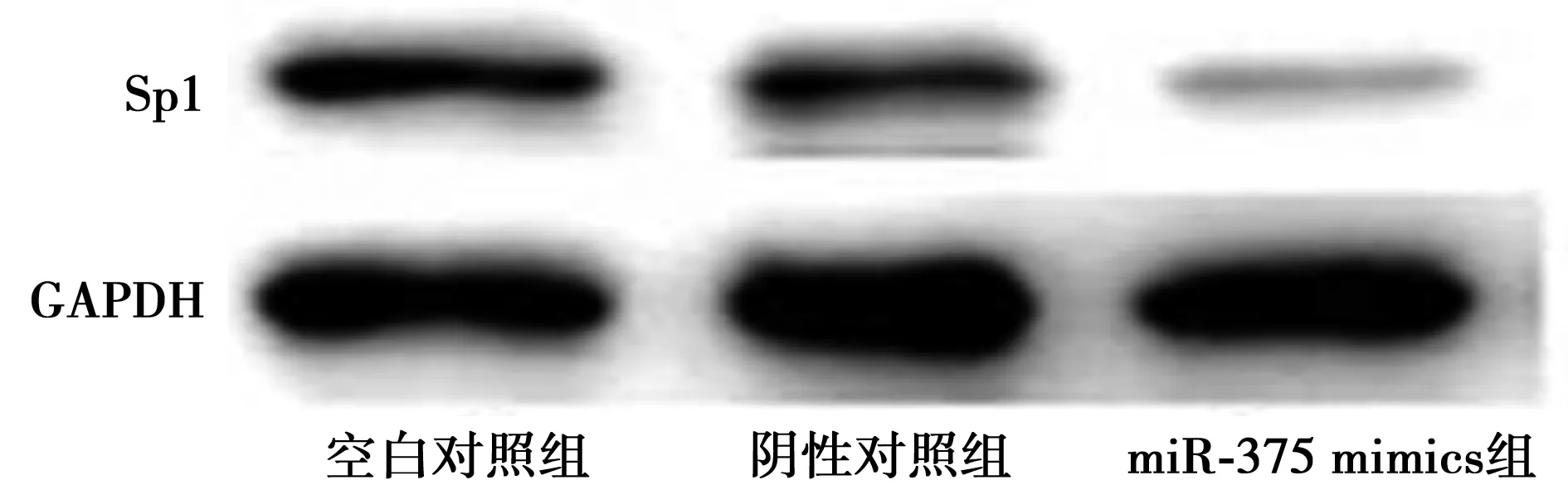
图3 Western印迹结果
3 讨 论
miRNA是一种单链非编码的小分子RNA,能够通过作用于靶基因影响细胞生长。miRNA广泛存在于真核生物体内,具有广泛的生物学作用〔8〕。近年来研究表明,miRNA与肿瘤的发生有关〔9〕。不同的miRNA对肿瘤的作用不同,在肿瘤组织中表达缺失或下调的miRNA发挥抑制癌症发展的作用,在肿瘤组织中表达上调的miRNA在肿瘤发展过程中发挥促进作用〔10〕。miR-375是一种与肿瘤相关的miRNA,在胰岛素分泌、葡萄糖代谢、神经元细胞分化、肺组织活性物质分泌等过程中均有重要作用〔11〕。研究表明,miR-375与肿瘤的生长有关,在宫颈癌、前列腺癌、喉鳞癌、胃癌等多种癌症组织中表达异常下调〔12〕。上调宫颈癌细胞中miR-375的表达水平能够抑制宫颈癌细胞的增殖,促进宫颈癌细胞凋亡〔13〕。后续研究表明,miR-375同样能够抑制喉鳞癌、前列腺癌、胃癌等多种癌细胞生长〔14〕。结果与之前的研究结果一致。
癌细胞的增殖和凋亡是一个复杂的过程,受到细胞内多种信号因子的共同作用。Caspase蛋白家族是目前公认的与细胞凋亡有关的蛋白家族〔15〕。Caspase-3是Caspase级联反应中的凋亡执行因子,Caspase-3活化后标志着细胞凋亡进入不可逆阶段〔16〕。Caspase-9是Caspase级联反应中关键的信号转导因子,活化后的Caspase-9能够将凋亡信号传递给信号通路下游,引起细胞凋亡发生〔17,18〕。本研究结果提示,过表达miR-375能够促进骨肉瘤细胞凋亡。
碱性磷酸酶是成骨细胞分化的早期标志,而骨肉瘤是由于正常成骨细胞分化异常减少导致的疾病〔19〕。本研究结果提示,miR-375能够逆转成骨细胞分化中断,使正常的成骨细胞分化继续发生。miRNA能够通过作用于靶基因影响细胞的生物学活性〔20〕。本研究结果提示,miR-375负调控靶基因Sp1。
综上,miR-375在骨肉瘤组织中表达下调。miR-375通过靶向Sp1促进骨肉瘤细胞正常成骨分化,促进骨肉瘤细胞凋亡,抑制骨肉瘤细胞增殖。
