急性溃疡性结肠炎小鼠结肠组织中SHP2的表达及其作用探讨
2018-11-13谭婉燕杨旭辉
谭婉燕,杨旭辉
(华中科技大学同济医学院附属梨园医院,武汉430077)
溃疡性结肠炎(UC)是一类病因不明、癌变风险较高的非可控性炎症性疾病,具有病程长、病变程度轻重不一、反复发作、治愈难度大等特点[1]。寻找有效的治疗靶点对改善UC的临床疗效具有重要意义。含Src同源区2蛋白质酪氨酸磷酸酶2(SHP2)是一种由PTPN11基因编码的非受体型蛋白质酪氨酸磷酸酶,作为蛋白酪氨酸磷酸酶家族的一员,其通过多条信号传导通路参与细胞的生长、分化、迁移、黏附及凋亡等重要生命活动[2]。SHP2广泛表达于各种细胞和组织中,与脑胶质瘤、大肠癌、乳腺癌和宫颈癌等多种恶性肿瘤的发生发展关系密切[3],但SHP2在UC中的作用目前仍不清楚。炎症性肠病的发生发展与炎性因子的过度表达有关,其中环氧合酶2(COX-2)、白细胞介素6(IL-6)和肿瘤坏死因子α(TNF-α)是UC中研究较多的炎性因子。P65和信号传导与转录活化因子3(STAT3)信号通路与UC的发生发展密切相关,它们通过调控相关炎性因子的释放,参与肠道的炎症反应[4,5]。Ki67作为一种在细胞增殖中不可缺少的核抗原,其表达水平可反映细胞增殖速度[6,7]。2017年1~12月,我们通过建立小鼠UC模型,观察结肠组织中SHP2的表达情况,并通过构建腺病毒SHP2突变载体下调SHP2表达,观察血清炎性因子COX-2、IL-6、TNF-α及结肠组织中NF-κB/STAT3信号通路蛋白的变化,探讨SHP2在UC发病中的作用。
1 材料与方法
1.1 动物、试剂与仪器 SPF级健康雄性BALB/c小鼠30只,4~6周龄,体质量19~21 g,由华中科技大学同济医学院实验动物中心提供。主要试剂:葡聚糖硫酸钠(DSS, MW40000,MPBio,美国),腺病毒稀释液(Sigma-Aldrich,美国),小鼠COX-2、IL-6、TNF-α酶联免疫吸附测定试剂盒(武汉伊莱瑞特生物科技有限公司,中国),兔源多克隆GAPDH抗体(杭州贤至生物有限公司,中国),兔源多克隆抗体SHP2(武汉三鹰生物技术有限公司,中国),兔源多克隆抗体p-P65(CST,美国),兔源单克隆抗体p-STAT3(CST,美国),Ki67抗体(Abcam,美国),辣根过氧化物酶标记的羊抗兔二抗(武汉博士德生物工程有限公司,中国)。腺病毒突变载体pAd-pG1.2-mus-shp2-2的构建委托赛业生物科技有限公司设计。主要仪器:低温离心机(Thermo scientific,美国),全自动酶标仪(Thermo scientific,美国),电热恒温培养箱(ASONE,日本),电泳仪(Bio-Rad,美国),Chemi Doc MP全能型凝胶成像分析系统(Bio-Rad,美国)。
1.2 急性UC模型制作 将30只小鼠随机分为正常组、模型组和SHP2组,每组各10只。模型组和SHP2组给予4% DSS溶液饮用7 d制作急性UC模型[8],正常组饮用高压过的饮用水。当小鼠出现不同程度的进食及进饮减少、体质量下降、腹泻、血便、肛周毛发凌乱、肛口稀血便黏附时,表明造模成功。继续饲养20 d。
1.3 腺病毒转染 于造模第1天分别向正常组、模型组和SHP2组腹腔注射100 μL腺病毒稀释液、腺病毒空载体和腺病毒SHP2突变载体。造模第8天取5只小鼠处死,取结肠组织,采用Western blotting法检测SHP2蛋白表达,以验证腺病毒在小鼠肠道组织的转染效率,以转染效率≥70%为转染合格。
1.4 肠道临床炎症严重程度评估 饲养期间每天测量小鼠体质量,检查肛周,记录排便情况。采用疾病活动指数(DAI)评分量表[8]对腹泻、便血、体质量改变情况进行评分。
1.5 组织病理学检查 饲养至20 d处死剩余15只小鼠,取结肠组织,制作病理切片,采用HE染色观察组织形态学变化,按照组织学评分标准[1]进行评分。采用阿尔新蓝染色检测组织中杯状细胞数量,根据杯状细胞数量评价结肠黏膜屏障功能。
1.6 血清COX-2、IL-6、TNF-α检测 采用ELISA法。小鼠处死后,收集心脏血,离心取上清,采用小鼠PTGS2/COX-2、IL-6、TNF-α ELISA试剂盒检测血清COX-2、IL-6、TNF-α水平,具体操作按照试剂盒说明书进行。
1.7 结肠组织中p-P65、p-STAT3表达检测 采用Western blotting法。取少量结肠组织置于匀浆器中剪碎,加入细胞裂解液,提取总蛋白,应用BCA试剂盒检测蛋白浓度。配制10%分离胶和5%浓缩胶,电泳转膜,5%脱脂牛奶封闭,结合兔抗鼠GAPDH(1∶1 000稀释)、p-P65(1∶1 000稀释)和p-STAT3(1∶2 000稀释)抗体,孵育结束后洗膜。再滴加羊抗兔二抗,室温摇床孵育1 h。洗涤后将PVDF膜置于ChemiDoc MP全能型凝胶成像分析系统仪器中扫膜,用Image Lab软件处理图像,Image J软件计算各条带的灰度值,以目标条带与对应内参条带灰度值的比值表示目标蛋白的相对表达量。
1.8 结肠组织中Ki67表达检测 采用免疫组化染色法。取组织切片常规脱蜡至水,3% H2O2去离子水孵育10~30 min,以灭活内源性过氧化物酶活性。山羊血清封闭15~30 min,加入Ki67一抗(1∶100稀释),37 ℃孵育2~3 h,次日滴加HRP标记的二抗室温孵育30 min,DAB显色,苏木素复染,逐级脱水、透明、中性树胶封片。根据每个高倍镜视野中阳性细胞所占百分比评分:阳性细胞≤5%为0分,6%~25%为1分,26%~50%为2分,51%~75%为3分,≥76%为4分;根据染色强度评分:无染色为0分,弱染色为1分,中等染色为2分,强染色为3分;两项评分相乘得出最终评分。
1.9 统计学方法 运用GraphPad Prism 6软件进行绘图和统计分析,组间两两比较采用LSD-t检验,多组间比较采用单因素方差分析。P<0.05为差异有统计学意义。
2 结果
2.1 三组DAI评分比较 见图1。从第13天开始,SHP2组DAI评分低于模型组(P均<0.01)。
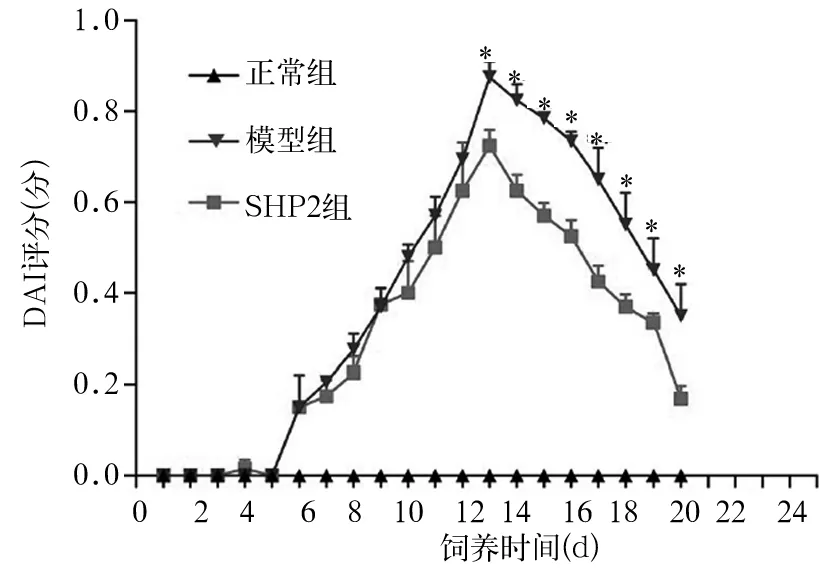
图1 各组DAI评分比较
注:与SHP2组比较,*P<0.01。
2.2 三组组织病理学检查结果 正常组结肠黏膜基本完整,腺体排列整齐、结构层次清晰,无明显炎性细胞浸润;模型组结肠黏膜破损严重,腺体减少、排列紊乱,以淋巴细胞为主的炎性细胞的大量浸润,淋巴滤泡增生;SHP2组结肠炎症相对较轻,黏膜基本完整,腺体结构清晰,炎细胞浸润相对较少。模型组和SHP2组的组织病理学评分分别为(15.33±1.53)、(10.67±2.08)分,与模型组相比,SHP2组评分降低(P<0.05)。模型组、SHP2组、正常组结肠上皮杯状细胞数量分别为(60.67±3.06)、(70.31±4.51)、(85.33±2.52)个,模型组杯状细胞数量较正常组减少,SHP2组杯状细胞数量较模型组增加(P均<0.05)。
2.3 三组血清COX-2、IL-6、TNF-α水平比较 模型组COX-2、IL-6、TNF-α水平高于正常组,SHP2组COX-2、IL-6、TNF-α水平低于模型组(P均<0.01)。见表1。

表1 三组血清COX-2、IL-6、TNF-α水平比较(x±s)
注:与正常组比较,*P<0.01;与模型组比较,△P<0.01。
2.4 三组结肠组织p-P65、p-STAT3、Ki67表达水平比较 模型组结肠组织中p-P65、p-STAT3、Ki67蛋白表达水平较正常组升高,SHP2组上述指标表达水平较模型组降低(P均<0.01)。见表2。

表2 三组结肠组织p-P65、p-STAT3、Ki67表达水平比较
注:与正常组比较,*P<0.01;与模型组比较,△P<0.01。
3 讨论
UC是一种以肠道慢性非特异性炎症为特征的肠道疾病,其临床表现主要为血性腹泻、腹痛、便血以及体质量减轻等。DAI评分作为一种以大便性状改变程度、便血程度以及体质量下降程度为指标的评价方式,已被广泛用于评估UC的活动程度[8]。为了探讨SHP2在UC中的作用,我们利用4% DSS溶液制作急性UC模型,并通过构建腺病毒SHP2突变载体,使SHP2在小鼠肠道组织低表达,结果显示,与对照组相比,SHP2组小鼠DAI评分降低,提示下调SHP2表达可改善急性UC模型小鼠的疾病活动程度。
肠道的组织病理学检查及评分可从组织结构上进一步鉴别UC的严重程度。在UC中,常通过HE染色观察肠道黏膜的破坏程度、腺体的排列及结构层次以及炎性细胞的浸润等来进行病理学评分。本研究结果显示,SHP2组肠道炎症程度及组织病理学评分显著高于对照组,但低于模型组,表明下调SHP2的表达可缓解UC小鼠的疾病情况,这与上述DAI评分相一致。此外,结肠黏膜上皮中杯状细胞的数量也可在一定程度上反映小鼠UC的严重程度。本研究结果显示,SHP2组小鼠结肠上皮中杯状细胞的数目介于正常组和模型组之间。上述研究结果表明,SHP2可能是UC发生发展的一个促进因素,抑制其表达对UC具有一定的治疗作用。
STAT3作为一个重要的细胞内信号转导分子,可被细胞因子激活发生磷酸化成为p-STAT3,从而发挥生物学功能。研究表明,STAT3信号通路通过调控TNF-α、IL-6、COX-2等炎性因子的释放而参与组织炎症反应[4]。STAT3在UC发病机制中的重要作用已得到证实,STAT3蛋白及mRNA表达水平与疾病的活动度呈正比[9]。P65是NF-κB中促炎作用最为显著的亚单位,其作为炎症性肠病中炎症级联放大效应及瀑布样效应的开关,在UC发病过程中起着核心作用[10]。本研究结果显示,p-P65和p-STAT3在模型组结肠组织中的表达较正常组升高,而在SHP2组的表达较模型组降低;提示SHP2可能通过激活NF-κB/STAT3相关信号传导通路,参与UC的发生发展。
既往研究表明,P65的活化结构即p-P65可通过介导促炎因子如TNF-α、IL-2、IL-6等的产生而参与UC的病理生理过程[11]。同时,SHP2已被证实参与RAS-RAF-MAPK、JAK-STAT、NF-κB、ERK、P13K等多条信号转导通路的调节[12]。本研究结果显示,模型组血清COX-2、IL-6、TNF-α水平较正常组升高,而SHP2组上述指标较模型组降低。提示SHP2可能通过激活NF-κB/STAT3相关信号传导通路,进而促进炎性因子COX-2、IL-6、TNF-α的产生和释放,从而介导UC的发生发展。
Ki67作为一类与细胞周期相关的增殖细胞核抗原,是目前应用最广泛的细胞增殖标志物之一,其表达水平高低可用于评估细胞的增殖程度[6,7]。本研究结果显示,模型组结肠组织中Ki67表达水平高于正常组,而SHP2组Ki67表达水平较模型组降低。提示SHP2可能通过促进Ki67的表达来诱导炎性细胞的增殖,从而参与UC的发病过程。
综上所述,SHP2在小鼠UC的起病中发挥促进作用,其机制可能是通过调节NF-κB/STAT3信号通路的激活,促进炎性因子COX-2、IL-6、TNF-α产生和释放,从而诱导炎性细胞的增殖,介导炎症的发生;抑制SHP2表达可改善小鼠肠道UC的炎症情况。因此,SHP2具有作为UC临床治疗靶点的巨大潜力,值得进一步深入研究。
