微型无导线心脏起搏器的临床应用与进展
2018-11-13汪菁峰梁义秀宿燕岗
汪菁峰 梁义秀 宿燕岗
经静脉植入电极导线和制作囊袋放置脉冲发生器依然是目前植入式心脏电子装置的基本结构,而导线、囊袋相关的并发症是困扰临床医生的重要问题,包括导线脱位、导线断裂、静脉血栓形成、三尖瓣返流、囊袋血肿、导线与囊袋感染等仍严重威胁患者健康。因此挣脱导线和囊袋的束缚进而完成起搏器的“无线”革命,是近年来起搏器技术发展的热点。
随着起搏器电池技术的不断发展和电子线路的微型化,微型无导线起搏器诞生了。其将高能电池、传导环路、起搏电极集成为可全部植入心腔的微型“胶囊”,体积只有传统起搏器的1/10,直接采用传统电刺激的方法起搏心内膜,无需经过能量的转换、发射及接收过程,降低能量损耗,同时进一步减少囊袋带来的手术复杂性和相关并发症。目前,通过认证的微型无导线起搏器主要有两种,一种是NanostimTM无导线起搏器(leadless cardiac pacemaker,LCP,St.Jude Medical),采用主动螺旋固定装置;另一种是MicraTM无导线起搏器(micra transcatheter pacing system,TPS,Medtronic),采用被动倒钩状固定装置。两者均基于导管的推送系统,采用高集成能量的微型电池,进行低能耗设计,通过介入操作,能够可靠地固定于心肌内,其脱位与穿孔的发生率低,便于测试与调控,植入与取出技术易操作。笔者主要结合现有临床研究,对该两款微型无导线起搏器的结构与功能、适用人群、植入手术安全性与有效性、起搏器械的移除、与皮下埋藏式心脏转复除颤器(ICD)的联合应用等问题作一简单阐述。
1 微型无导线起搏器的结构、功能及递送系统简介
两款无导线起搏器的形态学特点见图1。相比之下Micra TPS更为小巧,但预期电池寿命亦较短;Nanostim LCP通过血流温度调整起搏频率适应性变化,而Micra TPS通过三维加速计进行频率应答;Nanostim LCP需通过与体表接触方能对起搏器进行询问和程控,MicraTPS则通过射频遥测系统即可进行起搏器程控、远程随访及自动阈值检测与夺获管理;Micra TPS输送鞘直径较大,为避免血栓形成,需加强术中肝素的应用;Nanostim LCP通过旋转递送导管的手柄,采用主动螺旋将起搏器固定于心内膜(主动固定),Micra TPS则通过四个镍钛合金的倒钩将起搏器固定于心内膜(被动固定);手术操作均需在X线透视下完成,经皮操作,通过配套的递送系统经静脉将起搏器置入右室(图2A)。心腔内超声虽有助于起搏器定位,但鉴于费用问题及操作复杂性,目前非常规流程。Nanostim LCP和Micra TPS两种微型无导线起搏器结构功能特点的比较见表1。
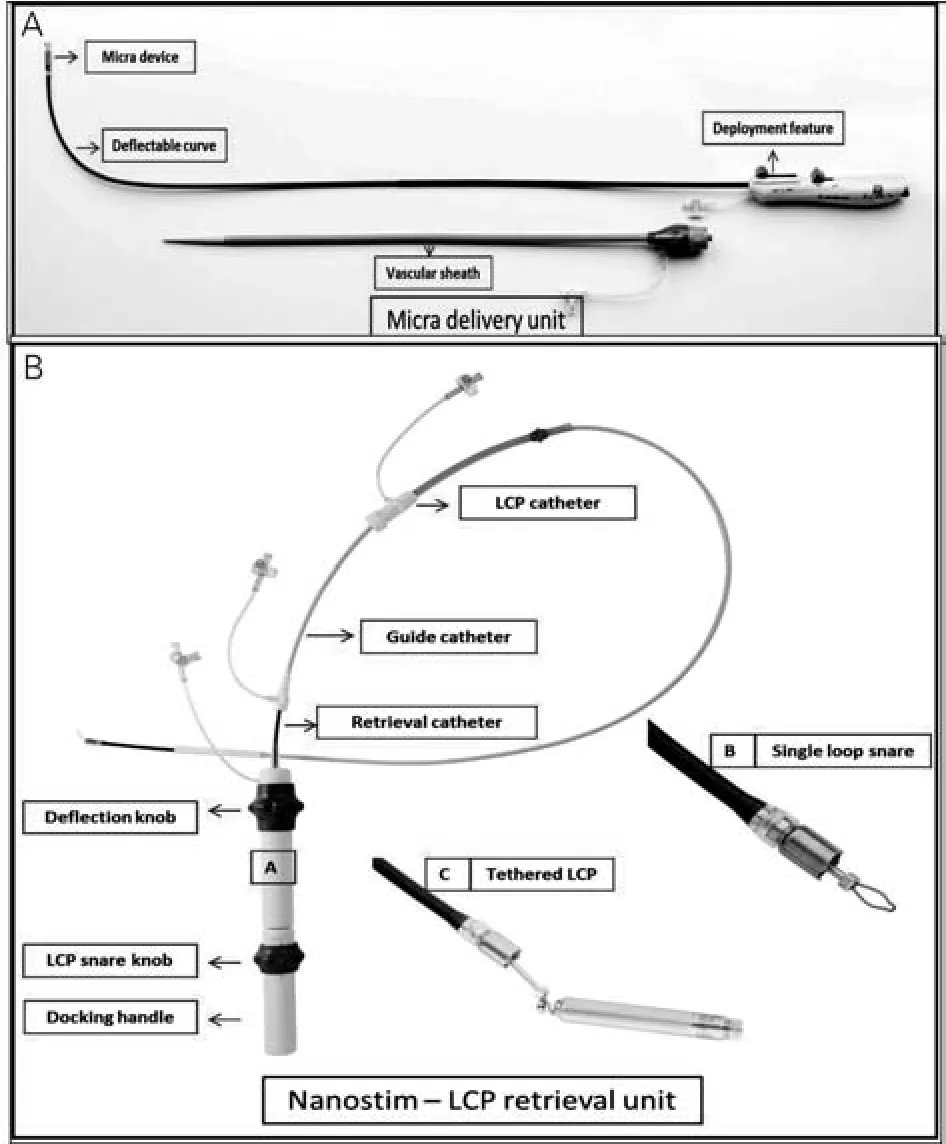
图2 微型无导线起搏递送系统及移除装置示意图
2 微型无导线起搏器的适应证与禁忌证
根据相关临床研究入排标准[1-3],上述两款无导线起搏器主要适用于行右室单腔起搏治疗的患者(VVIR),包括慢性心房颤动伴完全性房室传导阻滞或长RR间期;窦性心律伴高度房室传导阻滞且活动量低或预期寿命较短者;窦性心动过缓偶伴窦性暂停;不明原因晕厥伴心电生理检查异常(如HV间期延长)。主要禁忌证包括:机械三尖瓣;已存在心内膜电极导线;下腔静脉滤网置入者;醋酸地塞米松过敏者(起搏器头端为激素释放电极);股静脉解剖异常者;肺动脉高压;30天内发生急性冠状动脉综合征者;极度肥胖以致无法对起搏器进行程控询问者。根据微型无导线起搏器的优势,有两类患者尤其适用:①终末期肾功能衰竭患者,此类患者大多埋有深静脉导管、血液透析管,是血行感染的高危人群,而无导线起搏器体积小,周围有快速的血流冲涮,心腔密闭与外界无交通,因此不易发生感染相关并发症;同时无导线起搏器保留中心静脉或周围静脉不被占用,对血透患者亦至关重要[4]。②之前植入经静脉起搏器,反复感染或静脉栓塞患者,植入微型无导线起搏器则可杜绝相关并发症发生。
3 微型无导线起搏器植入安全性及有效性
2013年Reddy等[1]发表的Leadless研究是首次测试Nanostim LCP在人体安全性与有效性的临床研究,共入选33例患者,手术成功率97%;随访90天,2例患者(6%)发生严重不良事件,其中1例因右室穿孔心包压塞导致死亡,另一例则经未闭卵圆孔将起搏器植入左室,后成功取出重新植入右室。在随后的LEADLESSⅡ研究[2]中,共入选526例患者,植入成功率达95.8%。12个月随访,起搏感知参数良好,90%以上患者符合既定要求(即R波振幅≥5.0m V,输出阈值≤2.0 V/0.4 ms),其中平均R波振幅(9.2±2.9)m V,起搏阈值(0.58±0.31)V/0.4 ms。严重不良事件发生率6.5%,其中包括心脏穿孔1.6%,因起搏阈值升高而重新手术0.8%,血管相关并发症(如出血、动静脉瘘、假性动脉瘤等)1.2%,起搏器脱位1.1%,其中4例进入肺动脉,2例进入右股静脉,所有脱位起搏器均成功取出;此外尚有7例患者因阈值升高、心功能恶化等原因成功取出起搏器。整个研究过程中,28例(5.3%)患者死亡,均与植入器械无关,其中2例与手术操作相关。

表1 两种微型无导线起搏器结构功能特点的比较
针对Micra起搏器的Micra TPS研究[3]于2013年12月开始,2015年5月入组结束,共入选725例患者,手术成功率99.2%(719/725)。6个月随访,98.3%患者输出阈值≤2.0V,其中平均起搏阈值、R波振幅、起搏阻抗于植入时分别为0.63 V/0.24 ms,11.2 m V,724Ω,6个月随访时分别为0.54 V/0.24 ms,15.3 m V,627Ω,各项参数于随访过程中均逐步趋于稳定。严重不良事件发生率4%,其中心脏穿孔或心包压塞1.6%,动静脉瘘或假性动脉瘤等血管相关并发症0.7%,血栓栓塞并发症0.3%,1例患者因起搏阈值升高重新植入,无起搏器脱位事件发生。目前正在进行的Micra Post-Approval Registry是一项前瞻性、非随机对照、多中心注册研究[5],预计入组植入Micra TPS患者共1 830例,主要观察植入术后30天内相关并发症的发生率。中期结果对已入组的795例患者进行了总结分析,手术成功率99.6%,植入时平均起搏阈值、R波振幅、起搏阻抗于植入时分别为0.6±0.5 V/0.24 ms,(11.4±5.3)m V,(721±181)Ω;6个月随访时起搏阈值(0.6±0.3)V/0.24 ms,阻抗(572±115)Ω。术后30天内,12例患者(1.5%)发生严重不良事件,其中心脏穿孔或心包压塞1例,起搏器脱位1例,穿刺血管相关并发症6例(包括血肿、动静脉瘘、假性动脉瘤等),深静脉血栓1例,其他胸痛、肺水肿、败血症等各1例。研究中共22例患者死亡,无一例与起搏器械相关。总体而言,Nanostim和Micra两款微型无导线起搏器植入成功率高,电学参数稳定,并发症发生率低。目前为止,还没有针对两种无导线起搏器的对比性研究,从研究结果看,两者总体并发症的发生率基本相当。
4 微型无导线起搏器与传统经静脉起搏器的比较
新近有文献比较了无导线起搏器与传统单腔起搏器术后早期并发症的发生率,术后2个月内前者器械相关并发症发生率(4.8%)略高于后者(4.1%)[6],但两者并发症的具体种类及占比差异较大。传统起搏器术后早期并发症主要为气胸(0.6%~0.9%)、电极脱位(0.1%~1.7%)、囊袋血肿(0.2%~0.7%)和心脏穿孔(0.1%~0.3%);而无导线起搏器术后早期主要并发症为心脏穿孔(1.6%),血管相关并发症(0.9%)、起搏阈值升高需重置电极(0.5%)和起搏器脱位(0.5%)。而12个月长期随访结果显示,Micra TPS较传统起搏器总并发症减少48%(4.0%vs 7.6%,P<0.01),再住院率降低47%(2.3%vs 4.1%,P<0.05),因各种原因导致的起搏装置移除降低82%(0.7%vs 3.8%,P<0.01)[7];Nanostim-LCP则较传统起搏器并发症降低71%。
目前微型无导线起搏器与传统经静脉起搏器相关并发症的比较仅限于历史对照结果,缺乏“头对头”研究,但现有的间接对照结果表明无导线起搏器可显著降低气胸、锁骨下静脉血栓或阻塞、导线断裂磨损、囊袋感染等并发症,但增加心脏穿孔及股静脉血管相关并发症。
5 微型无导线起搏器的移除
起搏装置的安全移除是微型无导线起搏器广泛应用于临床的重要前提。研究显示正常人体右室可容纳3个Micra TPS装置[8],因此当无导线起搏器电池耗竭时,除了关闭其起搏感知功能,及时将其取出亦可为以后的治疗提供更多余地。此外,由于起搏阈值异常升高、起搏装置感染或需升级为双心室起搏等原因,亦需将起搏装置取出。Nanostim LCP和Micra TPS的近端均设有一个接口,在X线透视下,相应的抓捕器械通过股静脉鞘与起搏器尾端同轴锚定后,逆时针旋转2圈左右即可将整个无导线起搏装置取出(图2B)。一般而言,激素释放电极6周左右即可与心内膜形成纤维包裹,因此起搏电极的移除分为早期移除(≤6周)与晚期移除(>6周)。现有临床研究结果显示,Nanostim LCP早期移除成功率100%(5/5),晚期移除成功率91%(10/11),其中2/3患者起搏器植入时间超过6个月(平均346天),起搏器移除后30天内,无手术相关并发症发生,证实右室无导线起搏器移除是安全可行的[9];而未能取出的1例患者是由于起搏器植入部位不当,受瓣膜附属结构影响,导致抓捕器无法与起搏器成功锚定所致。Micra TPS相关数据显示无导线起搏器植入后6个月内,9例患者尝试移除起搏器,7例成功移除,1例于植入后229天因纤维包裹严重以致无法取出,另1例则因X线透视机故障导致移除手术失败。与传统经静脉起搏器类似,因Micra TPS为被动固定电极,其头端与心内膜组织形成纤维包裹更为牢固,导致起搏器移除相对较为困难。动物实验结果显示Micra TPS植入28个月后,起搏器成功移除率75%(3/4),病理解剖显示未成功移除者由于起搏器被纤维组织完全包裹所致。因此如何充分利用现有的影像学技术判断起搏器与纤维组织包裹程度,从而正确评估器械移除的风险,是今后重要的研究方向。
6 微型无导线起搏器与皮下ICD
近年来全皮下ICD(S-ICD)系统问世并开始应用于临床,其导线与脉冲发生器均位于皮下,除颤导线不直接接触心脏及相关静脉,尤其适用于不能经静脉植入ICD导线者。由于S-ICD不具有常规起搏功能,有症状性心动过缓需要起搏者或存在频繁单形室性心动过速(VT)能被抗心动过速起搏(ATP)有效终止者不适合植入S-ICD。随着无导线起搏器的诞生,S-ICD联合应用无导线起搏器的理念亦同时诞生了。Tjong等[10]在动物(n=2)及人体(n=1)上同时植入SICD及Nanostim-LCP,电生理检测显示Nanostim-LCP起搏功能和S-ICD感知功能无相互干扰,且除颤治疗不影响Nanostim-LCP的正常功能。病例报道显示Micra TPS与SICD亦无相互影响[11]。Boston Scientific公司研发了一种SICD与无导线起搏器的联合装置(图3),其主要特点为SICD→无导线起搏器单向传递信号,而后者同时具备抗心动过缓起搏与ATP功能。Tjong等[12]在40例动物(包括羊8例、猪5例和犬27例)体内植入S-ICD与无导线起搏器的联合装置,植入成功率98%(39/40),并对其中23例犬进行90天随访。随访结果显示无导线起搏器VVI工作状态良好,S-ICD感知到的VT事件99%(398/401)均成功传递至无导线起搏器,并100%进行ATP治疗;无论窦性心律、起搏心律、VT/心室颤动,S-ICD均可正常感知。S-ICD与无导线起搏器联合装置的应用目前仍处于动物试验阶段,其安全性和有效性有待大型临床研究进一步证实。
7 微型无导线起搏器的局限性、前景与展望
现有的无导线起搏系统仍存在一些问题有待解决:①首先,现有的无导线起搏产品仅适用于富有腱索和室壁较厚的心室起搏,由于心房壁薄,无腱索等结构,2种微型起搏器均无导线的弹性支撑,无法固定于心房,不能实现更符合生理需求的心房起搏或房室同步起搏;可能的解决办法是采集体表心电图波形,正确识别和记录心房波,从而达到心房跟踪心室起搏的目标。②其次,无导线起搏器电池耗竭时如何处理也是一大难题。有关无导线起搏器移除的临床数据十分有限,随着时间延长,植入的无导线起搏器有可能被全部包埋入心内膜纤维组织中,此时耗尽电量的起搏器很难经静脉移除,只能将起搏器关闭(程控为OOO模式),但这种旷置在右室的起搏器是否会增加血栓风险、右心功能不全及系统移位风险,目前尚不得而知。因此,无导线起搏似乎更适用于老年患者,对年轻患者的获益程度尚需长期随访研究来证实。③此外,现有的临床研究数据显示无导线起搏器心脏穿孔及股静脉血管相关并发症的发生率较高,但有望通过对植入者技术的培训控制并发症的发生。最后,无导线起搏器费用相对昂贵,其单价大约为传统单腔起搏器的4~5倍,高昂的费用某种程度上亦限制了其推广应用。
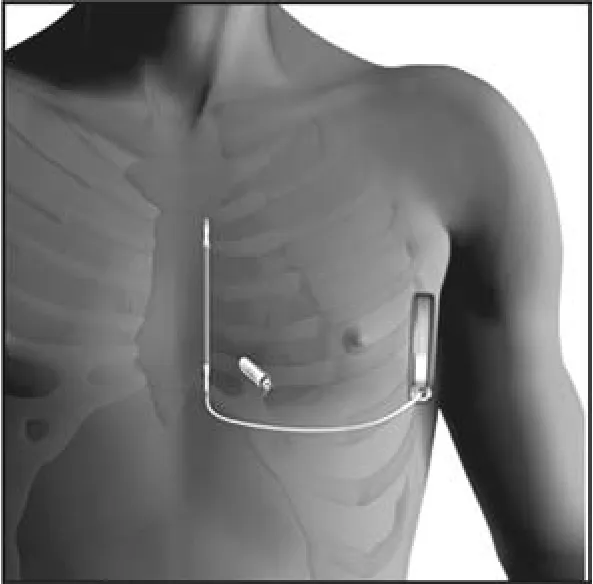
图3 无导线起搏器与皮下ICD联合应用
总体而言,无导线起搏器摆脱了囊袋和导线的束缚,完全避免了囊袋和导线感染的相关并发症,操作简单、便捷、创伤小,使起搏器植入的总体并发症显著下降。随着无导线起搏技术的迅猛发展,无导线起搏器将不仅仅局限于右室起搏,而是逐步实现右房、左室的无导线起搏,并通过电子集成技术完善各起搏装置间的感知、起搏协调工作,进入真正的起搏“无线”时代。
