抗性和非抗性哈萨克羊人工感染包虫虫卵早期小肠免疫指标的差异分析
2018-11-12王绪海张永生李超程营瑞文
王绪海,蒋 松,李 鑫,张永生,李超程,营瑞文,贾 斌
(新疆石河子大学动物科技学院,新疆 石河子 832003)
1 材料与方法
1.1 试验材料
1.1.1 试验动物
试验哈萨克羊:选择规模化哈萨克羊场——新疆第九师165团羊场,提供300只哈萨克羊,佩戴耳号,颈静脉采血于肝素钠抗凝管,按照要求提取基因组DNA,设计MHC-DBR1基因第二外显子引物,PCR扩增,PCR产物分别用MvaⅠ,SacⅡ,Hin1 Ⅰ三个内切酶切割,酶切产物用2%琼脂糖凝胶电泳检测,进行MHC-DRB1:MvaⅠbc-SacⅡ ab-Hin1 Ⅰ ab抗包虫病单倍型分析;同时经过B超和深圳康百得ELISA免疫试剂盒检测确认未感染包虫病,购买7只健康的绵羊,其中用于人工感染试验的绵羊6只(抗性组和非抗性组各3只),以及非抗性对照绵羊1只。MHC抗性组绵羊(KSP-AI)记为A组,MHC非抗性组绵羊(KSN-AI)记为B组,对照组绵羊(KSN-UAI)记为C组。购买饲养于大学动物养殖实验房,再人工攻虫感染试验。
试验犬:从新疆生产建设兵团第八师牧区团场购买哈萨克牧羊犬5只,购买后饲养于石河子大学动物科技学院动物试验站隔离犬舍。
经过检测确定为绵羊包虫病的病变肝、肺20个,均由乌鲁木齐屠宰场和新疆第八师石河子市兽医卫生监督所提供。
1.1.2 试剂与仪器
1.1.2.1 试剂
试验检测包虫病和其他常规所需的试剂:绵羊包虫病ELISA诊断试剂盒(深圳康百得公司);B超耦合剂、十二烷基硫酸钠(SDS)、Tris饱和酚、无水乙醇、氯仿、异戊醇(石河子北生物商贸有限公司);溴酚(蓝天津市鲁鑫化工科技有限公司);柠檬酸钠、柠檬酸、葡萄糖、EDTA(石河子联华商贸有限公司);DNA Marker DL2000、DNA Marker DL500、Taq酶、限制性内切酶MvaI、SacII、Hin1I、HaeIII(宝生物有限公司);琼脂糖Merck(西班牙);蛋白酶K(Sigma,美国);DNA green view(北京天恩泽基因有限公司);MHC-DRB1 exon2引物(上海生工生物工程公司)。
利用绵羊包虫病变肝脏囊液人工感染哈萨克犬获取虫卵试验所用的试剂:吡喹酮(兽药字(2012)310021174);地塞米松(兽药字(2012)290112530);静松灵(兽药字(2009)280031579);丙硫苯咪唑(新兽药字(2012)X 048745)购买于石河子大学动物科技学院动物医院;氯化钠(NaCl)、硫酸镁(MgSO4)、“84”消毒液、新洁尔灭消毒水、碱石灰(钠石灰)等购自石河子北生物商贸有限公司。
哈萨克羊人工感染细粒棘球绦虫后早期肠道免疫指标测定试验所用的试剂:绵羊血清抗体(IgM、IgE、IgG、SigA)、细胞因子(TNF-α、IFN-γ、IL-2、IL-4)及趋化因子(CCL8)ELISA试剂盒均购自上海蓝基生物科技有限公司。
1.1.2.2 仪器
便携式兽用B超仪,50 S Tringa Vet_Pie Medical(荷兰);电热恒温水浴锅,DKB-501A型(上海精密试验设备有限公司);电子天平BL310(Sartorius公司,德国);NANODROP1000核酸蛋白分析仪(Thermo,美国);电热恒温鼓风干燥箱,GZX-9240MBE(上海博迅医疗设备厂);台式高速离心机(Thermo,美国);PCR扩增仪,PTC-100TM型,BIO RAD凝胶成像分析系统(BIO RAD公司) 。
1.2 试验方法
1.2.1 哈萨克羊MHC-DRB1 exon2包虫病抗性、非抗性基因型个体的筛选
1.2.1.1 试验绵羊包虫病的诊断
根据WHO-IWGE推荐诊断包虫病的方法[1],采用影像学(B超)和血清学(ELISA)相结合的方法对300只哈萨克羊包虫病检测。
影像学(B超)检测:先肝脏区(右侧9~11肋间)被毛,涂抹耦合剂,B超显像,对图像冻结、测量分析,同时记录羊耳号。
按照ELISA试剂盒说明书检测包虫病,采用包虫囊液抗原作固相抗原对羊血清中的特异性包虫抗体检测。该试剂盒具有操作简便、准确、实用。
阳性判定:先肉眼观察,显黄色可判为阳性。用酶标仪于450 nm(620 nm作参比波长)读取OD值。以空白对照孔调零后测各孔OD值,待检OD值大于阴性对照2.1倍者为阳性。
1.2.1.2 包虫病抗性、非抗性的哈萨克羊个体筛选
采用新疆生产建设兵团第九师165团规模化羊场300只哈萨克羊作为试验对象,参照前期建立方法[2]筛选出的包虫病非抗性相关的遗传标记MHC-DRB1 Mva I bb-SacII aa-Hin1 I aa和抗性相关遗传标记MHC-DRB1 exon 2 Mva Ⅰ bc-SacⅡ ab-Hin1 Ⅰ ab,对其进行MHC-DRB1 exon2多态性与包虫病抗性进行关联性分析,具体方法如下:
(1)绵羊基因组DNA的提取及质量的检测 先对300只哈萨克羊颈静脉采集血液,肝素钠抗凝,-20℃保存。从-20℃冻存抗凝全血中按照酚-氯仿抽提法提取基因组DNA,并溶解于灭菌去离子水,适当稀释之后,4℃保存。
DNA 浓度和纯度的测定:取待检测DNA溶液约2μL置入一高压灭菌的1.5 mL离心管中;在紫外分光光度计260 nm波长处,测定 OD 值;同时在 280 nm波长处测定OD值;DNA 浓度(μg/mL)= OD值×50;DNA 纯度= OD 260 nm值/OD 280 nm值。比值在1.8~2.0为合格。
琼脂糖凝胶电泳检测试验:对合格的DNA样品进行琼脂糖凝胶电泳检测:取DNA 溶液2.5 μL和溴酚蓝缓冲液2 μL混匀,点样于0.8%的琼脂糖凝胶,在电泳仪上120 V 电压电泳35 min左右,取出胶置于凝胶成像系统中进行拍照。
再从电泳图中看到条带整齐、清晰,则说明DNA样品浓度纯度较好,保存在-20℃备用。
(2)引物设计及PCR扩增 利用巢式PCR技术从所提取的DNA中扩增MHC-DRB1片段,引物参照文献[3]。
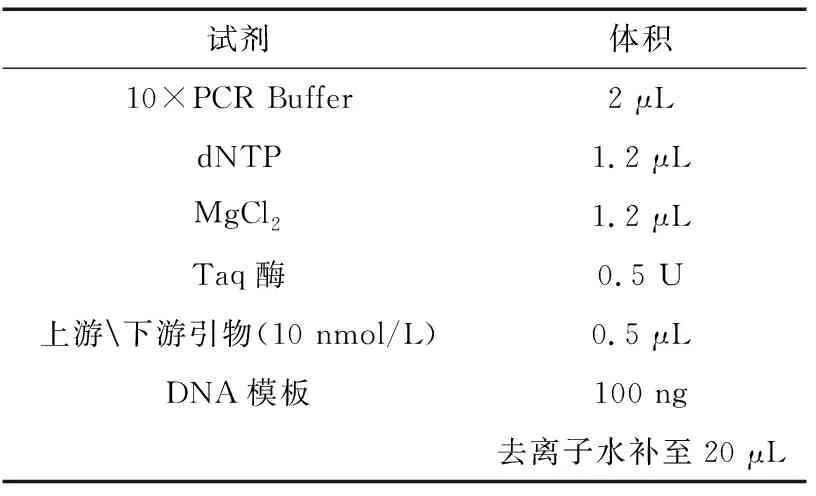
表1 一轮扩增反应体系(试剂及用量)Table 1 round amplification reaction system(Reagents and dosage)
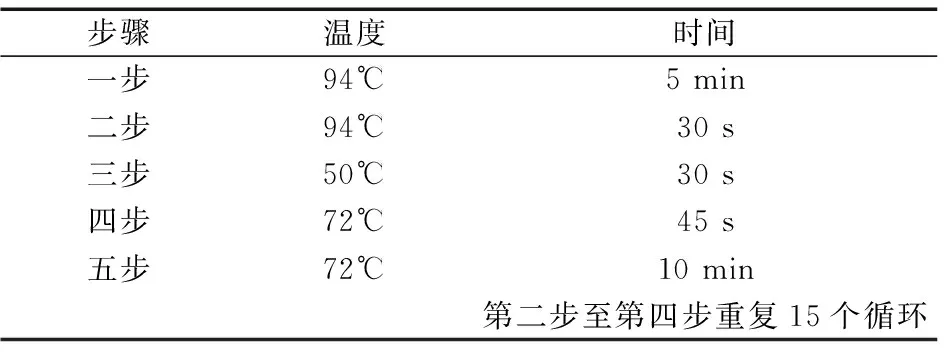
表2 一轮扩增体系(温度及时间)Table 2 round amplification system(Temperature and time)
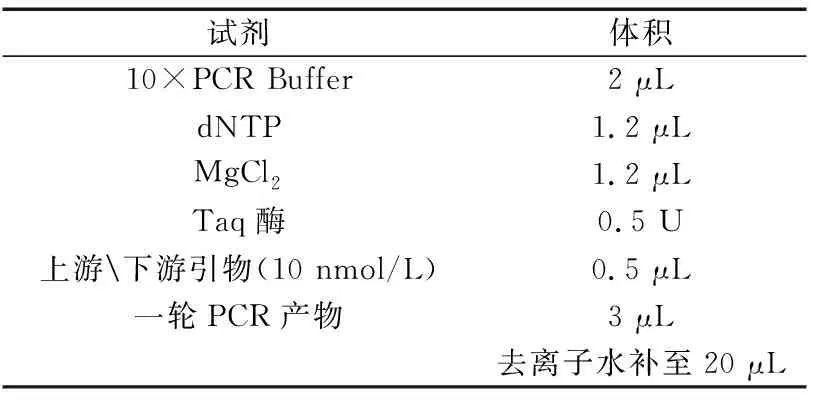
表3 二轮扩增反应体系(试剂及用量)Table 3 two round amplification reaction system (Reagents and dosage)
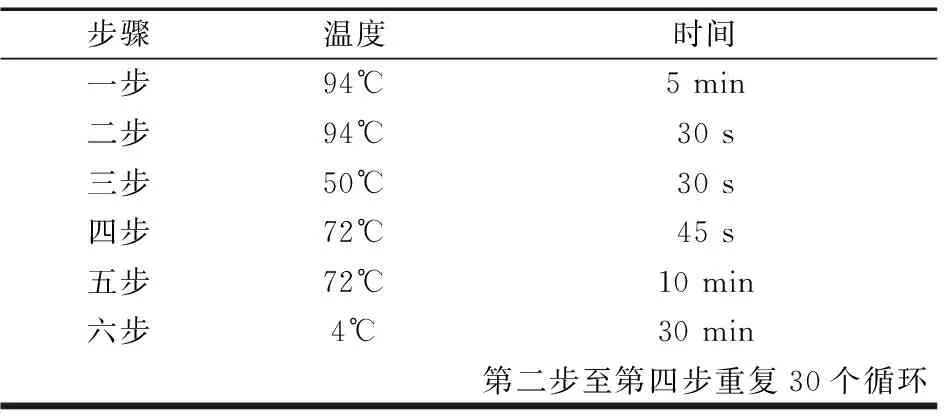
表4 二轮扩增体系(温度及时间)Table 4 two round amplification system(Temperature and time)
PCR产物经2%琼脂糖凝胶电泳分析验证。
(3) PCR产物酶切 对2轮PCR产物分别进行MvaⅠ、SacII、Hin1I的单酶切反应。

表5 酶切反应体系Table 5 enzymatic reaction system
37℃水浴锅内水浴4 h。酶切产物经2%琼脂糖凝胶电泳后,进行凝胶成像系统分析统计酶切结果。
1.2.1.3 数据分析
采用PCR-RFLP法分析哈萨克羊MHC-DRB1酶切基因型与包虫病抗性或易感性的关系。
1.2.2 试验绵羊人工口服感染细粒棘球绦虫模型的建立
1.2.2.1 细粒棘球绦虫虫卵的获取及收集
购买5只2岁健康当地土犬,饲养于石河子大学动物科技学院动物试验站隔离犬舍,用阿苯达唑片和吡喹酮驱虫2次,驱除肠道寄生虫;攻虫前1天肌肉注射地塞米松磷酸钠降低犬的抵抗力。同时收集有包虫病包囊的羊肝,用50 mL注射器抽出包囊液口服饲喂给犬,肝脏一并饲喂。饲养大约42~48天后,采集犬的粪便,涂抹在载玻片上,用显微镜检测犬的粪便,观察到有虫卵后,立即安乐死处死犬。取犬的十二指肠和空肠前半段装入干净的袋子,将肠道组织剪开立即放到37℃的装有生理盐水的烧杯中约2~3 h,同时将处死的犬深埋。待肠道组织完全展开,细粒棘球绦虫成虫露出后,用1 mL枪头吸取成虫到装有生理盐水37℃的干净瓶子中。将成虫捣碎,收集虫卵(图1)。用percoll液纯化虫卵。保存在-4℃。全部过程都在严密防护的条件下进行。
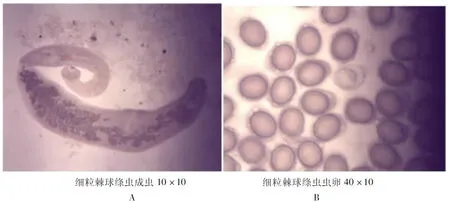
图1细粒棘球绦虫形态(A)及孕节(B)
Fig 1 Modality of Echinococcus granulosus
获取及收集细粒棘球绦虫虫卵的整个试验操作过程要严格遵照试验安全要求,试验操作人员均穿实验服、外穿一次性防护服,戴口罩、帽子、手套,穿长筒胶鞋和胶套;试验结束后对隔离饲养试验犬舍进行全面消毒,地面、墙面及污染的地方喷洒3%烧碱液,再用高锰酸钾和甲醛熏蒸;试验完所有试验器材喷洒2%新洁尔灭消毒液和10%次氯酸钠,杀灭可能残留的虫卵;最后整个试验中用到的防护用品全部焚烧销毁和深埋,以免对周围环境造成污染。
1.2.2.2 人工感染试验
将收集分离得到的细粒棘球绦虫(带孕节)和虫卵进行人工感染试验,试验哈萨克羊采用口服感染虫卵的方法,分别挑取25个细粒棘球绦虫放入盛有生理盐水的培养皿中,然后用20 mL的注射器抽取,并用生理盐水反复冲洗培养皿,确保25个虫子都吸取到注射器里,抗性组和非抗性组每只羊口服25个成虫孕卵节片(虫卵约1万~1.5万枚),对照组口服生理盐水。将所有试验羊隔离编号饲养于石河子大学动科院试验站试验羊舍。
1.2.3 哈萨克羊不同MHC-DRB1基因型个体人工感染细粒棘球绦虫后早期肠道免疫指标的测定
1.2.3.1 样品采集
攻虫后6 h、8 h、10 h分别处死抗性组和非抗性组绵羊各1只(总共6只),并在最短时间内采集绵羊小肠组织(包括十二指肠段、空肠段(空肠前段、空肠中段、空肠后段)、回肠段),每个组织采取1 g匀浆所加1 mL PBS,分离匀浆离心肠道黏膜组织取上清液测定相关抗体的水平,同时颈静脉采血5 mL,3000 g/min离心10 min,分离血清,分装保存于-80℃备用。
1.2.3.2 抗体、细胞因子及趋化因子的检测
按照ELISA试剂盒说明书检测绵羊抗体(IgM、IgE、IgG)、细胞因子(IL-2、IL-4、 SigA、TNF-α、IFN-γ)及趋化因子(CCL8)。
1.3 试验数据处理
1.3.1 哈萨克羊抗性、非抗性基因型筛选
参照前期团队方法对MHC基因型与包虫病关联性进行筛选。
1.3.2 侵染期肠道免疫指标数据处理及分析
上述免疫因子检测数据用SPSS19.0软件分析,采用单因子方差分析(one-way ANOVA,LSD)统计结果显著性检验,所有数据均用平均数±标准差(±SD)表示,当P<0.05,表示差异显著;P<0.01,表示差异极显著。
2 试验结果与分析
2.1 筛选出的包虫病抗性、非抗性哈萨克羊个体
进行MHC-DRB1:MvaI bb-SacII aa-Hin1 I aa非抗性单倍型分析;MHC-DRB1:MvaI bc-SacII ab-Hin1 I ab抗包虫病单倍型分析,根据基因分型结果,返回羊场选择绵羊个体。
2.2 人工模型的建立
本试验采用绵羊包虫病病变的肝脏囊液,口服饲喂感染试验哈萨克犬,45天后从犬粪便中检测虫卵是否感染,从犬小肠收集大量的细粒棘球绦虫成熟孕节,其感染力强,可以满足后续试验。
2.3 抗性和非抗性哈萨克羊个体人工感染细粒棘球绦虫早期肠道免疫指标差异分析
2.3.1 抗体的差异分析
包虫病抗性、非抗性基因型绵羊在人工感染细粒棘球绦虫后,表现出的抗体分泌水平不同,图2显示了两组绵羊在感染细粒棘球绦虫6 h、8 h、10 h,机体小肠中IgE、IgG、IgM的表达水平。
绵羊小肠细粒棘球绦虫早期感染过程中,总体来看,IgE抗性组高于非抗性组,且在空肠后段有显著差异(P<0.05)(图2.A)。IgG抗体在感染过程中,整体上抗性组低于非抗性组,在空肠前段有显著性差异(P<0.05)(图2.B)。IgM抗体在感染过程中,总体上抗性组高于非抗性组,在回肠抗性组明显高于非抗性组(P<0.01)。抗性组IgM分泌呈逐步上升趋势,而非抗性组IgM分泌不规律(图2.C)。

图2免疫球蛋白IgE、IgG、IgM在抗性组和非抗性组的分泌情况
(***表示:P<0.01,差异极显著)
Fig 2 the secretion of immunoglobulin IgE, IgG, IgM in the resistance group and non-resistant group
(*** indicates:P<0.01, the difference was significant)
2.3.2 Th1和Th2细胞因子的差异分析
2.3.2.1 Th1细胞因子
哈萨克羊人工感染细粒棘球绦虫虫卵早期,回肠抗性组IL-2水平显著低于非抗性组(P<0.05),其他肠段,抗性组与非抗性组基本持平。抗性组IL-2的含量在感染早期有逐步上升的趋势, 非抗性组更加明显(图3.A)。
对于TNF-α,抗性组小肠TNF-α的含量均低于非抗性组,但差异不显著。两组TNF-α的分泌先在空肠前升高,后逐步降低(图3.B)。
就IFN-γ而言,总体上,抗性组小肠IFN-γ的分泌均高于非抗性组,且在十二指肠和空肠前段差异显著(P<0.05)。两组IFN-γ的分泌在感染早期开始上升,在空肠前达到峰值随后呈下降趋势(图3.C)。

图3细粒棘球绦虫虫卵感染哈萨克羊后Th1细胞因子在抗性组和非抗性组的分泌
(*表示:P<0.05,差异显著)
Fig 3 the secretion of Th1 cytokines after Kazakh sheep infected with E.granulosus tapeworm eggs in the resistance group and non-resistant group
(* Indicates:P<0.05, significant difference)
2.3.2.2 Th2细胞因子
图4显示两组小肠IL-4分泌水平在十二指肠和空肠前先升高随后呈现下降趋势,差异不显著。
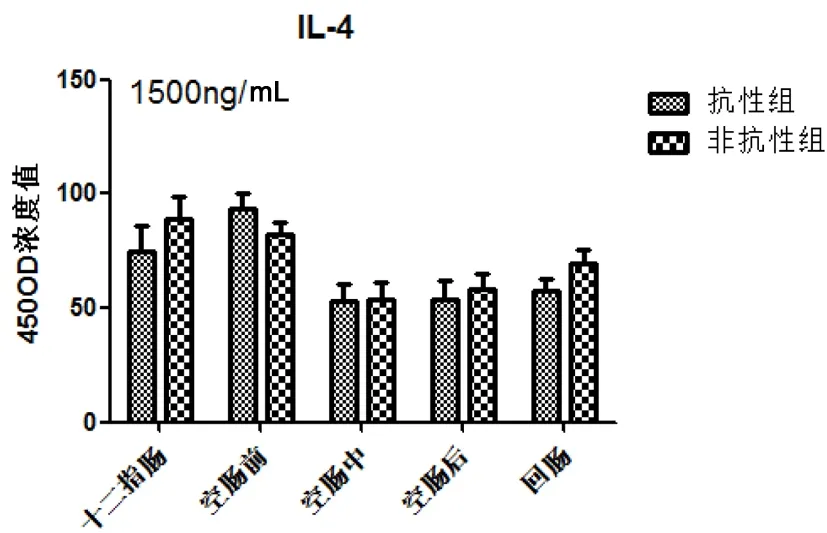
图4 细粒棘球绦虫虫卵感染哈萨克羊后
图5显示抗性组和非抗性组SigA在十二指肠和空肠前分泌升高,随后呈现下降趋势,且抗性组高于非抗性组,且在十二指肠和空肠有差异显著(P<0.05)。
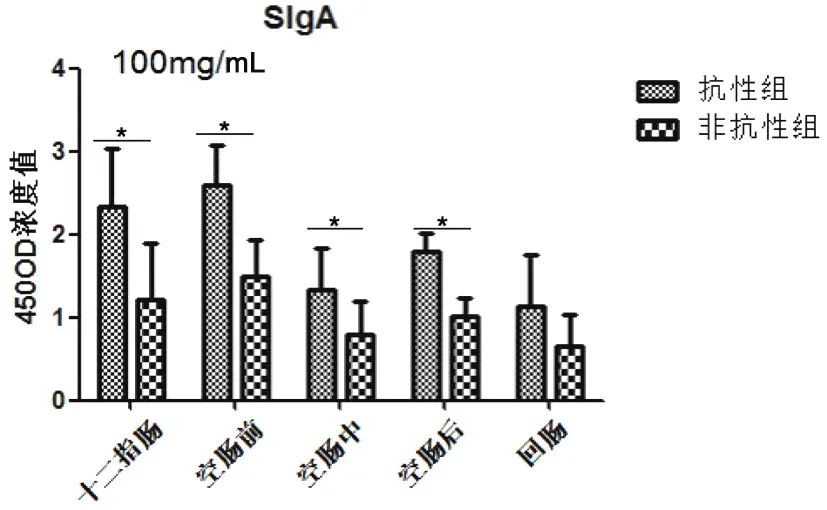
图5 细粒棘球绦虫虫卵感染哈萨克羊后
2.3.3 趋化因子的差异分析
抗性组和非抗性组在人工感染细粒棘球绦虫,趋化因子(CCL8)在总体上抗性组低于非抗性组。在十二指肠分泌水平升高,而后呈下降趋势,两组间差异不显著(图6)。
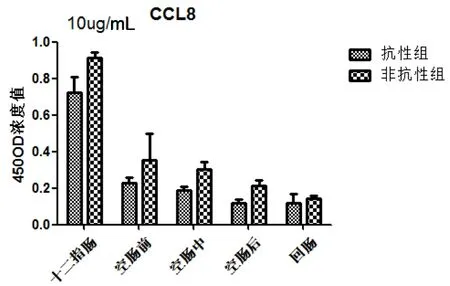
图6 细粒棘球绦虫虫卵感染哈萨克羊后CCL8在抗性组和非抗性组的表达
3 讨论
研究表明,遗传因素影响着生命活动的多种过程。免疫应答发生与否及其发生的强弱均受控于遗传因素。对于特定抗原的刺激,不同的个体所产生的免疫应答水平是有差异的。个体间免疫应答能力的差异由特定的MHC等位基因决定。因为免疫应答的强度或有无受MHC多态性控制T细胞对抗原的识别影响。MHC等位基因不同的个体,其免疫应答能力存在差异。群体中不同个体所携带的MHC等位基因型也是不同的,因此所编码的MHC分子结合特定抗原肽的能力就有差异。MHC分子的多态性制约着T细胞的激活,因为T细胞所识别的抗原肽必须是与MHC I类或MHC II类分子结合的抗原肽,从而使不同个体表现出不同的免疫应答效应[4]。
宿主感染细粒棘球绦虫后,可分为两个阶段:包囊形成前(六钩蚴侵入阶段)和包囊形成后,其界限为虫卵引起6天左右的原发感染。宿主对包囊完全形成的抵抗是很微弱的[5],因此研究六钩蚴侵染早期的机制非常重要。目前,对六钩蚴侵染早期的免疫研究不多,尤其是包囊形成前这一阶段。因此本研究通过让细粒棘球绦虫人工感染抗性和非抗性绵羊试验,探索这两种基因型绵羊在感染细粒棘球绦虫后早期机体的免疫变化。惠文巧等报道,通过对单倍型Mva I bc-Sac II ab -Hin1 I ab绵羊抗细粒棘球蚴和非抗细粒棘球蚴感染小肠测序发现,在抗性和非抗性的绵羊中有195个差异表达基因,其中105个基因是与免疫相关的。这些基因中,大多数上调基因,与先天免疫有关,包括先天免疫细胞(巨噬细胞、NK细胞、肥大细胞和嗜碱性粒细胞)和先天免疫分子(细胞因子、趋化因子、补体、溶解酶和内凝集素—2)[6]。更好地了解宿主对包虫在小肠组织早期免疫应答。
本研究对小肠组织中的免疫球蛋白和部分细胞因子、趋化因子进行了ELISA试验,发现抗性、非抗性绵羊人工感染细粒棘球绦虫后表现出不同的免疫应答能力。抗性组绵羊以抗体IgE、IgM,细胞因子SIgA分泌水平升高,而非抗性组则表现出以抗体IgG、细胞因子IL-2、IFN-γ分泌水平升高。
3.1 抗体的差异分析
研究报道,血清中IgE抗体在感染细粒棘球绦虫的病人肠道免疫中起着重要作用[7],特别是在杀伤六钩蚴过程中发挥重要作用[8]。本研究发现,小肠IgE抗体在细粒棘球绦虫感染10 h后,抗性组高于非抗性组,且有差异显著(P<0.05)。据报道,虫卵经口服感染进入动物经胃肠道孵化为六钩蚴约需2 h[9],因此在虫卵感染后10 h有可能为六钩蚴穿越肠壁进入血液的过程,并且抗性组绵羊小肠各段IgE抗体分泌水平显著高于非抗性组,并与抗原结合后会促使肥大细胞释放大量的趋化因子和炎性介质,募集大量补体和吞噬细胞抵抗六钩蚴的侵入,损伤六钩蚴和减少六钩蚴的存活数量,从而阻止其进入肝脏形成包囊,这有可能之所以抗性组绵羊抵抗包虫病能力强于非抗性组绵羊。
小肠中IgG抗体水平在抗性组低于非抗性组,且高于IgE表达水平。另外发现抗性组小肠IgG含量在空肠前段达到峰值,推测IgG在肠道抵抗六钩蚴的早期侵入过程中不发挥主要作用。Pater等[9]发现在C57BL/6J小鼠腹腔注射多房棘球绦虫囊泡,IgG抗体在感染后2周检测到稳定增加,在感染后14周,总的IgG浓度占到92%。
小肠IgM抗体:IgM在早期感染中发挥重要的免疫防御作用[4],本研究发现,绵羊感染细粒棘球绦虫后10 h,IgM抗体在总体来看,抗性组高于非抗性组,在回肠差异显著,而在其他小肠各段差异不明显。另外发现非抗性组小肠IgM含量在感染后10h内空肠中段显著下降。Pater等[9]通过口服多房棘球绦虫虫卵感染Balb/C小鼠(包虫病易感小鼠)后发现早期机体血清IgM水平显著下降,直到感染后第8周才开始上升。Pater等[9]推测这种早期机体分泌的IgM水平较低可能与易感性有关,据此,推测推测抗性组绵羊因其自身分泌相对较高的IgM抗体在虫体的早期感染中发挥了重要的免疫防御作用。
在抗体水平上,IgE、IgM的分泌在抗性组都高于非抗性组,其中IgE的分泌趋势都比较一致,而IgM分泌从十二指肠到空肠再到回肠依次逐步增加,IgG在抗性组的分泌水平低于非抗性组。据此推测,绵羊在人工感染细粒棘球绦虫后,IgE、IgM在绵羊小肠发挥着重要的免疫作用。
3.2 细胞因子的差异分析
本试验通过对抗性和非抗性哈萨克羊人工感染细粒棘球绦虫虫卵后,使用ELISA试剂盒检测了小肠分泌的Th1、Th2细胞因子,发现两种细胞分泌的细胞因子含量有所差异。以Th1细胞因子IFN-γ、TNF-α、IL-2为代表,抗性组IFN-γ含量高于非抗性组,而IL-2、TNF-α正好相反。Th2细胞因子中SigA分泌在抗性组高于非抗性组,而IL-4分泌水平相当。由于不同的MHC基因型个体会表现出不同的抗病力,而两组绵羊在相同剂量细粒棘球绦虫的刺激下,血清中Th1细胞因子含量有差异,这种差异很可能与动物机体的MHC基因型有关。
3.2.1 Th1细胞因子
IL-2由活化的CD4+Th1细胞产生,具有广泛的生物活性。可以促进Th0和CTL的增殖,因此是重要的调控免疫应答的因子。IL-2参与T细胞的增殖和活化[10],前期研究中,IL-2在抗性绵羊是上调的[11]。而在本研究中,IL-2在抗性组的表达低于非抗性组。
TNF-α由巨噬细胞、树突状细胞,中心粒细胞和Th1细胞产生主要参与炎症前信号通路,比如细胞因子产生和细胞凋亡[12-13]。TNF抑制在克罗恩病治疗中起重要作用[12]。有研究报道,细胞因子γ干扰素(IFN-γ)水平可以作为依赖巨噬细胞的原头节杀伤效应[14]。前期研究发现,哈萨克羊人工感染细粒棘球绦虫后,抗性组绵羊血清IFN-γ、TNF-α的含量高于非抗性组绵羊,尤其是IFN-γ在感染后4 h、9 h、1 d和7 d,差异是比较显著的,TNF-α在感染后4 h,组间差异显著[15]。本研究中,TNF-α在抗性组绵羊中的十二指肠和回肠表达上升,在空肠前段表达下降分泌低于非抗性组。结果表明TNF-α在小肠可能促进了表皮细胞和Th1细胞的凋亡,从而减轻了免疫应答。而IFN-γ在十二指肠、空肠前分泌水平显著高于非抗性组,表明IFN-γ可能在小肠前端参与了细粒棘球绦虫虫卵感染的免疫应答。
在本研究中,抗性组相对较高的IFN-γ细胞因子分泌量,很可能与含有MHC抗性基因型有关。这与Godot等[16]在人类上的研究一致,他发现带有MHC抗性等位基因的人血清中TNF-α等细胞因子含量高于带有MHC易感性等位基因的人群。有文献报道,在抵抗棘球绦虫侵入机体的早期,IFN-γ在幼虫形成的初始阶段发挥着重要的作用,其分泌量越高,清除病原能力越强[16]。因此本试验中抗性组绵羊感染细粒棘球绦虫早期高的IFN-γ分泌量可能在虫体杀伤力或阻止虫体的进一步发育方面发挥了重要作用。A/J小鼠感染AE后产生较高水平的IFN-γ,提示与包虫病的抗性有关[17]。本试验证实了Th1细胞因子参与宿主抵抗包虫病的保护性免疫这一观点[18]。
3.2.2 Th2细胞因子
人类和小鼠IL-4分别主要由活化的T细胞和Th2亚群产生。IL-4对T细胞、B细胞和巨噬细胞发挥免疫调节作用。有报道,IL-4在人类黏膜固有层单核细胞产生,在有炎症的肠道细胞产生的IL-4低于正常细胞产生的。当加入植物凝集素到新鲜的LPMCs,IL-4抑制了IL-2诱导增殖。IL-4 在炎症性肠病的减少可能引起缺陷性的免疫抑制和抗炎症机制,有助于疾病病理发生。IL-4 差异性调节LMPC活性可能影响黏膜免疫内稳态[19]。在本研究中,IL-4在抗性组和非抗性组分泌水平都上升且相当。这可能暗示细粒棘球绦虫虫卵感染后,IL-4抗性和非抗性绵羊都发挥了免疫作用,但不是其发挥作用的主要差别。Emery等报道,BALB/c小鼠感染泡球蚴(AE)后产生高水平的IL-4,暗示与包虫病的易感性有关[17]。
sIgA 在肠道黏膜免疫中起关键作用,是阻止细菌、病毒等入侵黏膜的第一道有效防线。包含2 个外加的多聚多肽链J链和多聚Ig受体单位和分泌片段(SC),其分泌后与上皮细胞紧密连接在一起,分布于黏膜或浆膜表面而发挥免疫作用。sIgA 主要通过免疫排除、阻抑黏附、溶解细菌、中和病毒、介导ADCC等机制发挥作用[20-21]。在本研究中,sIgA在抗性组均高于非抗性组,且在十二指肠和空肠前有显著差异(P<0.05),表明SIgA可能在小肠前端发挥主要的黏膜免疫作用。据报道,小鼠在游泳训练中,sIgA在回肠中的表达上升,参与了应激反应。而且温和的训练显著增加了先天性免疫细胞因子(包括TNF-α,IL-12,IL-6和IL-10)以及适应性免疫细胞因子(含有IL-2,IL-4,TGF-β和IFN-γ)的表达水平[22]。
本研究发现IL-4为代表的Th2细胞因子分泌水平在非抗性组绵羊小肠中均低于抗性组绵羊,但两组间差异不显著。这表明Th2细胞因子在细粒棘球绦虫侵入机体的早期,在抗性组绵羊机体中并无优势,那么,Th2细胞因子是否与包虫病的抗性有关有待进一步研究。目前,有关宿主口服感染细粒棘球绦虫虫卵后早期机体Th细胞因子的活性研究较少[23]。
总之,在哈萨克羊感染细粒棘球绦虫虫卵后,小肠中的sIgA和IFN-γ分泌增加,而大部分细粒棘球蚴病患者的IL-4、IL-6、IL-5和IL-10水平增高,IgG4、IgG、IgE类型抗体水平也升高,说明Th2细胞被活化[5]。
3.3 趋化因子的差异分析
本研究检测了两组绵羊在感染细粒棘球绦虫虫卵后小肠中的CCL8为代表的Th1趋化因子,结果显示抗性组小肠组织水平低于非抗性组。
CCL8是一个小的细胞因子属于趋化因子家族。可以利用多个细胞受体吸引和激活人的白血球。CCL8在结肠炎的CD169+巨噬细胞选择性表达,是表皮受损诱导黏膜炎症的一个重要调节因子[24]。CCL8可以激活很多免疫细胞,包括肥大细胞、嗜酸性粒细胞、嗜碱性粒细胞、单核细胞、T细胞和NK细胞参与炎症反应。本研究中,抗性组CCL8分泌均低于非抗性组,在十二指肠均表现出高水平的分泌,表明在感染细粒棘球绦虫早期,CCL8在抗性和非抗性绵羊的十二指肠都发挥了重要的免疫作用。表明了CCL8可能受到某些因子的影响没有激活了T细胞和单核细胞参与炎症反应。
