CT和MRI在肝细胞癌微血管浸润中的诊断价值
2018-11-12杨国庆付泉水
胡 纳,杨国庆,付泉水
(遂宁市中心医院放射影像科,四川 遂宁 629000)
肝细胞癌(Hepatocellular carcinoma,HCC)作为常见的临床恶性肿瘤,是一种高发病率和死亡率的原发型肝癌,在所有肿瘤中分列第六位及第三位[1]。目前,外科肝段切除和肝移植被认为是维持肝癌患者肝功能的首选方法。然而,术后复发仍然是HCC治疗的一大挑战。微血管侵犯(Microvascular invasion,MVI)是否存在被公认为是HCC术后复发和预后的重要因素[2-4]。临床工作中MVI的存在与否依赖于术后病理评价,本文通过回顾性研究,探讨HCC的CT、MRI影像学征象与MVI的相关性。
1 材料与方法
1.1 病例资料
收集2014年3月—2017年10月在我院行肝肿瘤肝段切除术的患者94例,经手术病理证实为HCC的共68例,其中男53例,女15例,平均年龄(62.37±13.46)岁。纳入标准:①手术前未接受过抗肿瘤治疗(如TACE术等),且术前有完整的CT或MRI平扫及动态增强扫描资料;②肝癌影像诊断标准遵循美国肝病研究协会(American association for the study of liver diseases,AASLD)2010 年指南及2013年更新版。排除标准:术前接受过肿瘤局部治疗或CT、MRI检查与手术期之间接受肿瘤相关治疗的患者。
1.2 影像检查
CT扫描方法:采用Siemens公司Somatom Sensation 64排多层螺旋 CT (Multi-detector computed tomography,MDCT)检查。 准直 5 mm,层厚 6.5 mm;经由肘静脉置入20G留置针,使用Ulrich双筒高压注射器注入非离子型对比剂(碘海醇,300 mgI/mL),持续时间固定为30 s,后紧跟流速相同的40 mL生理盐水。采用自动触发技术,感兴趣区放置于腹主动脉腹腔干层面,当CT值达到100 HU时,自动触发扫描,延迟10 s后开始采集动脉期,45 s后采集门脉期,150 s后采集平衡期。扫描范围由膈顶至肝下角水平。MRI扫描方法:采用Siemens公司Avanto 1.5T MR 检查。 常规轴位 T1WI-TSE、T2WI-TSE、T2WI-TSE+抑脂、T1WI-VIBE+抑脂四期动态增强扫描(动脉期、门脉期、肝实质期及平衡期)与DWI,用相控阵柔软体部线圈。各序列采用多次屏气扫描,单次屏气时间为10~15 s,层厚8 mm,层间距2 mm,视野 350 mm×350 mm~400 mm×400 mm,层面、层厚及层间距、FOV均复制保持一致。DWI为自旋回波的平面回波序列(Echo planar imaging,EPI),TR 3200ms,TE 94ms,矩阵 128×128,b 值为 50s/mm2及 800s/mm2,扫描时在肝脏上方与下方各加一个预饱和带,以消除气体及运动伪影对图像质量的影响。选取肿瘤的最大层面,在DWI(b=800 s/mm2)图像上沿肿瘤边缘画感兴趣区,包括整个肿瘤,然后将感兴趣区拷贝到同层的ADC图像上,从而得到ADC值,如果肿瘤为多发,仅测量最大的病灶[5-6]。
1.3 影像图像观察
由两名资深的放射学专家分别对CT、MRI图像中肿瘤边缘模糊(图1a~1d)、瘤内动脉和低密度/信号环征象 (Two-trait predictor of venous invasion,TTPVI)(图 2a)、 门脉分支癌栓 (Portal vein tumor thrombosis,PVTT)(图 1d) 等影像征象及弥散系数(Apparent diffusion coefficient,ADC)(图 2c,3c)值进行判定。其中将边缘模糊征象细分为局部外凸结节(图 1a,1b)、局部包膜不完整(图 2a)、多结节融合(图1c)、瘤内新月征(图1d)及多征象叠加等5个部分。
在判定方面,将肿瘤边界光滑定义为[7-8]任意层面(轴位、冠状、矢状位)显示肿瘤与正常肝组织间分界清楚;将边缘模糊定义为局部外生性结节凸入邻近非肿瘤组织或多结节型呈现多发外生性结节局部凸入邻近非肿瘤组织;瘤内新月征系肿瘤局部突破假包膜向外成新月形膨胀性生长,归类为肿瘤边缘模糊。TTPVI定义为[8-9]动脉期同时具有两种独立的影像特征,即瘤内动脉显影和肿瘤边缘不完整低密度/信号环征象。
1.4 病理学观察取材
结合术前CT、MRI影像征象,在大体标本对应层面处,取癌组织与非癌变肝组织交界区组织。染色与观察:按常规程序进行HE染色,显微镜下重点观察肿瘤有无包膜、有无包膜侵犯、有无癌结节、肿瘤内有无坏死、癌旁血管内有无癌栓、边缘(或包膜内)有无血管等。然后进行FⅧ因子相关抗原(FactorⅧ related antigen,F8RA)单克隆抗体免疫组化染色。免疫组化采用SABC法,抗F8RA单克隆抗体稀释度为1∶50,染色阳性代表血管。由病理科医生观察免疫组化染色切片,确定是否为血管内癌栓。
1.5 统计学分析
使用SSPS 22.0软件包对数据进行统计分析,连续变量表达为均值±标准差(x±s),类别变量表达为频率或者百分数。采用Fisher精确检验方法对组内各征象进行差异性检验。采用CohenK检验方法对两名资深放射学家的吻合度进行评判,其中K值>0.8 为较一致吻合,>0.60~0.80 为欠一致吻合,>0.40~0.60为中度吻合,≤0.40为不吻合。在ADC值分析中,用K-S方法对连续变量正态性进行检验,若符合正态分布,则采用t检验进行差异性分析,若不符合则采用Mann-Whitney U检验方法。应用受试者工作特征曲线 (Receiver operator characteristics,ROC)比较边缘模糊、TTPVI及PVTT等征象对MVI的诊断性能。P<0.05为差异具有统计学意义。
2 结果
在68例HCC患者中,共有51例行CT平扫及动态增强检查,17例行MRI平扫及动态增强检查,经病理检查证实,68例患者中,具有MVI的病灶为41例,占 60.29%。 MVI组的肿瘤直径为(4.64±1.33) cm,非 MVI组的肿瘤直径为(4.12±1.19) cm,二者无明显差异(P=0.478)。
两名资深放射学专家在对所有病灶影像的判定中具有较一致的吻合率(K>0.8)。各影像征象与经病理证实的MVI及非MVI的判定结果为:边缘模糊、TTPVI及PVTT 3组征象均与MVI的存在具有显著的相关性 (P<0.001,P<0.001,P=0.037;P<0.001,P<0.001,P=0.037)。 在边缘模糊征象中,局部包膜不完整与 MVI具有最强的相关性(P=0.011,P=0.005)。此外,在ADC值的比较中,两位观察者的ADC测量值无显著性差异(P=0.667),采用观察者1的结果进行分析。在行MRI检查的17例患者中,经病理证实8例 HCC患者具有 MVI,其 ADC平均值为 (1.21±0.33)×10-3mm2/s(n=8),非 MVI患者的 ADC 平均值为(1.03±0.17)×10-3mm2/s(n=9),二者 ADC 平均值具有明显差异(P<0.001)。
曲线下方区域面积(Area under ROC,AUROC)比较这3种征象判定性能结果显示(图5):在两位观察者中,边缘模糊(AUROC=0.84,AUROC=0.84)及 TTPVI(AUROC=0.84,AUROC=0.85)征象均在判定 MVI 性 能 上较 PVTT (AUROC=0.59,AUROC=0.59) 征象更显著 (P<0.001,P<0.001;P<0.001,P<0.001);而边缘模糊与TTPVI征象间比较则无显著性差异(P=0.06,P=0.22)。
3 讨论
HCC是临床常见的恶性肿瘤,已经成为全球性健康问题。目前,外科切除和肝移植是治疗该类疾病的重要手段,据文献报道,HCC肝移植后5年复发率达到25%,而HCC肝段切除后5年复发率达到了近70%[10-11]。HCC血管浸润已经反复被证明与肿瘤的复发密切相关,其中,大血管浸润与MVI可以分别增加15倍及4.4倍以上的肿瘤复发风险[12-14]。病理学是MVI诊断的金标准,然而,标本的取得是在肝段切除术后或肝移植术后,对HCC治疗方案的选择与疗效难以进行预判。
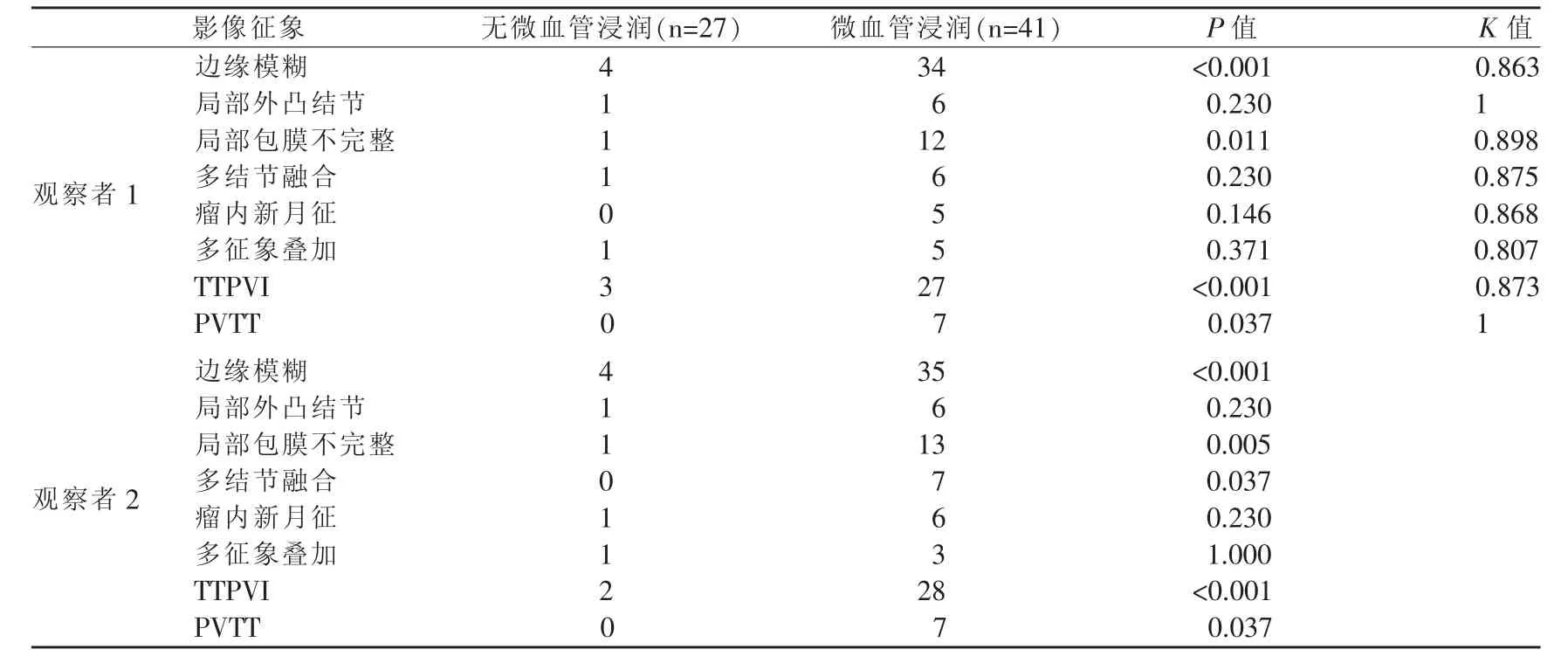
表1 HCC有无MVI的CT及MR征象判定结果
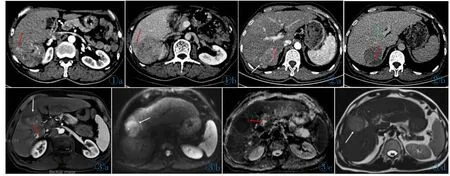
图1 男,62岁,原发型HCC并MVI。图1a,1b:CT轴位图像动脉期及延迟期分别显示局部外凸结节(红箭)。 图2 男,62岁,原发型HCC并MVI。图2a,2b:动脉期及延迟期显示瘤内新月征(红箭);动脉期显示多结节融合(白箭);门静脉期显示门静脉癌栓(绿箭)。 图3男,58岁,原发型HCC并MVI。图3a:MR轴位图像,动脉期显示瘤内血管(红箭),并包膜局部不完整(白箭)(TTPVI);图3b:DWI显示肝癌呈稍高信号,并局部浸润;图 3c:ADC 图呈稍低信号,平均 ADC 值为 1.02×10-3mm2/s;图 3d:T2WI低信号环局部缺如(白箭)。Figure 1. Male,62 years old,with HCC MVI.Figure 1a,1b:A focal extranodular extension(red arrow)in arterial phaseand delayed phase respectively were shown on CT axial images. Figure 2. Male,62 years old,with HCC MVI.Figure 2a,2b:CT axial images of arterial phase and delayed phase showed a crescent extranodular extension beyond the tumor capsule(red arrow)respectively;Multinodular confluent appearance in arterial phase(white arrow);PPVT in portal venous phase(green arrow).Figure 3. Male,58 years old,with HCC MVI,MR axial images.Figure 3a:The TTPVI features:internal arteries(red arrow)and uncontinous hypoattenuating halos(white arrow)in the arterial phase;Figure 3b:The increased signal intensity in tumor with focal infiltrative margins was shown on diffusion map;Figure 3c:Lesion was shown with mean diffusion value of 1.02×10-3mm2/s on corresponding ADC map;Figure 3d:Uncontinous hypoattenuating halos(white arrow)was shown on T2WI axial image.

图4 男,49岁,原发型HCC,无MVI。图4a:MR轴位图像示包膜完整(白箭);图4b:动脉期显示瘤内血管(白箭);图4c:ADC图呈稍高信号,平均 ADC 值为 1.24×10-3mm2/s;图 4d:弥散加权成像显示 HCC 呈高信号(白箭)。Figure 4. Male,49 years old,HCC without MVI.Figure 4a:Continous hypoattenuating halos(white arrow);Figure 4b:Internal arteries(white arrow);Figure 4c:Lesion with mean diffusion value of 1.24×10-3mm2/s on ADC map;Figure 4d:High signal intensity(white arrow)on diffusion map.
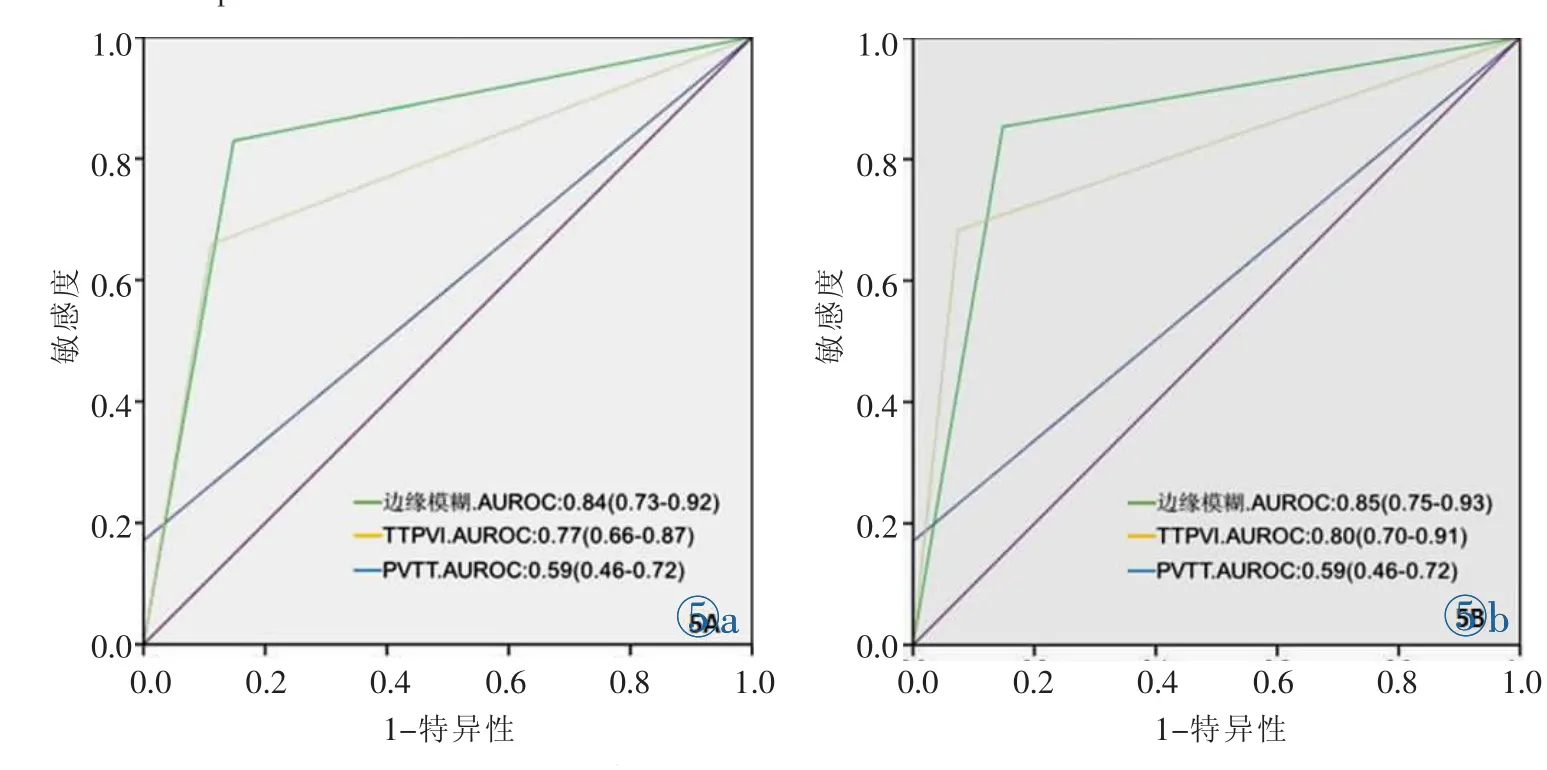
图5 3种不同MVI征象的ROC曲线比较,图5a为观察者1,图5b为观察者2。图5a:边缘模糊AUROC与TTPVI AUROC二者之间无明显差异(P=0.06),并且均明显高于 PVTT (P<0.001,P<0.001)。图5b:边缘模糊AUROC与TTPVI AUROC二者之间无明显差异 (P=0.22), 并且均明显高于 PVTT (P<0.001,P<0.001)。Figure 5. Comparison for three features of MVI.Figure 5a:Observe 1;Figure 5b:Observe 2.Figure 5a:There were no significant differences between Non-smooth margin and TTPVI(P=0.06),but both higher than the presence of PVTT(P<0.001 and P<0.001,respectively).Figure 5b:There were no significant differences between Non-smooth margin and TTPVI(P=0.22),but both higher than the presence of PVTT(P<0.001 and P<0.001,respectively).
本研究通过对边缘模糊(局部外凸结节、局部包膜不完整、多结节融合、瘤内新月征及多征象叠加)、TTPVI及PVTT等各种影像征象与HCC是否存在MVI进行相关性分析,结果显示这3种影像征象均具有较明显的临床价值。其中,TTPVI作为单一征象,与MVI的存在具有最强相关性。
Chou等[15]对102位行CT扫描的HCC病患进行回顾性分析,发现边缘模糊对判定MVI具有显著性意义(P<0.001);Renzulli等[7]对 140 位 HCC 病患进行研究后发现边缘模糊征象对判定MVI具有显著性意义(P<0.001),其中局部包膜不完整征象具有最高的相关性(P<0.001)。在本研究所有边缘模糊影像征象中,局部包膜不完整征象与MVI亦具有最高的相关性(P=0.011,P=0.005)。 可以看出,边缘模糊征象尤其是局部包膜不完整征象可以较好的提示MVI的存在。
Segal等[9]将瘤内动脉和低密度/信号环同时存在的征象定义为TTPVI,发现其与HCC的MVI具有密切关联性。在Renzulli等[7]的研究中,亦将TTPVI作为征象之一进行观察,发现TTPVI在MVI的征象中存在率高达 81.1%(观察者1) 及 82.2%(观察者2),与 MVI具有显著相关性(P<0.001,P<0.001)。 在本研究中,由于样本量较上述研究者低,TTPVI在MVI的征象中存在率为 60.98%(观察者 1)及65.85%(观察者 2),比例略低,但与 MVI亦具有显著相关性(P<0.001,P<0.001)。 TTPVI作为一种较为新颖的影像征象,在预测MVI存在方面具有重要的意义。分析其原因,低密度/信号环即肿瘤呈膨胀性生长,对邻近的非癌变肝组织产生压迫,引起纤维结缔组织增生以及邻近肿瘤缘压缩肝组织,形成低密度环/T1WI及T2WI低信号,但同时由于肿瘤细胞及其间质细胞产生大量促进血管生成的细胞因子,使纤维结缔组织内血管生成活跃,导致肿瘤边缘新生血管丰富,形成瘤内血管征,但血管壁基底膜不完整、内皮欠连续,因此,肿瘤细胞容易穿透不完整的血管壁进入血循环,从而导致MVI与肝内转移,同时致假包膜不完整,边缘模糊。
DWI序列从分子水平提供组织的代谢信息,可以通过计算ADC值量化,由于人体组织水分子的扩散系数受到细胞膜、细胞质等结构的限制和血流灌注的影响,故在描绘人体的水分子扩散状态时只能用ADC值来表达。很多恶性肿瘤都表现出ADC值升高,更有研究表明,DWI能显著提高HCC的检出率[16-18],然而目前各种DWI的b值设定尚未标准化。本研究为回顾性分析,故选用b值为原始设定的50 s/mm2、800 s/mm2, 结果显示MVI组ADC值明显低于非 MVI组(P<0.001)。与本研究结果类似,Suh 等[18]的研究将 b值设定为 50 s/mm2、400 s/mm2、800 s/mm2时,结果表明ADC值在两组中具有明显差异(P<0.005), 将 1.11×10-3mm2/s作为临界值诊断 MVI 时的灵敏度为 93.5%、特异度为 72.2%。 晏耀文等[5]的研究将b值设定为0 s/mm2、500 s/mm2时,结果亦有明显差异(P<0.005),将 1.33×10-3mm2/s 作为临界值判断HCC存在MVI的敏感度为 75.0%、特异度为68.2%。本研究因病例数少以及选用了原始b值等因素而未能做出ADC临界值,但也可以从两组ADC值有明显差异上肯定,ADC值确实在预测HCC是否存在MVI上具有显著的临床应用价值。
肝脏三分之二供血来自于门静脉,肝癌病患会因侵犯邻近门静脉分支,在内形成肿瘤栓子。本研究发现HCC具有边缘模糊或TTPVI中一个或多个影像征象,同时合并PVTT时,具有MVI的风险明显提高。本研究中,有7例(10.14%)HCC合并PVTT均只存在于MVI组,并对提示MVI具有统计学意义(P=0.037)。
原发型HCC的MVI早期位于肿瘤边缘,肝内播散首先集中在门静脉分支系统内,这也可以解释手术切缘大于1 cm或规则性肝段切除术为什么能获得更好的生存期,因为合并切除了潜在的微转移灶。也就是说MVI的存在与否与HCC肝段切除术后或肝移植术后复发密切相关,目前诊断MVI的金标准为术后标本病理学检查,但这种方式是相对滞后的。
本研究证实了边缘模糊、TTPVI、PVTT等影像征象以及ADC值对判定MVI具有较明显的临床价值,但还存在一些不足。首先,本研究的样本数量还很欠缺,特别是MR样本量过少,无法进行MVI的ADC临界值分析;其次,本研究中HCC病患主要为大直径肿瘤,缺少对肿瘤直径与MVI的相关性分析;第三,由于是回顾性分析,DWI的b值缺乏前瞻性设定,仅选用了2个b值,对研究的准确性具有一定的影响,在多b值的设定上还有待进一步探讨。
综上所述,MVI对HCC的治疗方式的选择及预后发展都有着重要意义。通过CT和MRI的各种影像学特征能前瞻性预判MVI情况,为手术治疗方案的选择和术后疗效的预判提供依据。
