急性低温胁迫对史氏鲟幼鱼抗氧化和免疫指标的影响
2018-11-12张厚本唐大明张德志
管 敏,张厚本,王 龙,唐大明,张德志,姜 伟
(中国长江三峡集团公司中华鲟研究所,三峡工程鱼类资源保护湖北省重点实验室,湖北宜昌 443100)
史氏鲟 (Acipenserschrenckii) 俗称七粒浮子,主要分布于黑龙江、乌苏里江和松花江等地,因其生长速度快、抗逆性强、肉质鲜美,具有较高的营养价值和经济价值,逐渐发展成为我国鲟养殖的主要品种之一[1]。史氏鲟作为一种亚冷水性鱼类,环境温度是影响其正常生长和代谢的重要环境因子之一,其最适生长水温为19~22 ℃[2]。在史氏鲟的养殖过程中,经常出现因季节更替、气候变化及人为因素的原因导致水温出现节律性或突发性的温度骤变[3],从而对其造成一定程度的低温胁迫。低温胁迫包括冷驯化和温度骤变,前者是指水温的缓慢降低(慢性低温胁迫),而后者则指水温的骤降(急性低温胁迫)[4]。研究表明,低温胁迫可以对鱼类的行为[5]、营养代谢[6]、血液指标[5]、抗氧化能力[7]、免疫[8]、生殖进程[9]、胚胎发育和仔鱼发育[10]等产生影响。当低温胁迫的强度在鱼体耐受范围内时,鱼体会通过自我调节适应低温环境;当低温胁迫的强度超出鱼类承受能力时,鱼体内环境稳态将发生不可逆的改变,最终导致死亡[11]。因此,研究急性低温胁迫对史氏鲟抗氧化和免疫的影响,可为史氏鲟的人工养殖和运输提供重要的理论指导,具有非常重要的实际意义。
目前,关于史氏鲟的研究主要集中在营养[12]、繁殖[1]、病害[13]等方面,而关于急性低温胁迫对史氏鲟抗氧化防御系统和免疫系统的影响研究未见报道。本实验通过研究急性低温胁迫条件下史氏鲟幼鱼抗氧化和免疫指标的变化情况,掌握水温骤降对其代谢水平和生理状况的影响,从而为深入研究史氏鲟幼鱼应激反应及耐寒机理提供理论依据,也为优化史氏鲟的养殖、运输技术提供重要的参考依据。
1 材料与方法
1.1 实验材料
实验鱼为中国长江三峡集团公司中华鲟研究所2016年全人工繁殖所得的史氏鲟幼鱼。随机挑选规格一致、体质健康史氏鲟幼鱼162尾,体质量为 (180±16)g,体长为(30.50±1.50)cm,并将其暂养于直径4.0 m的养殖池中,暂养水温为23 ℃,溶氧6.0~7.0 mg/L,pH 7.3~7.6,氨氮0.01 mg/L,亚硝氮为0.005 mg/L,每天饱食投喂1次,3 d后开始实验,实验开始前1 d停止投喂。
1.2 实验设计
实验在直径4.0 m、水深0.8 m的实验池中进行,实验水温设置3个温度水平,分别为23、17和11 ℃,其中,23 ℃组为常温对照组,每个温度组设3个平行组,每个平行组18尾鱼。具体方法为:使用循环水系统的制冷机将实验池中的水温由23.0 ℃降至设定温度后,将实验鱼从水温23℃的暂养池中分别直接转至水温为11、17和23 ℃的实验池中,2 h后再转回水温23 ℃的暂养池中进行恢复,并于0、3、6、12、24、48 h时取样,每个温度组每次取样9尾鱼;23 ℃组作为对照组,虽然水温没有变化,但也要经历人为转鱼的操作过程,避免人工操作对实验造成的误差。实验期间,连续充气,每隔30 min校准调节一次温度,维持温差在±0.5 ℃。
1.3 样品的采集处理及各项指标的测定
用120 mg/L的MS-222将实验鱼快速麻醉后解剖,取肝脏组织。用预冷的鱼用生理盐水将肝脏冲洗干净,滤纸吸干水分后将其切成小块,并置于2 mL离心管中,经液氮快速冷冻后,置于-70 ℃保存待测。
抗氧化指标包括超氧化物歧化酶(SOD)活性、过氧化氢酶(CAT)活性、谷胱甘肽(GSH)含量、丙二醛(MDA)含量、总抗氧化能力(T-AOC)活性;免疫指标包括溶菌酶(LZM)活性和免疫球蛋白M(IgM)。以上指标的测定采用南京建成生物工程研究所研制的试剂盒,具体实验方法参考其说明书。
1.4 数据统计
实验数据用SPSS16.0和Excel 2016软件进行统计分析与作图,利用单因素方差分析(One-Way ANOVA)和Duncan’s多重比较检验低温胁迫对各项指标影响的显著性,差异的显著性以P< 0.05为标准,结果以平均值±标准差(Mean±SD)表示。
2 结果
2.1 急性低温胁迫条件下史氏鲟幼鱼的行为表现
当水温由23 ℃骤降至17 ℃时,史氏鲟幼鱼的应激反应强烈,呼吸频率加快,四处乱窜,不断撞击池壁,10 min后游动逐渐变慢,30 min后大部分鱼伏底不动;当水温由23 ℃骤降至11 ℃时,史氏鲟幼鱼应激反应更为强烈,甚至有鱼跳出水面的现象,随着时间的推移,鱼体游动的速度迅速下降,15 min后伏底不动,低温胁迫结束时,鱼体吻端、腹部和肛门充血,但未出现死亡现象。
2.2 急性低温胁迫对史氏鲟幼鱼抗氧化指标的影响
2.2.1 SOD活性
如图1所示,17 ℃和11 ℃组SOD活性随恢复时间延长均呈波浪式变化,但11 ℃组SOD活性趋势变化的时间拐点明显滞后于17 ℃组;在23 ℃组中,SOD活性随着恢复时间的增加总体呈缓慢增加的趋势,其中,0 h组与48 h组差异显著。此外,在0 ~3 h时,SOD活性随水温骤降温差的增大呈先升后降的趋势,且17 ℃组与11 ℃、23 ℃组差异显著。
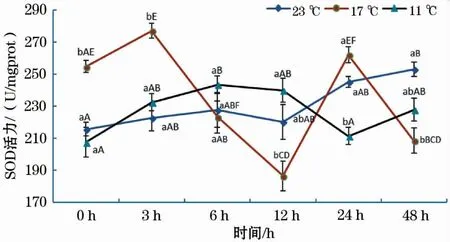
图1 急性低温胁迫对史氏鲟幼鱼SOD活性的影响Fig.1 Effect of acute temperature stress on the SOD activity of juvenile Amur sturgeon图柱上方不同小写字母表示同一时间段内不同温度组之间差异显著(P<0.05),不同大写字母表示同一温度组不同恢复时间差异显著(P<0.05)(下同)。
2.2.2 CAT活性
图2显示,各温度组CAT活性的变化趋势与SOD相似。在11 ℃组中,6 h的CAT活性最大,显著高于3 h组和24 h组;17 ℃组中,CAT活性在24 h时达到最大值,且24 h组与0 h组、3 h组均差异显著;23 ℃组中,0 h组、3 h组CAT活性均显著低于24 h组和48 h组。此外,17 ℃组CAT活性在各个时间段均高于11 ℃组和23 ℃组,但在0~12 h中差异均不显著。
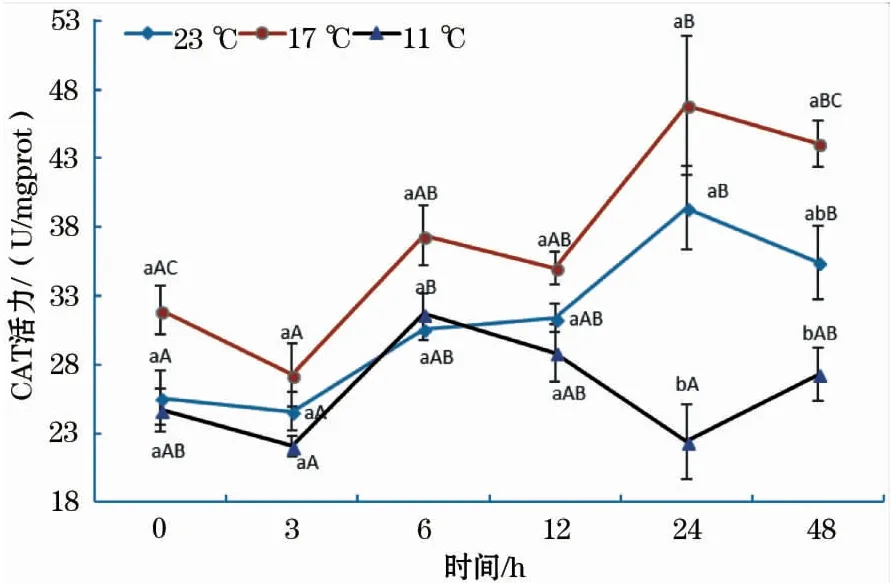
图2 急性低温胁迫对史氏鲟幼鱼CAT活性的影响Fig.2 Effect of acute temperature stress on the CAT activity of juvenile Amur sturgeon
2.2.3 GSH含量
结果显示,各温度组GSH含量随恢复时间的增加均呈波浪式变化(图3)。在17 ℃组中,GSH含量先下降后升高,于24 h达到最大值,随后又显著下降;23 ℃组GSH含量的变化趋势与17 ℃组相同,但各时间点之间差异不显著;11 ℃组中,GSH含量在0~12 h显著增加,24 h时出现显著下降,随后升高。结果还显示,在0 h时,11 ℃组GSH含量显著低于17 ℃、23 ℃组;而在6 h时,11 ℃组显著高于17 ℃、23 ℃组;其它时间段内,各组之间差异不显著。
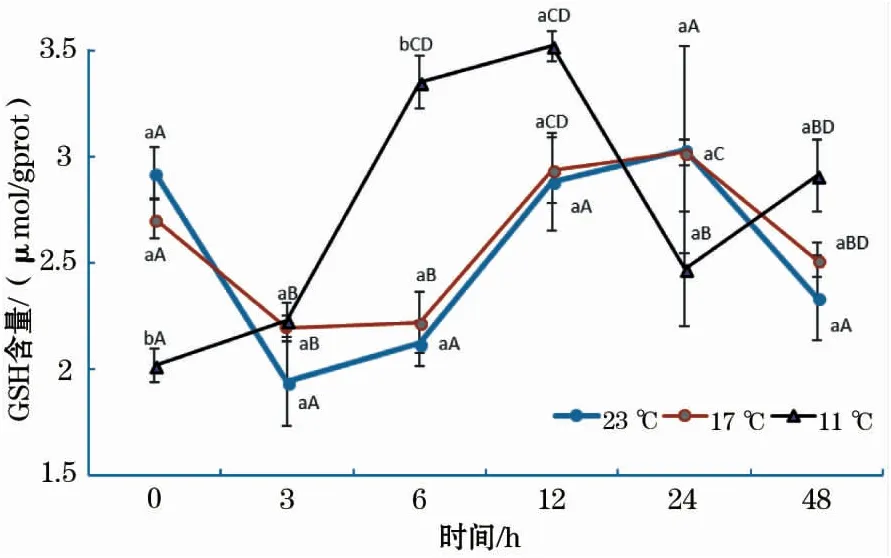
图3 急性低温胁迫对史氏鲟幼鱼GSH含量的影响Fig.3 Effect of acute temperature stress on the GSH content of juvenile Amur sturgeon
2.2.4 T-AOC活性
如图4所示,各温度组T-AOC活性随时间的增加基本均呈先升后降的趋势。23 ℃组T-AOC活性在24 h时达到最大值,各时间组间差异不显著;17 ℃组中,24 h T-AOC活性显著高于其它各时间点;11 ℃组中,T-AOC活性在12 h时达到最大值,显著高于0、24和48 h。此外,11 ℃组T-AOC活性在3~48 h中显著低于17 ℃组。
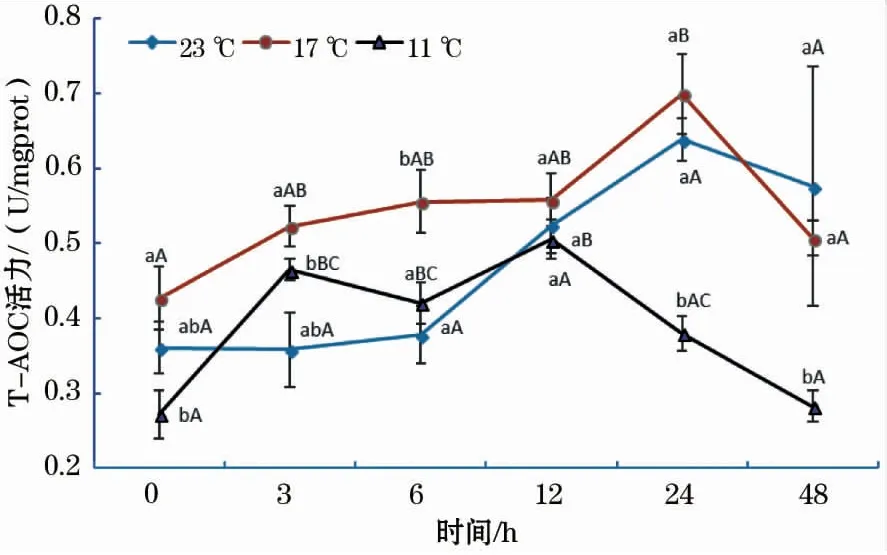
图4 急性低温胁迫对史氏鲟幼鱼T-AOC活性的影响Fig.4 Effect of acute temperature stress on the T-AOC activity of juvenile Amur sturgeon
2.2.5 MDA含量
如图5所示,17 ℃和11 ℃组MDA含量随恢复时间延长均呈波浪式变化,其中,17 ℃组MDA含量趋势变化的时间拐点为3、6和24 h,11 ℃组MDA含量趋势变化的时间拐点明显滞后于17 ℃组,分别为6 h和24 h;11 ℃组MDA含量在0、3和12 h均显著高于17 ℃、23 ℃组;23 ℃组MDA含量在0~24 h呈缓慢增加的趋势,48 h时出现显著下降。
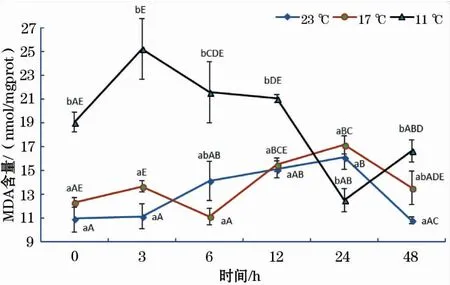
图5 急性低温胁迫对史氏鲟幼鱼MDA含量的影响Fig.5 Effect of acute temperature stress on the MDA content of juvenile Amur sturgeon
2.3 急性低温胁迫对史氏鲟幼鱼免疫能力的影响
2.3.1 LZM活性
如图6所示,23 ℃组LZM活性随着恢复时间的延长呈缓慢增加的趋势,48 h显著高于0 h;17 ℃组LZM活性随恢复时间增加呈波浪式变化,其趋势变化的时间拐点为3、6和24 h;11 ℃组LZM活性随恢复时间的变化趋势与17 ℃组基本相同,但趋势变化的时间拐点(3 h和24 h)明显滞后于17 ℃;此外,在0、3和6 h时,17 ℃时LZM活性均显著高于11 ℃组。
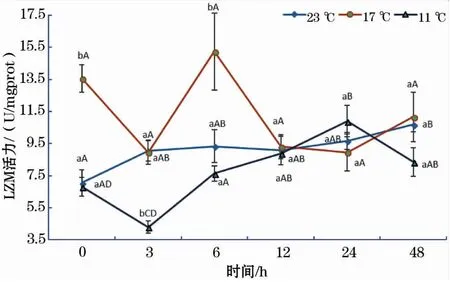
图6 急性低温胁迫对史氏鲟幼鱼LZM活性的影响Fig.6 Effect of acute temperature stress on the LZM activity of juvenile Amur sturgeon
2.3.2 IgM含量
在11、17 ℃组中,IgM含量随恢复时间增加均呈先下降后升高的趋势(图7);在23 ℃组中,IgM含量随着时间的延长呈缓慢增加的趋势。在各个时间段内,3个温度组中IgM含量由大到小依次均为23 ℃组、17 ℃组和11 ℃组。
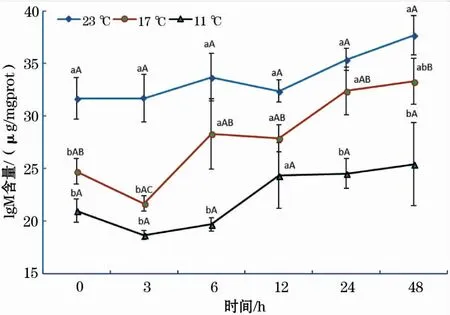
图7 急性低温胁迫对史氏鲟幼鱼IgM含量的影响Fig.7 Effect of acute temperature stress on the IgM content of juvenile Amur sturgeon
3 讨论
3.1 急性低温胁迫对史氏鲟幼鱼抗氧化指标的影响
水温与鱼类的各项生理活动有着非常紧密的关联,温度的变化会对鱼类的行为、抗氧化防御系统和免疫系统等均会产生一定的影响。本实验结果表明水温骤降不仅对史氏鲟幼鱼的游泳、呼吸等行为均产生了一定程度的影响,还导致鱼体个别部位发生充血现象,与田甜等[14]的研究结果相似,这说明温度突变对鱼体产生了较强的胁迫作用,打破了鱼体内环境的稳定,导致自由基 (ROS)大量产生,进而对鱼体造成一定程度的损伤[15]。
超氧化物歧化酶 (SOD) 和过氧化氢酶 (CAT) 是抗氧化防御体系中非常重要的功能酶[16],可联合清除ROS,其活性的下降标志着机体清除ROS的能力下降[17]。本研究中,11 ℃组SOD和CAT活性随时间的变化趋势与17 ℃组基本相同,但其趋势变化的时间拐点明显滞后于17 ℃组。这说明水温骤降温差越大,对史氏鲟SOD和CAT活性的影响越大,其恢复至正常状态所需时间也更长。23 ℃组SOD和CAT活性随时间的变化总体呈缓慢增加的趋势,可能与实验过程中实验鱼停食3 d对鱼体造成了一定程度的短期饥饿胁迫有关,这可能也是11 ℃组和17 ℃组SOD和CAT活性在24 h或48 h又出现升高的原因。另外,急性低温胁迫后恢复0~3 h时,史氏鲟幼鱼SOD、CAT活性随水温骤降温差的增大均呈先升后降的趋势,这与谢明媚等[18]、强俊等[19]的研究结果相同。表明当水温由23 ℃骤降至17 ℃时,鱼体可以通过提高SOD和CAT活性来应对低温应激反应对鱼体的影响;但当水温骤降温差增至12 ℃时,鱼体抗氧化酶活性受到显著抑制,使得11 ℃组SOD活性显著低于17 ℃组。
谷胱甘肽(GSH)是一种低分子自由基清除剂,是清除ROS非常重要的非酶抗氧化物质[20]。本实验条件下,各温度组GSH含量随恢复时间的增加均呈波浪式变化,在12~24 h达到最大值后逐渐下降。这说明,随着机体恢复时间的增加,GSH消耗量逐渐减小;而12~24 h后,肝脏GSH含量受鱼体短期饥饿的影响又出现波动。这与刘松岩[21]研究饥饿胁迫对中华鲟血清GSH含量影响的结果基本一致。此外,在0 h时,11 ℃组GSH含量显著低于17 ℃组和23 ℃组,这说明骤降温差越大,机体产生的ROS越多,GSH消耗量越大。这也与李大鹏等[22]研究水温对中华鲟血清活性氧含量及抗氧化防御系统的影响时所得出的结论相同。
总抗氧化能力(T-AOC)的大小是衡量机体抗氧化系统功能的综合性指标,它可以反映机体抗氧化防御系统应对外来胁迫的能力[23]。本研究中,低温胁迫组T-AOC活性在0 h最低,随着ROS不断被清除,T-AOC活性开始不断增加,这说明鱼体针对低温胁迫已开启自我保护机制,通过消耗抗氧化物质来抵抗氧化反应带来的损伤;在12~24 h时,T-AOC活性出现下降,原因可能与短期饥饿胁迫对鱼体的影响有关。此外,11 ℃组T-AOC活性在3~48 h均显著低于17 ℃组,这说明12 ℃骤降温差对鱼体的总抗氧化能力产生了显著抑制作用,从而导致11 ℃组T-AOC活性恢复速度显著低于17 ℃组。
丙二醛(MDA)是ROS与脂质发生过氧化反应的产物,它能够加剧细胞膜的损伤,可以反映组织细胞受ROS攻击的程度,从而间接反映机体抗氧化能力的强弱[18]。结果表明,17 ℃组和11 ℃组MDA含量随恢复时间增加呈波浪式变化,这是鱼体抗氧化防御体系对抗应激反应的结果。结果还表明,11 ℃组MDA含量在0、3、6、12和48 h均高于17 ℃组和23 ℃组,且11 ℃组MDA含量随时间的变化趋势明显滞后于17 ℃组。这说明水温骤降温差越大,对肝脏损伤程度越大,其恢复至正常状态所需的时间越长。这与孙学亮等[24]的研究结果基本相同,但江东能等[25]研究表明以色列红罗非鱼(Oreochromissp.)血清中MDA含量随胁迫温度的降低而降低,原因可能是ROS的产生量随鱼体温度的降低而下降。
3.2 急性低温胁迫对史氏鲟幼鱼免疫指标的影响
溶菌酶(LZM)是鱼体非常重要的免疫因子,它可以破坏革兰氏阳性菌细胞壁中的肽聚糖,从而瓦解细菌细胞[26]。Saurabh等[27]报道,鱼体溶菌酶活性与水温、盐度、细菌等环境因子密切相关。石小涛[28]研究认为拥挤胁迫会降低史氏鲟稚鱼的LZM活性,何杰等[29]也曾报道,在急性应激条件下,鱼体血清中LZM活性会显著增加,肝脏也会受到一定程度的损伤。本研究中,23 ℃组LZM活性受短期饥饿的影响出现缓慢增加的趋势;17 ℃组LZM活性在0、3和6 h时均显著高于11 ℃组,这说明12 ℃的水温骤降幅度显著降低了鱼体溶菌酶活性,对机体的免疫功能产生了显著的抑制作用。这与童燕[17]的研究结果类似,即随着盐度的增加,史氏鲟血清LZM活性先升后降。该结果也与Fevolden等[30]认为胁迫的强度和方法可以影响溶菌酶活性变化的观点一致。
免疫球蛋白M(IgM)是鱼体内一种重要的免疫球蛋白[29],主要分布在血液中,是机体受抗原刺激后最先产生的抗体,具有强大的抗感染作用,因此,IgM含量的多少是评价鱼体免疫应答反应的一项重要指标[19]。本研究中,在各个时间段内,三个温度组IgM含量由大到小依次为23 ℃组、17 ℃组和11 ℃组,表明温度的骤降抑制了鱼体IgM的产生,会对鱼体的免疫功能产生显著的抑制作用。这与低温胁迫对银鲳 (Pampusargenteus)幼鱼[19]、罗非鱼(Oreochromismossambicus)[29]的血清IgM影响结果基本类似,说明温度的骤降抑制了IgM的产生,降低了鱼体的免疫力。
4 结论
本研究发现急性低温胁迫对史氏鲟幼鱼抗氧化能力和免疫机能具有显著的影响,随着恢复时间的增加,鱼体抗氧化能力和免疫机能不断恢复,但11 ℃组的恢复速度要显著慢于17 ℃组,说明12 ℃的骤降温差显著抑制了鱼体的抗氧化防御能力和免疫机能,对鱼体的机能产生了显著的不利影响,且修复较为缓慢。因此,在史氏鲟的实际养殖及运输过程中,应密切关注水温的变化,尽量避免水温骤变胁迫对鱼体造成损伤。
