鲤疱疹病毒Ⅱ型ORF25截短蛋白的多克隆抗体制备与免疫原性分析
2018-11-12史玉恒范玉顶刘文枝赵建青曾令兵
周 勇,史玉恒,范玉顶,刘文枝,江 南,赵建青,许 晨,曾令兵
(中国水产科学研究院长江水产研究所,武汉430223)
鲫(Carassiusauratus)是我国重要的淡水养殖品种。据统计,2016年全国鲫养殖产量为300.52万t,约占全国淡水鱼养殖产量的10.67%[1]。由于鲫养殖规模的扩大,集约化程度的提高以及养殖水环境的恶化,鲫的病害问题日益突出,给鲫养殖业造成了严重的经济损失。由鲤疱疹病毒2型(Cyprinid herpesvirus 2,CyHV-2)感染养殖鲫引起的造血器官坏死症是我国新出现的一种病毒性疾病,其传染性强,死亡率高,危害严重[2,3]。
CyHV-2,又称为疱疹病毒性造血器官坏死症病毒(HVHNV)(Jung et al,1995)或金鱼(C.auratusauratus)造血器官坏死症病毒(GFHNV)(Groff et al,1998),属异疱疹病毒科(Alloherpesviridae)鲤疱疹病毒属(Cyprinivirus)成员(Davison et al,2009)。1992年,首次从日本患病金鱼组织内分离到CyHV-2,其致死率达100%[4]。随后陆续在亚洲、美洲、澳洲、欧洲的患病金鱼组织中检测到该病毒[5]。2011年首次在匈牙利养殖鲫组织内分离出CyHV-2,随后多国暴发了由该病毒引起鲫大量死亡的事件[6-8]。自2012年起,CyHV-2已在我国多个省市报道检出,其传播呈快速扩散的趋势[9]。
目前,针对CyHV-2感染尚无有效的防治药物。因此,研制有效的诊断试剂和疫苗,无疑有助于鲫造血器官坏死症的诊断和防控。本研究利用生物软件分析CyHV-2 ORF25编码蛋白的抗原表位,选取富含抗原表位的区域进行原核表达截短蛋白,将表达产物纯化后免疫日本大耳兔制备抗CyHV-2多克隆抗体,同时将纯化的截短蛋白免疫鲫,通过免疫保护实验研究截短表达蛋白的免疫原性,以期为抗CyHV-2新型疫苗的创制和CyHV-2免疫检测试剂盒的研发奠定前期基础。
1 材料与方法
1.1 试验鱼
实验用异育银鲫来自于中国水产科学研究院长江水产研究所窑湾试验基地,平均体重(158±18)g。暂养于室内循环水养殖系统中,水温控制在(24±2)℃,连续充气增氧,投喂商品化配合饲料。实验前随机抽取部分鲫进行CyHV-2检测,确定鱼体不带有CyHV-2后用于试验。
1.2 病毒株、细胞系、菌株与质粒
CyHV-2分离于江苏某养殖场患病异育银鲫,由本实验室分离鉴定与保藏[2]。异育银鲫脑组织细胞系(GiCB)由本实验室建立并保存[10],培养基为含10% 新生牛血清的M199,培养温度为28 ℃。E.coilDH5α菌株、E.coilBL21(DE3)菌株和克隆载体pMD19-T购置于TaKaRa公司;表达载体pET32a+ 购置于Novagen公司。
1.3 CyHV-2 ORF25截短基因的克隆
利用生物信息学软件DNA Star 6.0(Protean)对CyHV-2(GenBank Access.No.KM200722.1)的ORF25 编码蛋白进行分析,针对该序列富含抗原表位的一段基因设计引物pET-CyHV-25JD-F:5′-CGGGATCCACTCAGAATACAACA-3′和pET-CyHV-25JD-R:5′-CCAAGCTTGTTTGCGCCGTATGG-3′,上、下游引物酶切位点分别是BamH I和HindⅢ。提取GiCB细胞培养的CyHV-2病毒核酸作为PCR模板进行扩增。扩增程序为:95 ℃预变性 2 min;94 ℃变性30 s,56 ℃退火30 s,72 ℃延伸30 s,30个循环;72 ℃延伸7 min。扩增产物经琼脂糖凝胶电泳分离后回收。将回收产物连接到pMD19-T克隆载体后,转化到E.coilDH5α感受态细胞中。通过PCR和双酶切鉴定出阳性重组质粒,命名为pMD19-T-tORF25。
1.4 原核表达载体的构建
用限制性内切酶BamH Ⅰ和HindⅢ分别对重组质粒pMD19-T-tORF25和原核表达载体pET32a+进行双酶切。将酶切后的目的基因通过琼脂糖凝胶电泳分离后回收。回收产物经T4 DNA连接酶连接后,转化到E.coilBL21(DE3)感受态细胞中。转化产物经PCR和双酶切鉴定,阳性重组质粒命名为pET-32a-tORF25,其菌株命名为pET-32a-tORF25/BL21。
1.5 截短表达蛋白的表达与纯化
将重组菌pET-32a-tORF25/BL21接种于含0.05 g/mL氨苄青霉素的LB液体培养基中,37 ℃,160 r/min振荡培养过夜。次日将菌体培养物以1∶100的比例接种于LB液体培养基内,继续培养至OD600 nm≈0.4,加入终浓度为1 mmol/L的异丙基-B-D-硫代吡喃半乳糖苷(IPTG)进行诱导表达,以不加IPTG的菌液作为阴性对照。诱导4 h后将菌液离心,取部分沉淀进行SDS-PAGE分析。 同时,剩余沉淀经超声波破碎后,通过His标签蛋白纯化试剂盒(上海,碧云天)纯化截短表达蛋白tORF25。采用Bradford法对纯化后截短表达蛋白tORF25的浓度进行测定。
1.6 多克隆抗体制备及效价测定
将0.6 mg截短表达蛋白tORF25与等量的弗氏完全佐剂混合后,以皮下多点注射的方式免疫日本大耳兔,阴性对照注射PBS。每间隔14 d加强免疫一次,共免疫5次。在最后一次免疫后第7天采集兔血样,分离血清。通过抗体亲和纯化得到纯化的多克隆抗体。将纯化的多克隆抗体稀释1×103倍后,再进行2倍等比稀释至1∶64 000。将稀释后不同浓度的多克隆抗体转移至含100 μg/孔截短表达蛋白tORF25的96孔板中孵育,同时设置1×103倍稀释后的阴性组血清作为阴性对照。将羊抗兔IgG(含HRP标记)加入上述96孔板后,用四甲基苯胺(TMB)溶液显色。测定各孔的OD450nm值,确定抗体效价。
1.7 Western blot分析
将诱导和未诱导(阴性对照)的重组菌进行SDS-PAGE电泳后,转至硝酸纤维素膜上。以纯化的多克隆抗体为一抗,参照ONE-HOUR WesternTM试剂盒(南京,金斯瑞)操作步骤对多克隆抗体进行Western blot分析。
1.8 间接免疫荧光检测
用4% 多聚甲醛将感染CyHV-2后出现典型细胞病变效应的GiCB细胞固定。以纯化的多克隆抗体为一抗,参照间接免疫荧光试剂盒-抗兔Cy3(上海,碧云天)操作步骤进行间接免疫荧光检测。
1.9 免疫保护率测定
免疫试验用异育银鲫在恒温循环水养殖系统中暂养7 d后,随机分为免疫组和对照组,每组30尾鱼。将纯化的重组蛋白tORF25用PBS稀释至200 μg/mL。免疫组肌肉注射0.1 mL含有20 μg的截短蛋白tORF25。对照组注射等体积的PBS。接种截短蛋白tORF25后,免疫鲫养殖水温保持在25 ℃,每天投喂鲫商品饲料。免疫后第21天用浓度为0.1 mg/mL MS-222将鱼体麻醉后,通过腹腔注射滴度为100 TCID50/mL的CyHV-2,剂量为0.4 mL/尾。持续观察28 d,每天记录感染后情况,计算出截短表达蛋白tORF25免疫鲫后的相对免疫保护率(RPS)。计算公式为:
RPS=[1-(免疫组死亡率/对照组死亡率)]×100%
1.10 数据分析
利用SPSS 17.0统计分析软件处理实验结果。
2 结果
2.1 CyHV-2 ORF25截短蛋白编码基因的克隆
利用生物软件对CyHV-2 ORF25蛋白的抗原表位进行分析,结果显示CyHV-2 ORF25编码蛋白存在多个抗原表位。针对CyHV-2 ORF25蛋白第20-117位富含抗原表位的氨基酸编码基因设计引物。从病毒基因组DNA中扩增出大小为294 bp的基因片段,其测序结果与预期结果一致(图1)。将扩增产物tORF25进行电泳回收后,连接到克隆载体pMD19-T上。连接产物转化到E.coilDH5α感受态细胞后,对阳性菌株进行PCR和双酶切检测。检测结果显示,均在294 bp处有一条特异条带,与预期的核酸片段大小相同(图2)。结果表明,已成功构建了重组质粒pMD19-T-tORF25。
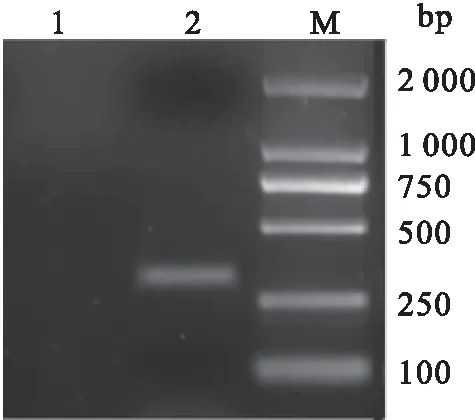
图1 tORF25基因的扩增结果Fig.1 The result of tORF25 gene amplification1:阴性对照;2:tORF25基因;M:DL 2000 DNA Ladder
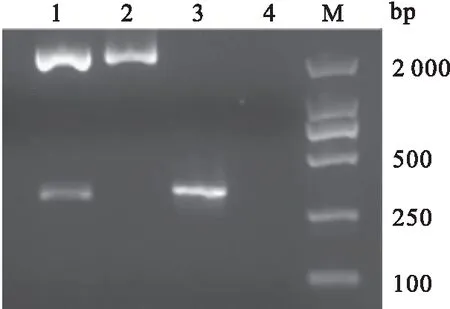
图2 重组质粒pMD19-T-tORF25鉴定结果
2.2 重组表达质粒的构建及鉴定
将重组质粒pMD19-T-tORF25和原核表达载体pET32a+双酶切后,回收并连接目的基因。连接产物转化到E.coilBL21(DE3)感受态细胞后,对阳性菌落进行PCR和双酶切鉴定。电泳结果显示,均在294 bp处有一条特异条带,与预期的核酸片段大小相同(图3)。结果表明,已成功构建了重组表达质粒pET-32a-tORF25,且获得了含有该质粒的E.coilBL21(DE3)原核表达菌株。
2.3 截短表达蛋白的表达与纯化
原核表达菌株经1 mmol/L IPTG诱导4 h后,进行SDS-PAGE电泳。结果显示,诱导后的原核表达菌株在28 kW处有一条明显的亮带,与预期蛋白大小一致,而未诱导的原核表达菌株在28 kW处未见明显亮带(图4)。结果表明,原核表达菌株能有效地表达出截短表达蛋白tORF25。

图3 重组表达质粒pET-32a-tORF25鉴定结果Fig.3 Identification results of recombinant expression plasmid pET-32a-tORF251:双酶切;2:未酶切;3:PCR;4:阴性对照;M:DNA Marker DL 2000
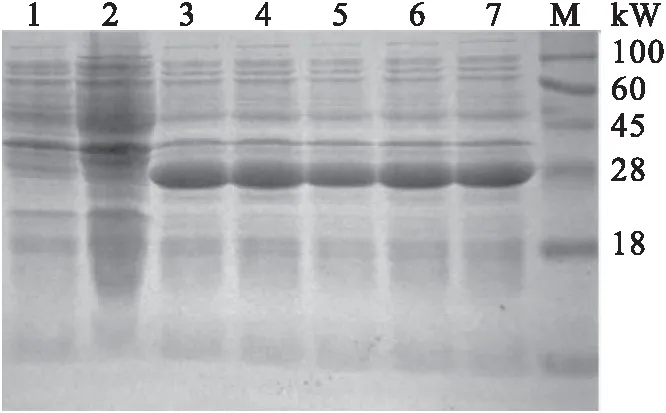
图4 原核表达菌株SDS-PAGE分析Fig.4 The strain analysis of procaryotic expression by SDS-PAGE1-2:未诱导;3-7:诱导;M:蛋白分子标准
利用His标签吸附作用纯化截短表达蛋白,并对纯化的产物进行SDS-PAGE电泳鉴定(图5)。实验结果表明得到了高纯度的截短表达蛋白。经Bradford法测定截短表达蛋白的浓度为600 μg/mL。

图5 纯化后的重组tORF25蛋白Fig.5 Purified recombinant protein tORF251:纯化后的截短表达蛋白;2:纯化前的截短表达蛋白;M:蛋白分子标准
2.4 截短表达蛋白多克隆抗体的制备及Western blot检测
收集经过5次免疫的日本大耳兔抗血清,抗血清经抗体亲和纯化得到多克隆抗体,浓度为6.25 mg/mL。经ELISA法测定,抗体效价大于1∶40 000。Western blot结果表明:多克隆抗体能特异性地结合截短表达蛋白tORF25(图6)。

图6 重组tORF25蛋白的Western blot分析Fig.6 Western blot analysis of expressed tORF25 protein with the polyclonal antibodies1:诱导;2:未诱导;M:蛋白分子量标准
2.5 间接免疫荧光检测
感染CyHV-2的GiCB细胞和未处理的正常GiCB细胞经多聚甲醛固定后,依次与多克隆抗体和红色荧光探针标记的羊抗兔IgG抗体孵育。荧光显微镜下观察显示,感染CyHV-2的GiCB细胞在绿光激发下呈现出鲜艳的红色,而没有感染CyHV-2的GiCB细胞则没有红色荧光出现(图7)。实验结果表明,制备的抗截短蛋白tORF25的多克隆抗体能够用于检测CyHV-2。

图7 免疫荧光检测GiCB细胞中的CyHV-2Fig.7 Detection CyHV-2 in GiCB cells by the immunofluorescenceA:DAPI染色病变细胞;B:荧光显微镜下病变细胞;C:A和B融合图;D:DAPI染色正常细胞;E:荧光显微镜下正常细胞;F:D和E融合图(标尺大小:50微米)
2.6 免疫保护率
使用截短蛋白tORF25免疫异育银鲫后,第21天进行攻毒感染试验。攻毒后,免疫组与对照组鲫在28 d内均出现了不同程度的发病死亡,发病时间集中在攻毒后的第10~22天,结果如图8所示。免疫截短蛋白tORF25后,鲫产生了明显的免疫力,tORF25截短蛋白免疫试验组的累计死亡率为46%,而PBS对照组的累计死亡率为87%(图8)。依据公式计算,免疫截短蛋白tORF25免疫异育银鲫后的相对免疫保护率为47%。攻毒试验中,试验鱼发病死亡的临床症状与自然感染CyHV-2的鲫临床症状一致。采集攻毒实验中发病死亡鲫的内脏组织进行PCR检测,均显示为CyHV-2阳性,表明其死亡原因是由于人工注射感染CyHV-2所致。

图8 攻毒后鲫的累计死亡率Fig.8 Cumulative mortality of gibel carp after challenge with live CyHV-2
3 讨论
Li等[11]对我国鲫造血器官坏死症流行株CyHV-2 SY-C1全基因组进行了测序,结果显示,该病毒由289 365个碱基对组成,G+C含量为51.7%。根据CyHV-2基因组序列预测出该病毒有开放阅读框约151个,这151个ORF编码了构成病毒自身所有的结构和功能蛋白[11,12]。其中,CyHV-2的ORF25基因属于ORF25多基因家族,编码病毒的膜蛋白,含有免疫球蛋白样结构域,具有较好的免疫原性[12,13]。本研究通过生物信息学方法,分析了ORF25编码蛋白的抗原表位,筛选出富含抗原表位的区域进行原核表达。表达的截短蛋白tORF25由CyHV-2 tORF25截短基因编码蛋白和载体自身的标签蛋白组成。
利用原核表达蛋白制备抗体后,验证抗体与病毒的免疫反应,是建立病毒免疫检测方法的基本思路。已有研究表明,用原核表达的CyHV-2 ORF4,ORF5和ORF72蛋白制备的多克隆抗体能与CyHV-2发生特异性反应[14-16]。彭俊杰等[13]用原核系统表达的CyHV-2 ORF25免疫小鼠后,通过细胞融合和ELISA实验筛选出1株能分泌抗CyHV-2 ORF25编码蛋白单克隆抗体的细胞株,该细胞株分泌的单克隆抗体能与感染CyHV-2的GiCB细胞发生特异性结合。本研究用纯化的截短表达蛋白tORF25免疫日本大耳兔,成功地制备了抗CyHV-2 ORF25截短基因编码蛋白的特异性多克隆抗体。将该多克隆抗体与原核表达的tORF25蛋白进行Western blot检测,结果显示杂交条带大小与预期蛋白大小一致,说明该抗体特异性好。将该多克隆抗体与感染CyHV-2后发生病变的GiCB细胞反应,发现病毒和抗体能特异性结合,而且结合效率高于CyHV-2 ORF4编码蛋白制备抗体的结合效率[16],表明该多克隆抗体可用于CyHV-2的免疫诊断。通过抗ORF25编码蛋白多克隆抗体建立的CyHV-2间接免疫荧光诊断方法,丰富了CyHV-2的免疫学检测方法。
廖红等[15]将原核表达的CyHV-2 ORF5编码蛋白免疫鲫后,使用CyHV-2进行攻毒试验,结果显示表达蛋白的相对免疫保护率最高为35%。而本研究将截短表达蛋白tORF25注射鲫后接种CyHV-2,其相对免疫保护率为47%,高于CyHV-2 ORF5编码蛋白免疫鲫后的保护率。但对于疫苗产品来说,47%的保护率并不理想,这可能是由于原核表达的蛋白缺少糖基化修饰等原因所致,尚需进一步优化与改进。
综上所述,本研究中原核表达的CyHV-2截短蛋白tORF25具有较好的免疫原性,同时利用截短蛋白制备出具有较好特异性的抗CyHV-2多克隆抗体,为抗CyHV-2新型疫苗的创制和免疫检测试剂盒的研发奠定了前期基础。
