苦荞黄酮醇合酶基因FtFLS4的克隆及其在大肠杆菌的表达
2018-11-09李青青张润敏石冠蓝姚攀锋王晓丽李成磊
李青青,张润敏,石冠蓝,姚攀锋,王晓丽,李成磊
(四川农业大学生命科学学院,四川雅安 625014)
黄酮类化合物是一类广泛存在与植物中的多酚类次级代谢产物,主要包括黄酮、黄酮醇和花青素等几大类。其中,黄酮醇化合物所占比例最大,约1/3左右,达2 000余种[1]。研究表明,黄酮醇不仅在植物中具有抵御紫外线伤害、抗寒抗旱、提高花粉萌发、促进花粉管发育等作用[2-6],在医药方面也具有多种功效如抗氧化抗衰老、抗炎、降糖降脂等[7-12]。
黄酮醇合酶(flavonol synthase,FLS,EC 1.14.11.23)是植物黄酮醇生物合成的关键酶,属于α-ODD家族黄酮醇合酶,催化二氢黄酮醇C3位发生羟基化生成黄酮醇[4]。1985年L.Britsch等[13]首先从受辐射的欧芹体外细胞提取物中检测到二氢黄酮醇转变为黄酮醇;1993年T.A.Hoton等[14]首次从矮牵牛中分离得到FLS编码基因,随后在马铃薯、金鱼草等物种中也分离得到FLS基因[15-16];这些研究表明,FLS由多拷贝基因编码且在不同植物中拷贝数不同,其表达量和底物偏爱性等与黄酮醇含量和分布等密切相关[17-20]。A.Fujita等[21]从葡萄中分离出5个VvFLS同源基因,VvFLS1-5在花中均有表达,VvFLS2、VvFLS4和VvFLS5在果皮也有表达,但只有VvFLS4能影响黄酮醇的合成。M.Mahajan等[22]研究发现在烟草中FLS基因转录后沉默不仅导致黄烷-3-醇含量升高、花青素含量降低,同时也导致烟草开花延迟、结实率严重下降。由此可见,FLS不仅直接影响黄酮醇的合成,对其他黄酮类化合物的积累以及植物某些生理特征也有很重要的影响[23]。
苦荞(Fagopyrum tataricum)学名鞑靼荞麦,是一种药食两用小杂粮[24]。其生物活性成分主要为黄酮类化合物,其中属于黄酮醇类的芦丁含量最高,约占总黄酮的80%[25]。由于苦荞食品和保健品日益受到广大消费者的青睐,使得苦荞黄酮代谢研究也成为植物次生代谢的热点之一。目前,苦荞黄酮醇合酶的同源基因FtFLS1、FtFLS2和FtFLS3已被克隆,且对其抗非生物胁迫及酶学性质进行了分析,表明这些基因的表达特征和酶学特征都有所不同[26-27]。随着苦荞转录组和基因组数据的日益丰富,可能会有更多的黄酮醇合酶同源基因被发现。本研究基于苦荞花期转录组,筛选获得一条注释为黄酮醇合酶的新基因序列FtFLS4,通过RT-PCR技术克隆该基因,并采用生物信息学分析其编码蛋白的分子特征,构建其重组原核表达载体实现在大肠杆菌中的表达,进而采用薄层层析技术对其表达产物的催化活性进行了初步鉴定。
1 材料和方法
1.1 试验材料
苦荞(“西荞二号”)种植于四川省雅安市四川农业大学实验基地。大肠杆菌DH5α、BL21(DE3)和原核表达载体pET-30b(+)由本实验室保存,其他药品为进口或国产分析纯试剂。
1.2 试验方法
1.2.1 基因克隆
通过对苦荞转录组数据的筛选,成功获得5条含有完整ORF框的FtFLS基因,其cDNA序列长度均为1 000 bp左右。其中FtFLS1-3基因已被成功克隆[27],剩余2条FtFLS基因其中一条基因表达量在各组织中明显高于另一条,为鉴定其功能并进一步研究苦荞黄酮醇合酶,对该基因进行克隆并命名为FtFLS4。
采用改良SDS法[28]提取苦荞花期总DNA。采用RNAout试剂盒(天泽基因工程有限公司)提取苦荞花期总RNA,以其为模板通过Revert AidTM First Strand Cdna Synthesis Kit逆转录试剂盒(Fermentas公司)制备cDNA第一链。根据苦荞转录组设计引物(见表1)。以花期苦荞cDNA及总DNA为模板,进行PCR反应。PCR反应体系(25 μL):cDNA模板1 μL,上下游引物各 1.5 μL,高保真 DNA 聚合酶(Prime STAR HS Polymerase,TaKaRa)12.5 μL 及无菌去离子水8.5 μL。反应条件:98℃预变性1 min;98℃变性10 s,58℃退火30 s,72℃延伸 30 s,30个循环;72℃延伸10 min。按照DNAA-Tailing Kit试剂盒说明书对回收产物进行加A后克隆到pMD 19-T Simple Vector,筛选阳性转化子测序。
1.2.2 生物信息学分析
利用DNAman 8.0拼接测序结果,分析苦荞FtFLS4基因内含子和外显子,并推导其氨基酸序列。利用Clustal X对FtFLS4基因编码蛋白进行多重序列比对,从NCBI(https://www.ncbi.nlm.nih.gov/)上下载其他植物黄酮醇合酶序列,采用MEGA5.0软件根据邻接法,重复1 000次构建系统发育进化树。采用SOMPA预测氨基酸序列二级结构,并使用ExPASy(http://web.expasy.org/protparam/)在线软件对其进行分子量及等电点预测。利用蛋白质建模软件SWISS-Model建立蛋白质模型,并使用Discovery Studio 2.5对接程序将FtFLS4蛋白模型与3种底物进行分子对接,底物的三维结构由chEBI(http://www.ebi.ac.uk/chebi/init.do)数据库下载[二氢槲皮素(ChEBI:17948)、二氢山奈酚(ChEBI:15404)和二氢杨梅素(ChEBI:28429)]。

表1 基因克隆及表达载体引物序列Table 1 Primers used for gene cloning and expression vector
1.2.3FtFLS4基因的原核表达及蛋白纯化
以含FtFLS4基因的T载体质粒为模板,用引入酶切位点的引物(见表1)进行PCR反应,将扩增产物克隆到原核表达载体pET-30b(+)。将pET-30b(+)-FtFLS4重组质粒转化大肠杆菌菌株E.coliBL21(DE3),挑取单菌落接种到10 mL液体LB培养基中(含卡那霉素)37℃过夜培养。按2%接种量接种于50 mL液体LB培养基(含卡那霉素),37℃培养至OD600=0.6~0.8,加入异丙基-β-D-硫代吡喃半乳糖苷(IPTG)至终浓度为0.4 mmol/L,22℃诱导6 h。收集菌体后按照His标签蛋白纯化试剂盒His-Tagged Protein Purification Kit(康为世纪生物科技有限公司)的操作步骤进行蛋白分离纯化。
1.2.4 重组FtFLS4的催化活性鉴定
采用薄层层析技术(TLC)对酶的活性进行定性分析。参照Li C.[7]的方法,反应体系(总体积500 μL)中包括100 μmol/L底物(二氢槲皮素、二氢山奈酚、二氢杨梅素),111 mmol/L 乙酸钠,83 μmol/Lα-酮戊二酸,42 μmol/L 硫酸铁,2.5 mmol/L 维生素 C(pH 5.0),约 12.5 μg纯化蛋白,37℃反应 20 min后用等体积乙酸乙酯萃取,进行薄层层析定性分析。依照中国药典进行TLC检测[29],以二氢黄酮醇、黄酮醇及两者混合物为对照,将反应萃取物点样于羧甲基纤维素钠硅胶G薄层板上,以甲苯∶乙酸乙酯∶甲酸=5∶2∶2为展层剂进行展层,碘蒸气显色并计算各斑点的Rf值。
采用分光光度法对酶的活性进行定量分析。将不同质量浓度(0.5、1、2、3、5、7、9、12 和 15 μg/mL)的槲皮素、山奈酚和杨梅素溶于反应缓冲液中,利用紫外可见分光光度计(Shimadz,Japan)测得其吸光度并以此建立标准曲线。将酶促反应液于对应波长测定吸光度,根据标准曲线计算产物生成量进而计算比活力。酶活力单位采用国际酶单位(IU),即每分钟生成1 μmol产物。
2 结果与分析
2.1 FtFLS4基因的克隆及序列分析
以苦荞花期总cDNA及DNA为模板,用引物FtFLS4f和FtFLS4r进行PCR扩增后分别获得1条约1 000 bp的特异条带。测序结果显示,获得的扩增产物分别为1 026 bp和1 126 bp。序列分析表明,苦荞FtFLS4cDNA序列包含1个1 026 bp的ORF,编码341个氨基酸残基;DNA序列为1 126 bp,外显子与cDNA序列一致,包含1个100 bp的内含子,其序列符合GT-AG剪接规则(见图1)。

图1 苦荞FtFLS4的基因结构Figure 1 Gene structures of FtFLS4 of tartary buckwheat
Protparam在线软件预测推导的FtFLS4蛋白理论分子量大小为39.2 kDa,等电点(pI)为5.79。二级结构预测结果表明,FtFLS4主要由α-螺旋(36.95%)、β-转角(6.74%)、β-片层(22.58%)以及无规则卷曲(33.72%)组成。将苦荞FtFLS4的氨基酸序列与苦荞其他4条FtFLS序列(FtFLS1:GenBank ID AEC33116.1,FtFLS2:GenBank ID AGE13752.1)及甜荞(GenBank ID:AEC33115.1)、金荞(GenBank ID:AHN19765.1)、拟南芥(GenBank ID:CAP09052.1)、葡萄(GenBank ID:BAE75810.1)和草莓(GenBank ID:ABH07784.1)的FLS序列进行多重序列比对,见图2。结果显示,FtFLS4具有α-ODD家族保守功能区域[30](conserved domain A和conserved domain B)及Fe2+和α-酮戊二酸结合位点。系统进化树构建结果显示,该进化树主要聚为3簇:第I簇由苦荞FtFLS1、FtFLS3及甜荞、金荞、荷兰芹等双子叶植物FLS聚成,Li C.等[7]研究表明FtFLS1在三级结构N-末端含有第1个α-螺旋,具有酶催活性;第Ⅱ簇由拟南芥AtFLS1-6及紫罗兰和裸茎条果芥FLS聚成,均属十字花科植物,其中AtFLS1-6中仅有AtFLS1和AtFLS3具有酶催活性,其他4个因三级结构N-末端缺失第1个α-螺旋而丧失活性[17];第Ⅲ簇由苦荞FtFLS2、FtFLS4及裸子植物银杏、单子叶植物玉米和大麦、双子叶植物茶树和葡萄的FLS聚成,研究表明玉米ZmFLS在三级结构N-末端也含有第1个α-螺旋且具有酶催活性[19]。本研究中苦荞FtFLS4与玉米亲缘关系最近,表明其可能具有相似的功能;此外与苦荞其他FLS虽来源于同一物种,但却处于不同的两大簇,进化上出现了分化,推测其酶催活性等功能可能存在差异。

图2 苦荞FtFLS4编码蛋白的多重序列比对Figure 2 Amino acid sequence alignment of tartary buckwheat FtFLS4 with FLSs in others plants

图3 不同植物FLS氨基酸序列的系统进化树Figure 3 Phylogenetic tree based on amino acid sequence encoded by FLS gene in different plant species
2.2 FtFLS4编码蛋白模型及分子对接
利用蛋白质建模软件SWISS-MODEL,以拟南芥无色花青素双加氧酶(leucoanthocyanidin dioxygenase,LDOX)结晶结构为模板建立FtFLS4的蛋白模型,并将蛋白模型与3种二氢黄酮醇进行分子对接(见图4)。FtFLS4为球状蛋白,其底物结合位点位于蛋白质表面且主要由短序列的α-螺旋和无规则卷曲形成活性中心口袋,其中His215、Asp217和His272为Fe2+离子结合位点,Arg282和Ser284为α-酮戊二酸结合位点。在FtFLS4-DHQ模型中,Gln219和Gln196与二氢槲皮素分子形成氢键;FtFLS4-DHK模型中,Asp217、Gln219和Gln196与二氢山奈酚分子形成氢键;FtFLS4-DHM 模型中,Thr216、Arg194、Gln219和 Gln196与二氢杨梅素分子形成氢键。Gln219、Tyr218、His215、Arg194和 Phe288等氨基酸残基提供疏水性环境和电子拉链以稳定酶促反应微环境。分子对接结果显示FtFLS4通过活性中心的氨基酸残基可与3种二氢黄酮醇形成酶-底物复合物,推测该蛋白可能具有酶催活性。
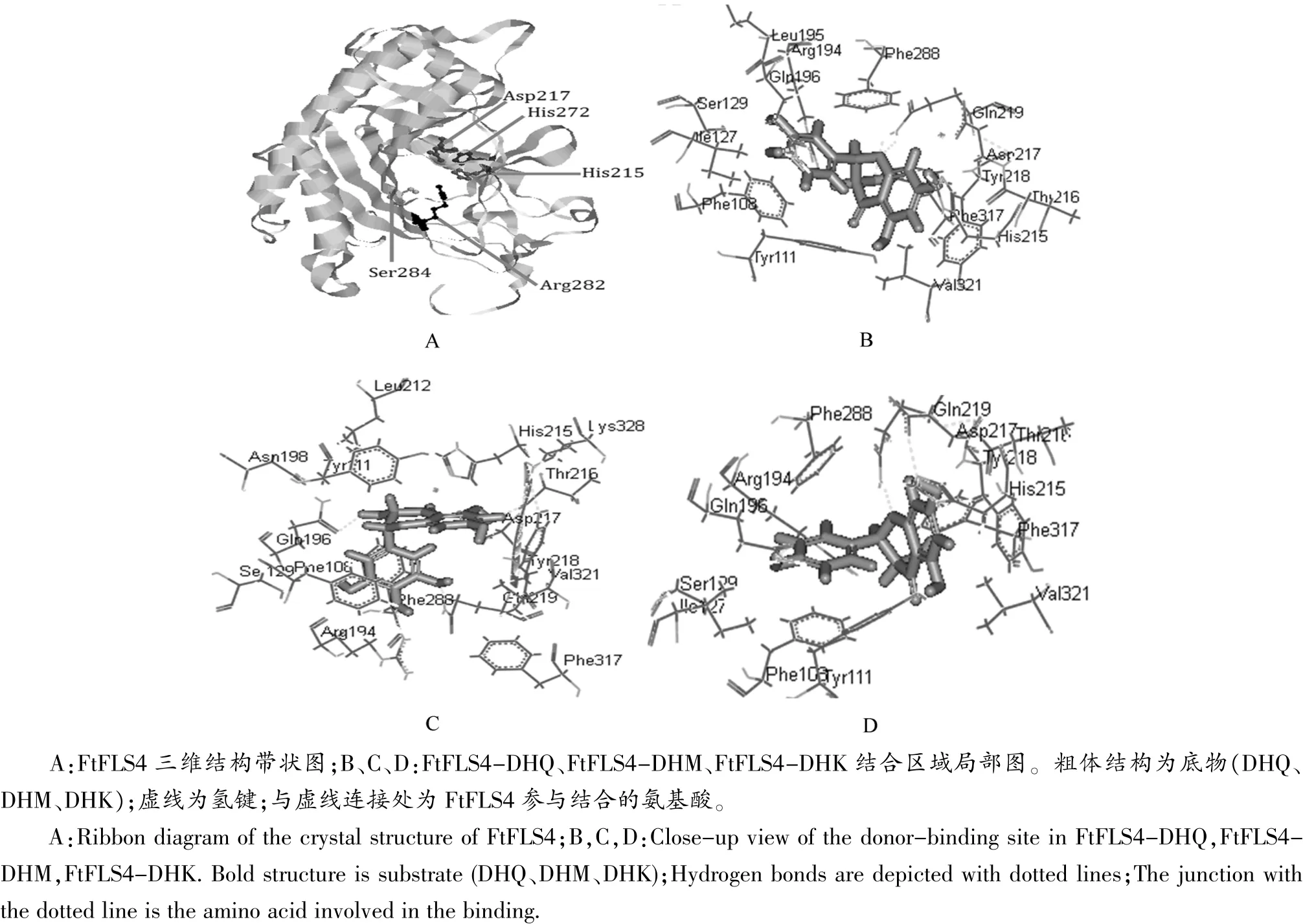
图4 苦荞FtFLS4的同源建模及分子对接Figure 4 The homology modeling and molecular docking of FtFLS4
2.3 FtFLS4基因在大肠杆菌中的表达
含有pET-30b(+)-FtFLS4重组质粒的大肠杆菌经IPTG诱导后,对表达蛋白产物进行SDS-PAGE分析,见图5。结果表明,诱导后的基因工程菌可见一条约40 kDa的新生带,与理论相对分子质量一致。重组蛋白主要以可溶状态表达,且表达量随诱导时间逐渐增加。表达蛋白经His-tag亲和层析纯化后获得了条带单一的融合表达酶蛋白,可用于后续酶催活性鉴定。
2.4 FtFLS4表达蛋白的酶催活性鉴定
采用薄层层析法对FtFLS4表达蛋白酶促反应产物进行鉴定(见图6)。FtFLS4的酶促反应液样品均在接近黄酮醇标准品(槲皮素、杨梅素和山奈酚)的位置新出现一个斑点。二氢槲皮素和槲皮素标准品Rf值分别为0.16和0.27;二氢杨梅素和杨梅素标准品Rf值分别为0.11和0.18;二氢山奈酚和山奈酚标准品Rf值分别为0.28和0.37。而FtFLS4的3种酶促反应液中两种物质的Rf值均与标准品接近。结果表明,FtFLS4具有催化3种二氢黄酮醇转化为黄酮醇的催化活性。此外,酶学活性测定表明,重组FtFLS4蛋白以二氢槲皮素、二氢山奈酚和二氢杨梅素为底物,其比活力分别为25.19×10-3、48×10-3和 19.04×10-3IU/mg。
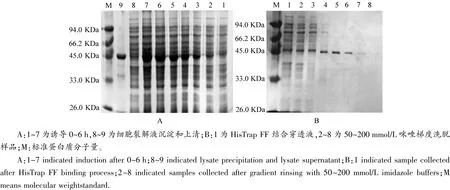
图5 FtFLS4在大肠杆菌中的表达分析Figure 5 SDS-PAGE analysis of FtFLS4 expressed in E.coli
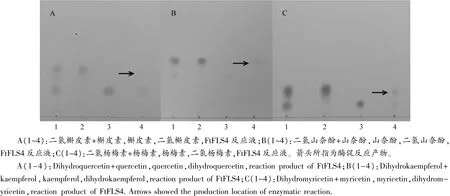
图6 苦荞黄酮醇合酶FtFLS4酶催活性的薄层层析鉴定Figure 6 Activity identification for tartary buckwheat FtFLS4 with thin layer chromatography
3 讨论与结论
黄酮醇合酶是黄酮类化合物代谢途径的关键酶,其催化二氢黄酮醇生成黄酮醇,对植物黄酮醇和花青素的合成及积累都有重要影响[14]。FLS属于α-同戊二酸依赖性双加氧酶(α-oxoglutaratedependent dioxygenase,α-ODD)家族的成员,该家族还包括黄酮类化合物合成途径的黄烷酮-3-羟化酶(flavanone-3-hydroxylase,F3H)、黄酮合酶(flavone synthase,FNS)和花青素合酶(anthocyanidin synthase,ANS)[31]。研究表明,α-ODD 基因都含有 2 个高度保守的功能区域,及α-酮戊二酸和Fe2+结合位点(Arg-X-Ser,His-Asp-His),推测可能与酶生物活性相关[32]。本研究所得FtFLS4含有α-ODD中2个高度保守的结构域和相关活性位点(His215、Asp217和His272为 Fe2+离子结合位点,Arg282和 Ser284为α-酮戊二酸结合位点)。因此,从分子结构上推测,FtFLS4可能具有黄酮醇合酶应具有的催化功能。同时,FtFLS4与3种二氢黄酮醇的分子对接分析结果也进一步支持上述推测。
植物FLS属于多拷贝基因,例如拟南芥有6个拷贝,玉米有 3 个拷贝,柑橘有 5 个拷贝[17,19,32]。已有研究表明,苦荞FtFLS基因也存在多拷贝[33],并已分离克隆了3个FtFLS同源基因[27]。不同拷贝之间编码的氨基酸序列上虽有着较高相似性,但三维结构却存在差异,这些差异最终导致彼此之间有着不同的酶学活性及催化特征。拟南芥FLS基因的6个拷贝中,仅有AtFLS1和AtFLS3编码蛋白具有催化活性,其他4个拷贝由于三级结构N-末端第一个α-螺旋缺失导致其活性丧失。其中,AtFLS1能有效催化拟南芥中黄酮醇的合成,而AtFLS3有着宽松的底物选择性[17]。柑橘CuFLS[31]都趋向于催化二氢山奈酚,而玉米ZmFLS1[19]却更加偏爱二氢槲皮素。本研究表明,苦荞FtFLS1与FtFLS3与同属蓼科植物的金荞和甜荞,亲缘性最近,FtFLS2与双子叶植物葡萄和茶树亲缘关系最近,而FtFLS4与单子叶植物玉米和大麦亲缘性最近,说明苦荞FtFLS同源基因在进化过程中出现分化,其编码蛋白的催化活性和底物特异性可能存在差异。尽管通过大肠杆菌表达的苦荞FtFLS1-4对3种二氢黄酮醇均表现出催化活性,但FtFLS1和FtFLS2对二氢槲皮素具有底物偏爱性,而FtFLS3和FtFLS4则更偏爱二氢山奈酚[27]。可见,苦荞中的黄酮醇合酶基因及其编码蛋白在进化和功能上具有多样性。
目前,苦荞基因组测序已经完成[34],这使得在基因组尺度上的黄酮合酶基因进化分析和功能鉴定成为可能,可望进一步加深对苦荞黄酮醇合成、调控及其对发育和抗逆生理的理解。
