Water-in-salt锂离子电解液研究进展
2018-11-08周安行蒋礼威岳金明索鎏敏胡勇胜黄学杰陈立泉
周安行,蒋礼威,岳金明,索鎏敏,胡勇胜,李 泓,黄学杰,陈立泉
Water-in-salt锂离子电解液研究进展
周安行,蒋礼威,岳金明,索鎏敏,胡勇胜,李 泓,黄学杰,陈立泉
(中国科学院物理研究所,北京 100190)
与传统的商用有机锂离子电池相比,水系锂离子电池具有高安全性、成本低、环境友好等优点,但由于水的热力学窗口较窄(1.23 V),从而大大限制了其输出电压和能量密度。Water-in-salt电解液的提出将水溶液的电化学窗口拓宽到3.0 V以上,为实现新型高电压水系锂离子电池提供了有利前提保证。本综述意在介绍Water-in-salt电解液及其相关衍生体系以及其在锂离子电池、锂硫电池以及混合离子电池中的相关应用拓展。与此同时,对该新体系中所引出的新的基础科学问题,包括水系固态电解质界面(SEI)膜的生长机理及锂离子的传输机制做了简单归纳和总结。
Water-in-salt;水系锂离子电池;SEI膜;锂离子传输
锂离子电池为现在移动和智能的时代提供了巨大的便利[1-2],但是随着应用场景的不断扩大和应用需求的不断苛刻使得锂离子电池安全性方面的问题不断暴露且日益突出,近些年来锂离子电池的安全问题频发,如图1所示。图1(a)为2006年,戴尔笔记本电脑在日本某次会议上起火爆炸;图1(b)为2013年特斯拉汽车在发生碰撞后起火燃烧;图1(c) 为波音787的蓄电池发生燃烧;图1(d)为三星Note 7手机起火燃烧事件。2018年7月,在韩国连接灵岩风力发电厂的EES设备发生火灾,该储能设备为12 MW·h的锂离子电池,其储能变流器为4 MW,其发生爆炸时威力迅猛,烧毁了模块和所有的装置。在有段时间内火灾火焰高达几十米,烧毁708 m2规模的临时建筑和3500多个电池,经济损失达到46亿韩元,投入了20多辆消防车和100多名消防人员,经历3个多小时才成功扑灭。由此可见,若使用锂离子电池的储能量达到兆瓦单位,其发生火灾爆炸的杀伤力及带来的损失无法估量。

图1 (a)戴尔电脑爆炸;(b)特斯拉汽车爆炸;(c)波音787蓄电池起火爆炸;(d)三星Note 7手机起火爆炸
造成以上事故的原因之一是目前商用的锂离子电池所使用的有机电解液为易燃物质,使得锂离子电池在出现事故导致的热失控时极易发生起火甚至爆炸[3-4]。为了防止安全事故发生通常锂离子电池系统需要预留足够的散热空间,并采取必要的散热和安全控制模块以提高锂离子电池的安全性能。与此同时现有的锂离子电池电解液对水分十分敏感,从而使得生产锂离子电池的过程需要在水分含量极低的干燥车间装备生产,这些无疑带来了制造工艺的复杂化和成本的提高[3,5-6]。为了解决上述问题,相关研究者开始尝试水基锂离子电池。
1994年,加拿大达尔豪斯大学的DAHN教授等[7]首次展示了一类水系二次锂离子电池。该电池使用LiMn2O4作为正极,以5 mol/L LiNO3和0.001 mol/L LiOH 作为电解液,以VO2作为负极装配全电池。通过LiOH调节其电解液的pH值为11,使 其析氢的电位降低,电池能够正常的工作。其全电池的输出电压为1.5 V,能量密度能够达到75 W·h/kg,高于铅酸电池的能量密度(30 W·h/kg),接近于镍铬电池的能量密度(50 W·h/kg),图2为溶液的pH值与析氢析氧电位的关系示意图及全电池的循环情况。由于水溶液的电化学窗口不够宽,仅有1.8 V,故充放电的过程中有产氢的现象发生,导致电极材料会在水中溶解及其结构会发生变化,循环性能很差。近些年来在国内外学者的努力下水系锂离子电池性能有了大幅改善,各种水系二次锂离子电池体系及性能总结如表1所示。但是由于受到水系电解液电化学窗口的限制,水系锂离子电池输出电压普遍偏低,且小倍率工作下析氢现象明显,从而导致电池循环寿命较差,因此大大制约了水系锂离子电池的发展。

图2 (a)不同pH值下析氢析氧电位以及材料嵌入锂离子时的电位;(b)电池电压随着时间变化的曲线
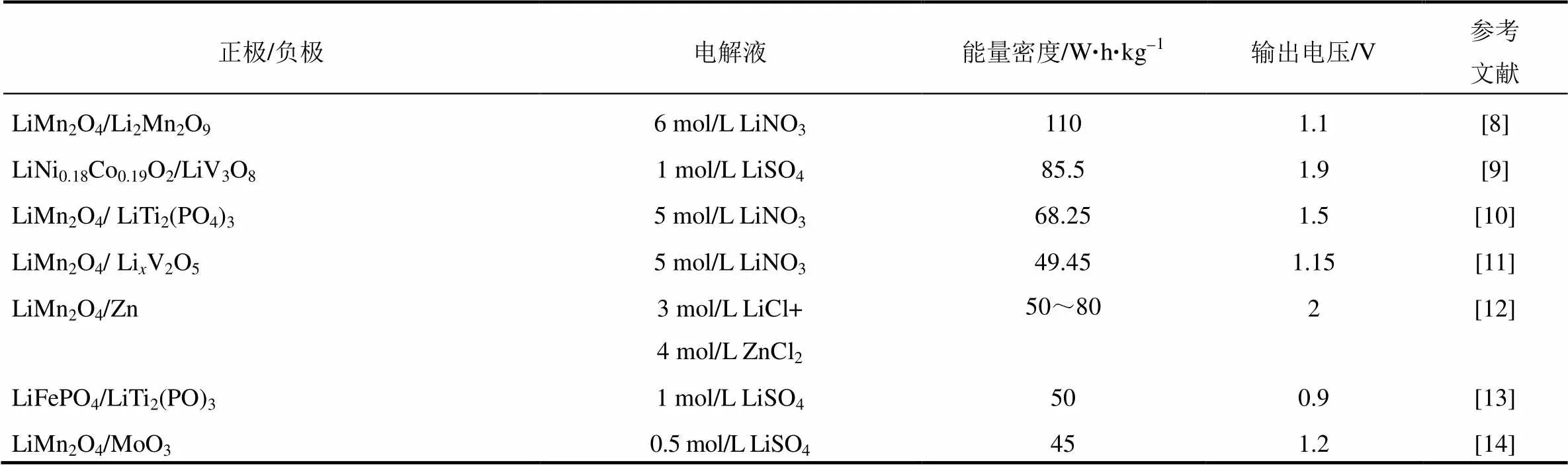
表1 各种水系锂离子电池总结
1 宽电位Water-in-salt(WIS)电解液及其拓展体系
锂盐的种类非常多,但考虑到溶解度和稳定性等具体要求能应用于锂离子电池的锂盐种类比较有限,常见的应用于锂离子电池的锂盐种类如表2所示。双三氟甲基磺酰亚胺锂(LiTFSI)具有较高的溶解度和高的化学稳定性,同时,具有高的离子电导率和宽的电化学窗口[15]。在20世纪90年代,3M公司率先将此盐实现了商业化,作为动力电池电解液的功能添加剂使用,具有改善正负极SEI膜,稳定正负极界面,抑制气体的产生,改善高温性能和循环性等多种功能[16]。在WIS体系中将LiTFSI作为主体锂盐是因为:其在水溶液中有较高的溶解度(>20 mol/kg,25℃)和其在水溶液中不水解具有高的化学稳定性[17-18]。

表2 锂盐在水溶液中的化学稳定性和溶解度
2015年,索鎏敏、许康和王春生等[18]在报道了Water- in-salt电解液,该电解液为21 m(m为mol/kg)的LiTFSI (双三氟甲烷磺酰亚胺锂) 水溶液,在该体系下溶质LiTFSI和溶剂H2O无论是质量比或是体积比都远远大于1,因此可以认为是溶剂和溶质实现了反转从而得名Water-in-salt。通常在一般浓度条件下,电解液中Li与H2O的质量比往往远远大于1∶4,因此认为水除了参与溶剂化的部分外依然存在大量自由的水分子,而在Water-in-salt中Li与H2O的质量比只有1∶2.6,此时的水无法实现溶剂化电荷屏蔽效应,阴阳离子发生强烈相互作用,进而导致形成了具有复杂结构的聚合离子对如Li2TFSI,如图3(a)~3(c)所示。
将Water-in-salt电解液用不锈钢电极进行CV测试以探寻其电化学窗口[18]。由图3(d)可知在负极一侧由于TFSI的还原导致了一种钝化作用,该钝化作用随着盐浓度的增加而增加,使得平台电流密度由1 m时的2.47 mA/cm2减少为21 m时的0.18 mA/cm2,将析氢电位由2.63 V降低至了1.90 V。由图3(e)可知在正极一侧并没有发现明显的钝化作用,但由于Li+的溶剂化作用导致水分子的活性降低,同时TFSI离子的作用导致其内部Helmholtz层的集聚[19],使其析氧电位由3.86 V提高至4.90 V。由此可知Water-in-salt电解液得到了如图3(f)所示的3 V稳定的电化学窗口,高于Pourbaix示意图解释的当pH值为7时水的电化学窗口为1.23 V[20]。随后2016年Water-in-bisalt(WIBS)电解质被报 道[21],该电解质为21 m LiTFSI与7 m LiOTF (三氟甲磺酸锂)水溶液,由WIS的单盐体系拓展为WIBS的双盐体系,其Li与H2O的质量比由1∶2.6变为1∶2。WIBS稳定的电化学窗口进一步拓宽大于3.1 V,并成功将TiO2负极包括进其安全稳定窗口,从而为实现更高输出电压水系锂离子电池提供可能。
2 高电压WIS水系锂离子电池
2.1 LiMn2O4/WIS/Mo6S8
在WIS电解液提出的同时,作者也展示了采用该电解液的全电池[18]。该全电池以LiMn2O4作为正极,以WIS作为电解液,以Mo6S8为负极。图4(a)为该体系全电池示意图,在三电极体系下LiMn2O4以及Mo6S8的充放电曲线如图4(b)所示,由此可 知该全电池的输出电压大于2 V。其充放电曲线如图4(c)所示,在该图中可以得知在充放电过程中存在着两个明显的充放电平台,经计算其能量密度可达到84 W·h/kg,与表1中的数据相比在输出电压及能量密度上都有了较大的突破。其长循环性能如图4(d)~4(e)所示,在4.5 C倍率下循环1000周的容量保持率为78%,在0.25 C倍率下循环100周的容量保持率为68%。

图3 (a)LiTFSI与H2O的质量比与体积比;(b)Li+ 在低浓度稀溶液中及Water-in-salt中溶剂化离子结构示意图;(c)TFSI-离子结构示意图及在Water-in-salt中聚合离子对Li2TFSI结构示意图;(d)~(f)Water-in-salt电化学窗口循环伏安结果

图4 (a)全电池(LiMn2O4/Mo6S8)示意图;(b)正负极各自典型的充放电曲线;(c)全电池充放电曲线及能量密度的计算;(d)0.15 C倍率下的循环性能及库仑效率;(e)4.5 C倍率下的循环性能及库仑效率
2.2 LiMn2O4/WIBS/C-TiO2
将WIS单盐体系拓展到WIBS双盐体系的过程中,以LiMn2O4为正极,WIBS为电解液,碳包覆锐钛矿相TiO2为负极组装的2.5 V全电池同时被报道[21]。图5(a)为该体系下全电池示意图;该电池平均放电输出电压为2.1 V,首次放电比容量为48 mA·h/g(以正负极总重量计算),能量密度能达到100 W·h/kg 以上,如图5(b)所示;其充放电曲线如图5(c)所示。一方面考虑到TiO2本身,尤其是在纳米尺度下可能对水有表面催化作用[22-24],若用TiO2作为水系锂离子电池的负极材料,在锂离子嵌入和脱出的过程中可能会加速水的分解从而导致更加严重的析氢现象,从而进一步使水系电池循环寿命恶化[25-27];另一方面,TiO2还存在着电子电导率低的问题。为了解决这一问题,文章中采用了热碳还原技术在纳米尺度的TiO2表面包覆上了一层薄层碳,从而不但有效改善了材料的电子电导率,而且降低了电化学的催化作用,未包覆C的TiO2在WIS以及包覆C的TiO2在WIS以及WIBS中的性能如图5(d)所示,后者在两种电解液中的库仑效率之比如图5(e)所示。
由对比可知C-TiO2在WIBS中的循环性能、库仑效率都要优于在WIS中,分析其原因是因为包覆碳的TiO2可有效降低其电化学催化性能,减少水的分解,同时碳的高电导率能够有效地降低欧姆极化。同时两种体系混合的高盐电解液中“自由水”的含量进一步减少,增加了电解液在氧化还原过程中的稳定性。高浓度的电解液也有利于阴离子发生还原反应,在析氢之前在负极生成SEI膜,综上所述其具有良好的电化学性能[21]。
2.3 LiFePO4/WIS/Mo6S8
为适应如今大规模电网储能以及商用电动汽车的需要,在2016年索鎏敏、许康和王春生等[28]有针对性地提出了一种专门应用于静态大规模电网储能使用的安全、绿色的水系二次锂离子电池(正极LiFePO4/电解液WIS/负极Mo6S8)。选择以LiFePO4代替LiMn2O4的原因是:即使是在有机电解液中,由于尖晶石结构的LiMn2O4的不稳定性会引起Jahn-Teller效应的发生,从而导致了十分明显的容量衰减,在较高的温度下例如55 ℃时会加快这种效应的发生[29-30]。而橄榄石结构的LiFePO4具有良好的热稳定性、无毒以及成本较低的特点[31-32],且具有合适嵌锂和脱锂的电位(3.5 VLi/Li+)而曾被用于水系锂离子电池中[33-35]。图6(a)为该体系下全电池示意图;全电池的电化学性能如图6(b)~6(e)所示,在0.2 C充放电时能够保持94.3%的容量保持率,能量效率大于85%。在1 C的倍率下充放电循环每周的容量衰减率为0.03%,库仑效率能够达到99%以上,能量效率大于77%。其具备良好的倍率性能,在55~-20℃的温度范围内都能够正常的充放电循环。

图5 (a)全电池(LMO/C-TiO2)示意图;(b)全电池(LMO/C-TiO2)在WIS及WIBS首周充放电曲线对比及能量密度的计算;(c)全电池(LMO/C-TiO2)充放电曲线;(d)碳包覆TiO2在WIS以及WIBS中的循环性能对比及原始TiO2在WIS中的循环性能;(e)C-TiO2在WIS及WIBS中的库仑效率对比
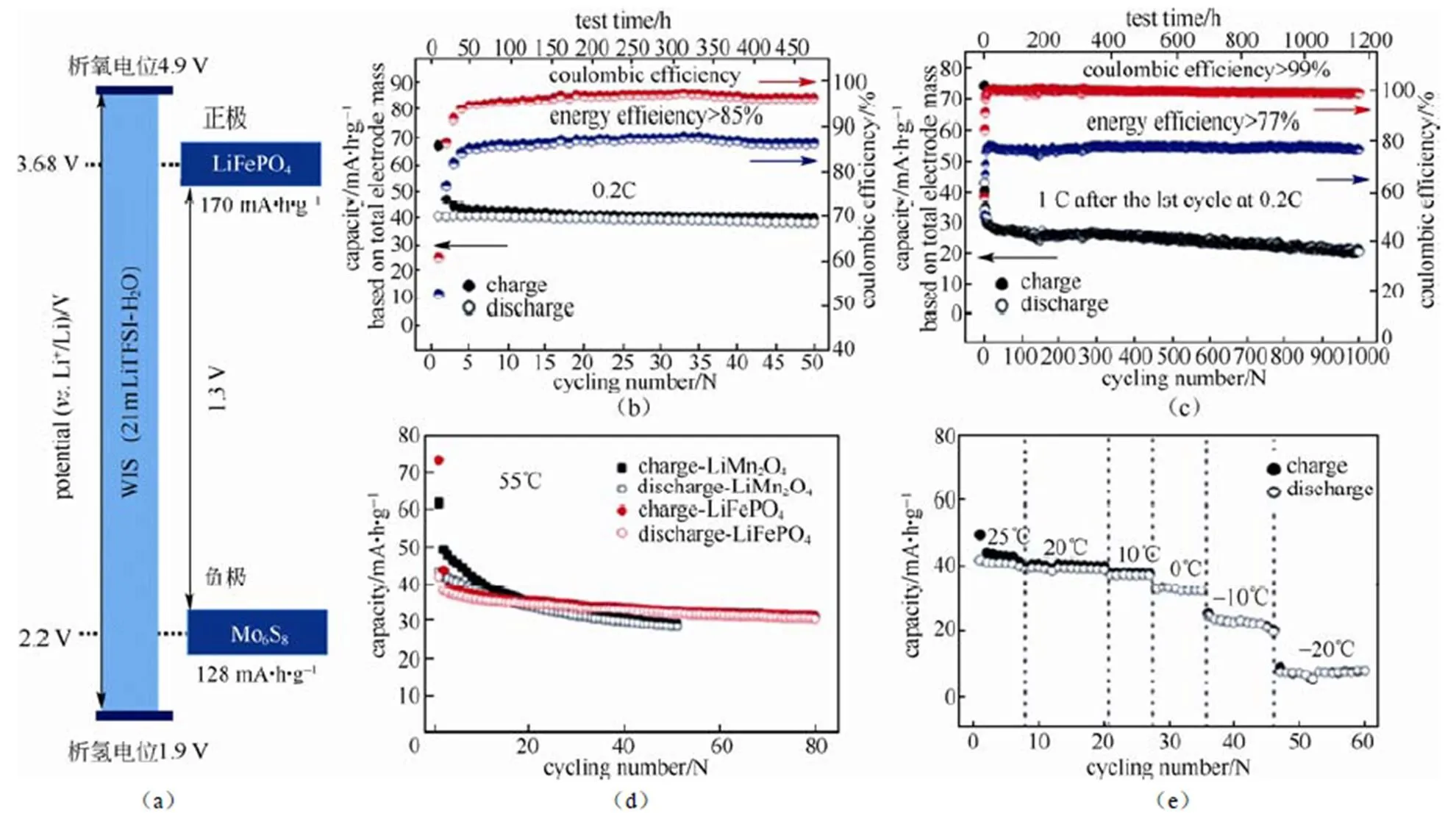
图6 (a)全电池(LiFePO4/Mo6S8)示意图;(b)0.2 C倍率下的循环性能、库仑效率及能量效率;(c)1 C倍率下的循环性能、库仑效率及能量效率;(d)在55℃时LiFePO4和LiMn2O4循环性能的对比;(e)在-20~25℃下循环该全电池的循环性能;
2.4 HV-LiCoO2/WIS-0.1% TMSB/Mo6S8
2016年,王飞、许康和王春生等[36]报道了以LiCoO2作为正极,含有0.1%质量比的三(三甲基硅烷)硼酸酯(TMSB)作为添加剂的WIS,以Mo6S8作为负极的全电池。橄榄石结构的LiFePO4有电压、能量密度较低,循环性能较差等缺点[34,37-38],故在此次报道中以LiCoO2代替LiFePO4作为正极材料。层状结构的LiCoO2具有良好的循环性,当其充电至4.2 V(. Li/Li+)时其容量可以达到140 mA·h/g[39],此时对应的分子式为Li0.5CoO2,相当于0.5个锂离子脱出,也被称为低电压钴酸锂(LVLCO),这种低电压的钴酸锂具有极佳的循环性能[40-43]。目前在非水系电池中曾报道了将LiCoO2充电到4.5 V(Li/Li+),其容量可以达到180 mA·h/g,相当于0.7个锂离子脱出,此时对应的分子式为Li0.3CoO2[39,44-48],但其循环性能很差,可能是由于Co的溶解以及Li0.3CoO2与电解质发生副反应[39,44,48-49]。
在本次报道中,通过加入TMSB添加剂成功在正极HVLCO表面形成了一层保护层(CEI),阻止Co的溶解及正极与电解液发生副反应。图7(a)为该体系下全电池的示意图,其电化学性能图如图7(b)~7(e)所示。图7(b)为0.5 C倍率下的充放电曲线,在首周充电时出现了一个电压平台,但该平台在第二次充电时没有再出现,说明了TMSB的加入并未影响正常的嵌入/脱出锂离子的过程,该平台是由于在HVLCO正极表面生成CEI膜导致的。图7(c)为0.5 C倍率下的循环性能及库仑效率示意图,在经过前8周的充放电循环后其库仑效率能够接近100%,循环100周后容量保持率能够达到92%,其能量密度为120 W·h/kg;图7(d)为在2.5 C倍率下充放电循环示意图,循环1000周每周的容量衰减率仅为0.013%。图7(e)为是否添加TMSB的HVLCO性能对比,由此可知TMSB的添加大大改善了高电压钴酸锂的性能。
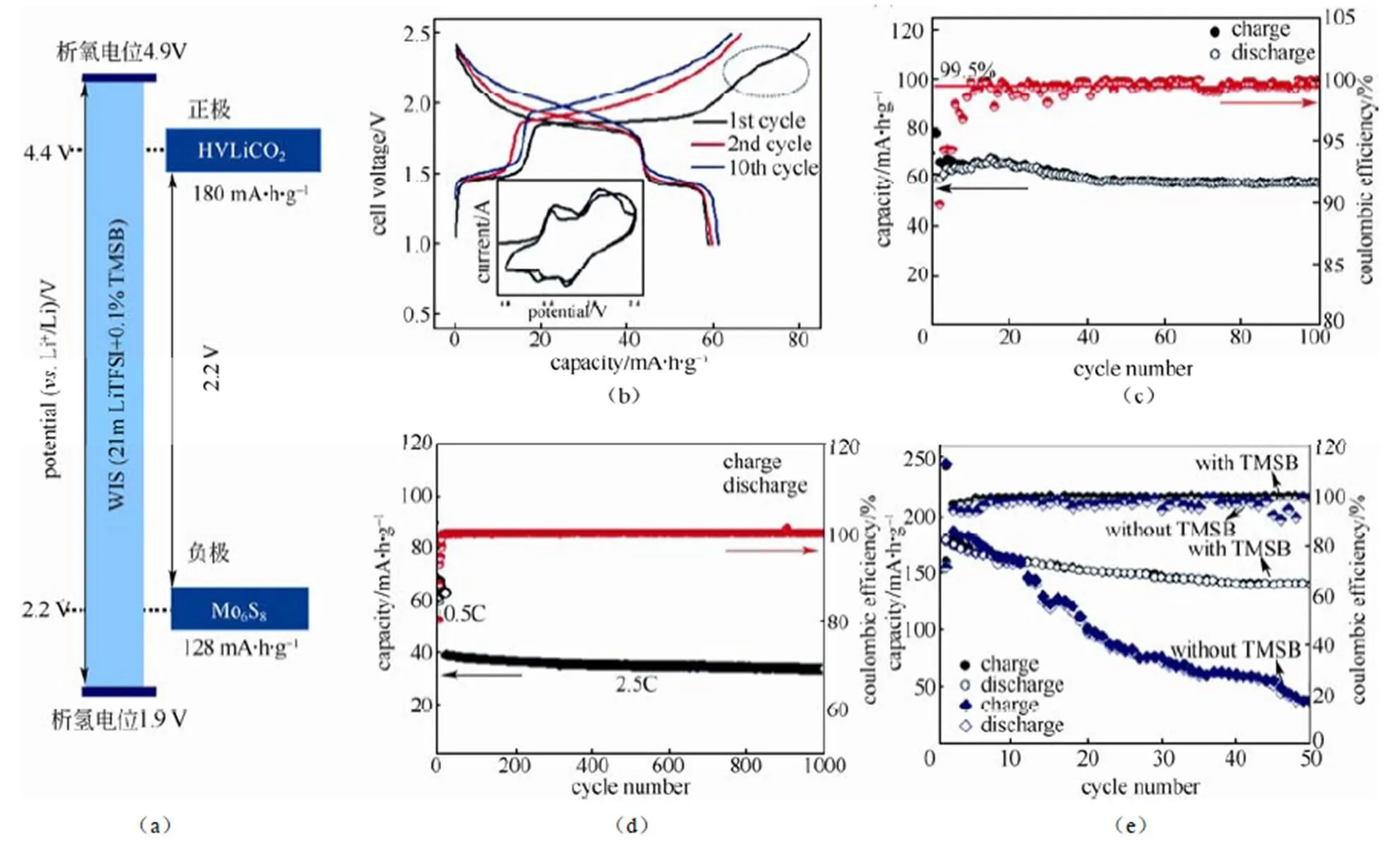
图7 (a)全电池(HVLiCoO2/Mo6S8)示意图;(b)0.5 C倍率下充放电曲线及CV测试图;(c)0.5 C倍率下循环性能及库仑效率图;(d) 2.5 C倍率下循环性能图及库仑效率图;(e)是否添加TMSB高电压钴酸锂的循环性能及库仑效率对比图
2.5 柔性电池LiVPO4F/WIS GPE/LiVPO4F
柔性电池可以根据需要被制成任何形状,在显示器、无线传感器和植入式医疗设备中可被广泛的应用,其因为具有抗压、抗剪切以及抗弯曲的能力从而具有广泛的应用前景[50-51]。柔性电池必须具备足够的化学安全性,具有稳定的能量密度和功率[52-53]。而如今商用的锂离子电池大多使用有机溶液,其具备毒性及可燃性,故并不能被称为真正的“柔性”电池。2017,杨重寅、许康和王春生等[54]报道了以LiVPO4F为正负极,以25 m LiTFSI水溶液(WIS),以及加入10%质量分数的聚乙烯醇(PVA)形成水系凝胶聚合物电解液(WIS GPE),图8(a)为该体系下的全电池示意图。该电池在WIS GPE及WIS中的电化学性能对比图如图8(b)所示,如图8(c)所示其在20 C倍率下充放电循环性能图,在充放电循环4000周后仍能保持84%的容量保持率,平均每周的容量衰减率为0.003%,其库仑效率接近100%。其在弯曲及剪切作用下的电化学性能如图8(d)所示,发现其在2 C倍率下弯曲90°及180°并未明显改变其容量及充放电平台。在空气中将电池剪掉一半的电化学性能图如图8(e)所示,剪去一半仅改变了其放电容量,电压平台仍能够很好的保持,证明其材料的稳定性。

图8 (a)全电池(LiVPO4F/ LiVPO4F)示意图;(b)以WIS和WIS GPE做电解液全电池性能对比;(c)在20 C倍率下循环稳定性及库仑效率;(d)在2 C倍率下折叠不同角度后的充放电曲线;(e)在空气中剪掉一半后的充放电曲线
3 Water-in-salt体系下的锂硫电池
3.1 LiMn2O4/WIBS GPE/S-KB
在传统锂硫电池中单质硫被作为正极材料使用,理论质量比容量可达1675mA·h/g[55-58],但是该体系通常需要使用金属锂作为负极,使得其存在一系列问题:金属锂表面锂枝晶的生长、醚类电解质中易燃易存在安全隐患[59]以及中间产物高阶长链的多硫化锂在充放电过程中溶解从而导致穿梭效应和较高的自放电率。2017年,杨重寅、许康和王春生等[60]报道了使用LiMn2O4或HVLCO作为正极,以WIBS GPE(先配制21 m LiTFSI+7 m LiOTF双盐溶液后再溶10% PVA,质量分数)作为电解质,以S-KB(硫碳复合物)作为负极,其放电比容量可达到1327 mA·h/g,在循环1000周后能保持86%的容量保持率,其能量密度能够达到135~200 W·h/kg。由于在水溶液中具有较好的动力学性能,长链的多硫化锂以极快的速度形成固体多硫化物Li2S2以及Li2S4。再加之高浓度的WIBS GPE电解液含有极少的自由水,所以Li2S2与Li2S4难以与之形成固液混合物,这便如图9(a)所示,其相较于有机体系的锂硫电池,在该体系下的锂硫电池仅存在一个还原峰,且如图9(b)所示,其在凝胶聚合物电解质中的循环性能要优于在液体电解质中的循环性能。再加上使用的含锂的正极材料与之搭配,硫电极只作为高容量负极使用使得其有效地避免了在传统的锂硫电池中出现的锂枝晶现象及穿梭效应,在Water-in-salt体系下的水系锂硫电池具有极佳的电化学性能,图9(c)为在不同倍率下的充放电曲线,其在0.2 C的放电容量为1327mA·h/g,其能量密度为135 W·h/kg。图9(d)为其在0.2 C倍率下的充放电曲线和1 C倍率下的循环性能及库仑效率。

图9 (a)碳硫复合电极在有机电解液体系和水系WIBS体系中的CV曲线;(b)水系锂硫电池在WIBS GPE和液态电解质循环性能对比;(c)在不同倍率下的充放电曲线;(d)在0.2 C倍率下长循环循环性能及库仑效率;(e)LiMn2O4/S和HVLCO/S示意图;(f)0.2 C倍率下充放电曲线及1 C倍率下循环性能和库仑效率图
3.2 HVLCO/WIBS GPE/S-KB
为了进一步提高水系电池的能量密度,在文章中同时引入了高电压钴酸锂(HVLCO)作为正极材料[60]。其电化学性能示意图如图9所示,如图9(e)所示,高电压钴酸锂的理论放电容量为190 mA·h/g,若以硫作为负极其输出电压可达2.4 V。其在0.2 C倍率下充放电曲线及在1 C倍率下的循环性能及 库仑效率如图9(e)所示,其放电容量能够达到1400 mA·h/g,能量密度为195 W·h/kg,通过技术的不断改进,HVLCO/S水系锂硫电池有望达到267 W·h/kg的理论能量密度。
4 Water-in-salt体系下混合离子电池
4.1 LiMn0.8Fe0.2PO4/WIS-0.5 M ZnSO4/Zn
2016年,ZHAO和崔光磊等[60]报道了以LiMn0.8Fe0.2PO4为正极,以WIS+0.5 mol/L ZnSO4为电解液,以Zn为负极的混合离子电池,其输出电压可达1.8 V,能量密度能够达到183 W·h/kg,在0.8 C的倍率下循环150周无明显的容量衰退[61]。图10(a)为该体系下全电池示意图,图10(b)为其在0.1 C倍率下的充放电曲线及能量密度的计算,图10(c)为该电池在不同倍率下的充放电曲线,图10(d)为其倍率测试的结果,证明其具有良好的倍率性能,图10(e)为0.3 C倍率下的循环性能及库仑效率。
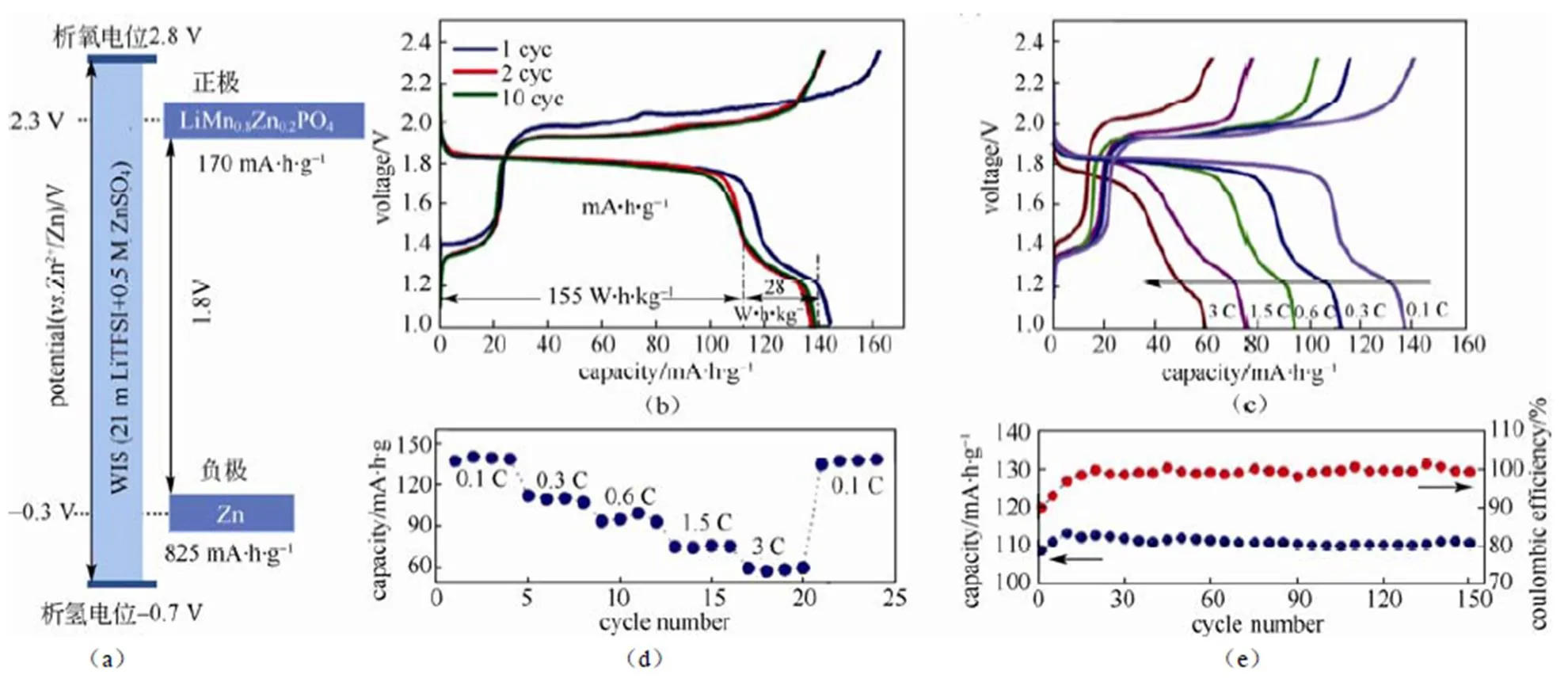
图10 (a)该体系下全电池(LiMn0.8Zn0.2PO4/Zn)示意图;(b)0.1 C倍率下的充放电曲线及能量密度计算;(c)不同倍率下的充放电曲线;(d)倍率性能测试结果;(e)0.3 C倍率下循环性能及库仑效率
4.2 LiMn2O4/HCZE/Zn
2018年,王飞、许康和王春生等[62]报道了以LiMn2O4为正极,以HCZE [1 m Zn(TFSI)2+20 m LiTFSI]为电解液,Zn为负极的混合离子电池。该混合离子电池的能量密度能够达到180 W·h/kg。图11(a)为该体系下全电池示意图。图11(b)为其在0.2 C倍率下的充放电曲线,其放电容量为66 mA·h/g,其能量密度为119 W·h/kg。图11(c)为其在0.2 C倍率下的充放电曲线,在500周的循环后能够保持83.8%的容量保持率以及99%的库仑效率。图11(d)为在4 C倍率下的循环性能及库仑效率,其在4000周的循环后仍能保持85%的容量保持率,库仑效率能够达到99.9%。图11(e)为其储存性能,在充满电后静置24 h后能达到97.8%的容量保持率,说明其自放电率较低。

图11 (a)全电池示意图(LiMn2O4/Zn);(b)0.2 C倍率的充放电曲线;(c)0.2 C的循环性能及库仑效率;(d)4 C倍率下的循环性能及库仑效率;(e)储存性能的测试
5 Water-in-salt体系中的基础科学问题 初步探讨
5.1 固态电解质界面SEI膜形成机理
在Water-in-salt概念提出来的同时,以WIS为电解液组装的LiMn2O4/WIS/Mo6S8全电池第一次在水系锂离子负极上发现了SEI膜的存在。同时,由图12(a)、12(b)的TEM表征结果,将循环前和循环后的Mo6S8进行对比可以看出在负极一侧观察到明显的SEI膜,其厚度为10~15 nm。由之前的报道可知,TFSI-在电化学的作用下可以被还原为LiF[63-64]。由图12(c)的XPS 表征也同样证明了该SEI膜的主要成分之一为LiF,进一步证明了WIS体系中电化学窗口的拓宽是由于WIS电解液热力学作用之外,在负极侧形成SEI动力学保护膜。
量子化学理论计算结合分子动力学模拟结果表明高浓度的LiTFSI形成了大量聚合离子对从而使得阴离子的还原电位由1.40 V提升到了更高的2.30~2.90 V,使得该阴离子有机会在高于产氢电位的条件下分解还原成LiF从而覆盖在负极表面,从热力学及动力学两个方面拓宽了水溶液的电化学窗口,抑制了析氢现象的发生[18]。经过进一步的研究,发现SEI的成分除了LiF之外,还存在着Li2CO3和Li2O,由于考虑到阴离子还原后无法形成碳酸盐和锂的氧化物,因此推测SEI的来源除了是TFSI-的还原,还可能来源于电解液中残留的溶解O2和CO2,其在随后进行的电化学充电过程中在负极被还原所形成,如图13所示[65]。

图12 (a)未进行充放电循环的Mo6S8的TEM表征结果;(b)充放电循环完后的Mo6S8;(c)循环后的负极Mo6S8的XPS结果

图13 SEI在WIS电解质中还原机制示意图
5.2 锂离子的传输机制
通过对不同浓度的水系和非水系电解液离子电导率的研究发现,WIS电解液(21 m LiTFSI)即使在高黏度的情况下其随温度的变化在较宽范围内依然保持较好的阿伦尼乌斯线性关系,而并非像非水体系高盐浓度Solvent-in-salt或是离子液体电解液出现严重偏离阿伦尼乌斯线性关系,而更加符合VTF方程现象。基于这个现象出发,通过实验和理论计算相结合初步给出解释机理,即由溶剂化的Li+与H2O和TFSI-形成了具有纳米结构的锂离子快速传输通道[66],该通道示意图如图14所示,由两种纳米网络构成:第一种为Li+和TFSI-构成的TSFI富集的纳米网络,该网络的作用在于固定阴离子,降低阴离子的活性,另一种纳米通道为Li+与H2O构成的,其Li+(H2O)4富集的纳米网络为锂离子的快速移动构建了一个3D通道,使其具有较高的离子传导数。

图14 水的纳米微区富集产生锂离子快速传输通道示意图
6 总结与展望
水系锂离子电池由于其独特的安全绿色优势,在未来开发环境友好且高安全性能电池体系方面具有重要研究意义。本综述首先详细介绍了宽电位Water-in-salt电解液的提出及其相关衍生体系的发展历程和目前研究现状,对目前已有的WIS体系电解液相关物理化学和电化学性能进行了归纳总结(表3);随后对以该体系为基础电解液所构成的各种水系二次锂离子电池体系进行总结归纳和逐一介绍,其中包括二次水系锂离子电池、水系锂硫电池及水系混合离子电池,各类电池的电化学性能总结在表4。由此可见,随着在WIS体系下电解液电化学窗口的提高,使得在水系电池中的正负极材料有了更多的选择,随着在WIS体系下各种新体系的出现,不断提高了水系电池的输出电压及电池的能量密度。
此外,在最后部分对目前WIS体系中存在的基础科学问题如SEI膜形成机制和锂离子在高盐浓度中离子传输机制做了简单初步探讨。
目前水系锂离子电池的研究相对传统有机锂离子电池而言,无论是基础研究还是应用技术方面都处于初级探索阶段,尽管Water-in-salt电解液体系在很短时间内已经得到了较大拓展,目前已有大量衍生电解液体系和相关新型电池体系被提出,但其巨大潜力仍有待进一步挖掘:①Water-in-salt电解液体系在水系钠离子电池、水系钾离子电池、水系镁离子电池和超级电容器等方面仍然有大量探索研究工作有待丰富和完善;②基于Water-in-salt电解液体系下的水系电池体系正负极材料仍然有大量筛选优化工作有待完成;③未来关于Water-in-salt水系电池在安全系数较高的应用领域如电动汽车、航空蓄电池、兆瓦级的电池储能系统等的开发和利用仍有待基于全体系下的安全和性能综合预测评价。与此同时,随着相关新体系的不断提出伴随着大量未知的溶液物理化学以及电化学现象产生和发现,为我们全面理解该体系提供了丰富的样本,但同时也带来了一系列基础科学和应用技术层面的问题:①超高盐浓度下离子输运机制目前仍然未知,受限于现有实验手段和理论研究水平如何给出定量描述仍然存在挑战;②水系电解液中电解液-电极界面问题尤其是SEI膜生长形成机制和规律仍然有待揭示和完善;③如何开发出低成本的Water-in-salt电解液体系;④水系电池的电池装备工艺、电池结构设计和工艺等等仍需要不断摸索。
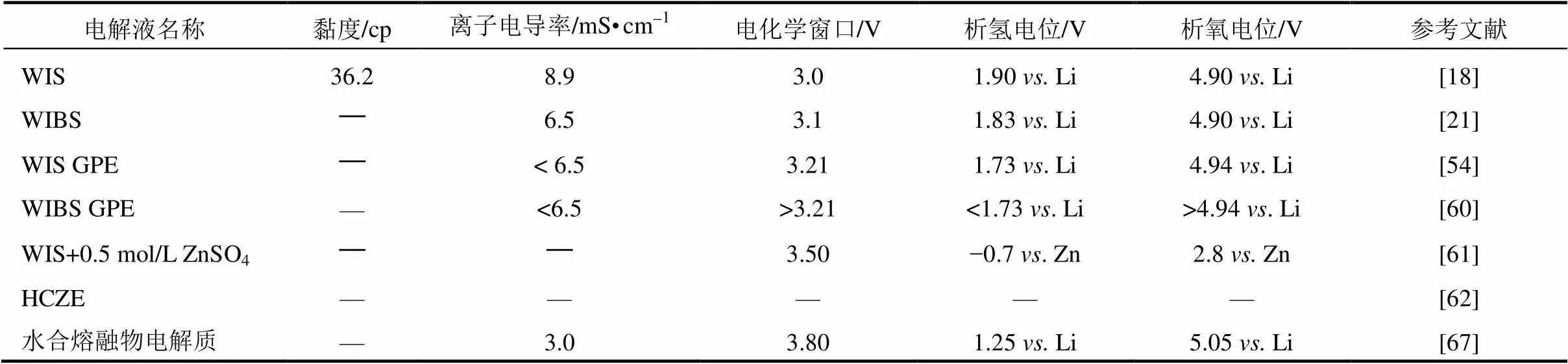
表3 WIS体系电解液

表4 WIS体系水系电池总结
综上所述,Water-in-salt电解液体系为水系锂离子电池以及其它水系电化学储能技术提供了一个全新的研究思路和机会,因此在基础科学研究领域具有十分重要的研究价值,未来在对安全系数要求较高的应用领域具有广泛的应用前景。
[1] ANGELL C A, LIU C, SANCHEZ E. Rubbery solid electrolytes with dominant cationic transport and high ambient conductivity[J]. Nature, 1993, 362(6416): 137-139.
[2] ARMAND M, TARASCON J M. Building better batteries[J]. Nature, 2008, 451(7179): 652-657.
[3] BOGLE X, VAZQUEZ R, GREENBAUM S, et al. Understanding Li+-solvent interaction in nonaqueous carbonate electrolytes with O-17 NMR[J]. Journal of Physical Chemistry Letters, 2013, 4(10): 1664-1668.
[4] BURNS J C, JAIN G, SMITH A J, et al. Evaluation of effects of additives in wound Li-ion cells through high precision coulometry[J]. Journal of the Electrochemical Society, 2011, 158(3): A255-A261.
[5] DUNN B, KAMATH H, TARASCON J M. Electrical energy storage for the grid: A battery of choices[J]. Science, 2011, 334(6058): 928-935.
[6] GOODENOUGH J B, KIM Y. Challenges for rechargeable Li batteries[J]. Chemistry of Materials, 2010, 22(3): 587-603.
[7] LI W, DAHN J R, WAINWRIGHT D S. Rechargeable lithium batteries with aqueous-electrolytes[J]. Science, 1994, 264(5162): 1115-1118.
[8] WANG G X, ZHONG S, BRADHURST D H, et al. Secondary aqueous lithium-ion batteries with spinel anodes and cathodes[J]. Journal of Power Sources, 1998, 74(2): 198-201.
[9] KOHLER J, MAKIHARA H, UEGAITO H, et al. LiV3O8: Characterization as anode material for an aqueous rechargeable Li-ion battery system[J]. Electrochimica Acta, 2000, 46(1): 59-65.
[10] WANG H B, HUANG K L, ZENG Y Q, et al. Electrochemical properties of TiP2O7and LiTi2(PO4)3as anode material for lithium ion battery with aqueous solution electrolyte[J]. Electrochimica Acta, 2007, 52(9): 3280-3285.
[11] WANG H B, ZENG Y Q, HUANG K L, et al. Improvement of cycle performance of lithium ion cell LiMn2O4/LiV2O5with aqueous solution electrolyte by polypyrrole coating on anode[J]. Electrochimica Acta, 2007, 52(15): 5102-5107.
[12] YAN J, WANG J, LIU H, et al. Rechargeable hybrid aqueous batteries[J]. Journal of Power Sources, 2012, 216: 222-226.
[13] LUO J Y, CUI W J, HE P, et al. Raising the cycling stability of aqueous lithium-ion batteries by eliminating oxygen in the electrolyte[J]. Nature Chemistry, 2010, 2(9): 760-765.
[14] TANG W, LIU L L, ZHU Y S, et al. An aqueous rechargeable lithium battery of excellent rate capability based on a nanocomposite of MoO3coated with PPy and LiMn2O4[J]. Energy & Environmental Science, 2012, 5(5): 6909-6913.
[15] NAOI K, MORI M, NARUOKA Y, et al. The surface film formed on a lithium metal electrode in a new imide electrolyte, lithium bis(perfluoroethylsulfonylimide) LiN(C2F5SO2)2[J]. Journal of the Electrochemical Society, 1999, 146(2): 462-469.
[16] 刘亚利, 吴娇杨, 李泓. 锂离子电池基础科学问题(Ⅸ)——非水液体电解质材料[J]. 储能科学与技术, 2014, 3(3): 262-282.
[17] LUX S F, TERBORG L, HACHMOLLER O, et al. LiTFSI stability in water and its possible use in aqueous lithium-ion batteries: pH dependency, electrochemical window and temperature stability[J]. Journal of the Electrochemical Society, 2013, 160(10): A1694-A1700.
[18] SUO L M, BORODIN O, GAO T, et al. "Water-in-salt" electrolyte enables high-voltage aqueous lithium-ion chemistries[J]. Science, 2015, 350(6263): 938-943.
[19] MCOWEN D W, SEO D M, BORODIN O, et al. Concentrated electrolytes: Decrypting electrolyte properties and reassessing Al corrosion mechanisms[J]. Energy & Environmental Science, 2014, 7(1): 416-426.
[20] KIM H, HONG J, PARK K Y, et al. Aqueous rechargeable Li and Na ion batteries[J]. Chemical Reviews, 2014, 114(23): 11788-11827.
[21] SUO L M, BORODIN O, SUN W, et al. Advanced high-voltage aqueous lithium-ion battery enabled by "water-in-bisalt" electrolyte[J]. Angewandte Chemie-International Edition, 2016, 55(25): 7136-7141.
[22] FUJISHIMA A, ZHANG X T, TRYK D A. TiO2photocatalysis and related surface phenomena[J]. Surface Science Reports, 2008, 63(12): 515-582.
[23] KHAN S U M, AL-SHAHRY M, INGLER W B. Efficient photochemical water splitting by a chemically modified-TiO2[J]. Science, 2002, 297(5590): 2243-2245.
[24] NI M, LEUNG M K H, LEUNG D Y C, et al. A review and recent developments in photocatalytic water-splitting using TiO2for hydrogen production[J]. Renewable & Sustainable Energy Reviews, 2007, 11(3): 401-425.
[25] ROSSMEISL J, QU Z W, ZHU H, et al. Electrolysis of water on oxide surfaces[J]. Journal of Electroanalytical Chemistry, 2007, 607(1/2): 83-89.
[26] KIM H J, JACKSON D H K, LEE J, et al. Enhanced activity and stability of TiO2-coated cobalt/carbon catalysts for electrochemical water oxidation[J]. ACS Catalysis, 2015, 5(6): 3463-3469.
[27] MORALES-GUIO C G, STERN L A, HU X L. Nanostructured hydrotreating catalysts for electrochemical hydrogen evolution[J]. Chemical Society Reviews, 2014, 43(18): 6555-6569.
[28] SUO L M, HAN F D, FAN X L, et al. "Water-in-salt" electrolytes enable green and safe Li-ion batteries for large scale electric energy storage applications[J]. Journal of Materials Chemistry A, 2016, 4(17): 6639-6644.
[29] THACKERAY M M, SHAO-HORN Y, KAHAIAN A J, et al. Structural fatigue in spinel electrodes in high voltage (4V) Li/LiMn2O4cells[J]. Electrochemical and Solid State Letters, 1998, 1(1): 7-9.
[30] XIA Y Y, ZHOU Y H, YOSHIO M. Capacity fading on cycling of 4 V Li/LiMn2O4cells[J]. Journal of the Electrochemical Society, 1997, 144(8): 2593-2600.
[31] CHOI D W, WANG D H, VISWANATHAN V V, et al. Li-ion batteries from LiFePO4cathode and anatase/graphene composite anode for stationary energy storage[J]. Electrochemistry Communications, 2010, 12(3): 378-381.
[32] WU X L, JIANG L Y, CAO F F, et al. LiFePO4nanoparticles embedded in a nanoporous carbon matrix: Superior cathode material for electrochemical energy-storage devices[J]. Advanced Materials, 2009, 21(25/26): 2710.
[33] MI C H, ZHANG X G, LI H L. Electrochemical behaviors of solid LiFePO4and Li0.99Nb0.01FePO4in Li2SO4aqueous electrolyte[J]. Journal of Electroanalytical Chemistry, 2007, 602(2): 245-254.
[34] HOU Y Y, WANG X J, ZHU Y S, et al. Macroporous LiFePO4as a cathode for an aqueous rechargeable lithium battery of high energy density[J]. Journal of Materials Chemistry A, 2013, 1(46): 14713-14718.
[35] HE P, ZHANG X, WANG Y G, et al. Lithium-ion intercalation behavior of LiFePO4in aqueous and nonaqueous electrolyte solutions[J]. Journal of the Electrochemical Society, 2008, 155(2): A144-A150.
[36] WANG F, LIN Y X, SUO L M, et al. Stabilizing high voltage LiCoO2cathode in aqueous electrolyte with interphase-forming additive[J]. Energy & Environmental Science, 2016, 9(12): 3666-3673.
[37] MANICKAM M, SINGH P, THURGATE S, et al. Redox behavior and surface characterization of LiFePO4in lithium hydroxide electrolyte[J]. Journal of Power Sources, 2006, 158(1): 646-649.
[38] HE P, LIU J L, CUI W J, et al. Investigation on capacity fading of LiFePO4in aqueous electrolyte[J]. Electrochimica Acta, 2011, 56(5): 2351-2357.
[39] CHEN Z H, DAHN J R. Methods to obtain excellent capacity retention in LiCoO2cycled to 4.5 V[J]. Electrochimica Acta, 2004, 49(7): 1079-1090.
[40] RUFFO R, LA MANTIA F, WESSELLS C, et al. Electrochemical characterization of LiCoO2as rechargeable electrode in aqueous LiNO3electrolyte[J]. Solid State Ionics, 2011, 192(1): 289-292.
[41] WANG G J, QU Q T, WANG B, et al. Electrochemical behavior of LiCoO2in a saturated aqueous Li2SO4solution[J]. Electrochimica Acta, 2009, 54(4): 1199-1203.
[42] RUFFO R, WESSELLS C, HUGGINS R A, et al. Electrochemical behavior of LiCoO2as aqueous lithium-ion battery electrodes[J]. Electrochemistry Communications, 2009, 11(2): 247-249.
[43] RAMANUJAPURAM A, GORDON D, MAGASINSKI A, et al. Degradation and stabilization of lithium cobalt oxide in aqueous electrolytes[J]. Energy & Environmental Science, 2016, 9(5): 1841-1848.
[44] SUN Y K, HAN J M, MYUNG S T, et al. Significant improvement of high voltage cycling behavior AlF3-coated LiCoO2cathode[J]. Electrochemistry Communications, 2006, 8(5): 821-826.
[45] LEE J N, HAN G B, RYOU M H, et al. N-(triphenylphosp- horanylidene) aniline as a novel electrolyte additive for high voltage LiCoO2operations in lithium ion batteries[J]. Electrochimica Acta, 2011, 56(14): 5195-5200.
[46] ZHAO F, TANG Y F, WANG J S, et al. Vapor-assisted synthesis of Al2O3-coated LiCoO2for high-voltage lithium ion batteries[J]. Electrochimica Acta, 2015, 174: 384-390.
[47] DAI X Y, ZHOU A J, XU J, et al. Extending the high-voltage capacity of LiCoO2cathode by direct coating of the composite electrode with Li2CO3via magnetron sputtering[J]. Journal of Physical Chemistry C, 2016, 120(1): 422-430.
[48] XIA H, LU L, MENG Y S, et al. Phase transitions and high-voltage electrochemical behavior of LiCoO2thin films grown by pulsed laser deposition[J]. Journal of the Electrochemical Society, 2007, 154(4): A337-A342.
[49] AURBACH D, MARKOVSKY B, RODKIN A, et al. On the capacity fading of LiCoO2intercalation electrodes: The effect of cycling, storage, temperature, and surface film forming additives[J]. Electrochimica Acta, 2002, 47(27): 4291-4306.
[50] WANG X F, LU X H, LIU B, et al. Flexible energy-storage devices: Design consideration and recent progress[J]. Advanced Materials, 2014, 26(28): 4763-4782.
[51] LI L, WU Z, YUAN S, et al. Advances and challenges for flexible energy storage and conversion devices and systems[J]. Energy & Environmental Science, 2014, 7(7): 2101-2122.
[52] TARASCON J M, ARMAND M. Issues and challenges facing rechargeable lithium batteries[J]. Nature, 2001, 414(6861): 359-367.
[53] CHOI N S, CHEN Z H, FREUNBERGER S A, et al. Challenges facing lithium batteries and electrical double-layer capacitors[J]. Angewandte Chemie-International Edition, 2012, 51(40): 9994-10024.
[54] YANG C Y, JI X, FAN X L, et al. Flexible aqueous Li-ion battery with high energy and power densities[J]. Advanced Materials, 2017, 29(44): doi:10.1002/adma.201701972.
[55] JI X L, LEE K T, NAZAR L F. A highly ordered nanostructured carbon-sulphur cathode for lithium-sulphur batteries[J]. Nature Materials, 2009, 8(6): 500-506.
[56] SEH Z W, YU J H, LI W Y, et al. Two-dimensional layered transition metal disulphides for effective encapsulation of high-capacity lithium sulphide cathodes[J]. Nature Communications, 2014, 5: 5017.
[57] SU Y S, FU Y Z, COCHELL T, et al. A strategic approach to recharging lithium-sulphur batteries for long cycle life[J]. Nature Communications, 2013, 4: doi:10.1038/ncomms3985.
[58] WEI SEH Z, LI W, CHA J J, et al. Sulphur-TiO2yolk-shell nanoarchitecture with internal void space for long-cycle lithium-sulphur batteries[J]. Nature Communications, 2013, 4: 1331.
[59] ZHANG S, UENO K, DOKKO K, et al. Recent advances in electrolytes for lithium-sulfur batteries[J]. Advanced Energy Materials, 2015, 5(16): 28.
[60] YANG C Y, SUO L M, BORODIN O, et al. Unique aqueous Li-ion/sulfur chemistry with high energy density and reversibility[J]. Proceedings of the National Academy of Sciences of the United States of America, 2017, 114(24): 6197-6202.
[61] ZHAO J W, LI Y Q, PENG X, et al. High-voltage Zn/LiMn0.8Fe0.2PO4aqueous rechargeable battery by virtue of "water-in-salt" electrolyte[J]. Electrochemistry Communications, 2016, 69: 6-10.
[62] WANG F, BORODIN O, GAO T, et al. Highly reversible zinc metal anode for aqueous batteries[J]. Nature Materials, 2018, 17(6): 543.
[63] KRAMER E, SCHEDLBAUER T, HOFFMANN B, et al. Mechanism of anodic dissolution of the aluminum current collector in 1 M LiTFSI EC∶DEC 3∶7 in rechargeable lithium batteries[J]. Journal of the Electrochemical Society, 2013, 160(2): A356-A360.
[64] VON CRESCE A, RUSSELL S M, BAKER D R, et al.and quantitative characterization of solid electrolyte interphases[J]. Nano Letters, 2014, 14(3): 1405-1412.
[65] SUO L M, OH D, LIN Y X, et al. How solid-electrolyte interphase forms in aqueous electrolytes[J]. Journal of the American Chemical Society, 2017, 139(51): 18670-18680.
[66] BORODIN O, SUO L M, GOBET M, et al. Liquid structure with nano-heterogeneity promotes cationic transport in concentrated electrolytes[J]. ACS Nano, 2017, 11(10): 10462-10471.
[67] YAMADA Y, USUI K, SODEYAMA K, et al. Hydrate-melt electrolytes for high-energy-density aqueous batteries[J]. Nature Energy, 2016, 1: 9.
Research progress on lithium based Water-in-salt electrolytes
,,,,,,,
(Institute of Physics , China Academy of Sciences , Beijing 100190 , China)
Compared with commercial organic based lithium (Li) ion batteries, aqueous lithium-ion batteries (ALIBs) present high safety, low cost and environment-friendly. However, due to the limitation of the electrochemical window of aqueous solution (1.23 V), it is excluded the most of electrochemical couples with the output voltage above 1.5 V. The invention of the Water-in-salt (WIS) electrolyte firstly expand stable electrochemical window of the aqueous electrolyte above 3.0 V which conceives of a series of high voltage ALIBs. The review mainly summarized research progress on Water-in-salt electrolyte and its relative following works, including the derivative electrolytes such as Water-in-bisalt electrolyte and its expanding applications on Li ion batteries, lithium-sulfur batteries and hybrid-ion batteries, and meanwhile introduces the fundamental investigation on the solid electrolyte interphase (SEI) formation mechanism and Li ion transport mechanism in WIS electrolytes.
Water-in-salt; aqueous lithium ion battery; solid electrolyte interphase; lithium ion transport
10.12028/j.issn.2095-4239.2018.0158
TM 911
A
2095-4239(2018)06-0972-15
2018-08-27;
2018-09-22。
国家自然科学基金项目(51872322)。
周安行(1995—),男,硕士研究生,主要研究方向为水系锂离子电池,E-mail:Zhouanxing95@163.com;
索鎏敏,副研究员,主要研究方向为新型水系二次电池,E-mail:suoliumin@ iphy.ac.cn。
