miR-98通过调控ox-LDL诱导血管内皮损伤抑制动脉粥样硬化形成的作用机制研究
2018-11-08刘继红冯斌
刘继红,冯斌
动脉粥样硬化(AS)引起的慢性炎症反应是冠心病、脑卒中、心力衰竭等心脑血管疾病的主要病理基础,如何有效防治AS的发生和发展,是全球医学界长期关注并亟待解决的重大难题[1]。AS的发病机制与多种调控因子和病理过程密切相关,包括内皮损伤、脂质浸润、氧化应激等[2]。微小核糖核酸(miR-98)是一类生物作用巨大的、非编码的小RNA,参与了大量基因或信号通路的调控作用,在心血管疾病发生过程中发挥着重要生物学效应[3]。其中miRNA-98是发现较早的一类miRNA,属于let-7家族成员,高表达于多种肿瘤细胞,通过作用于多种抑癌因子,参与肿瘤细胞的增殖、浸润和凋亡等过程[4]。但是目前关于miR-98与AS发病机制的研究探讨尚少。血管内皮损伤学说认为,氧化低密度脂蛋白(ox-LDL)是引起血管内皮损伤的主要参与因子,在凝集素样氧化低密度脂蛋白受体-1(LOX-1)的作用下,低密度脂蛋白被修饰成为ox-LDL,刺激单核细胞转化并形成巨噬细胞源性泡沫细胞,最终导致脂质斑块的形成[5]。因此通过抑制LOX-1的表达,降低ox-LDL引发的血管内皮损伤,可能为临床治疗AS的药物研发提供新的潜在靶点。有研究通过生物信息学预测系统,认为miR-98可与LOX-13’UTR区域结合,抑制LOX-1的表达[6]。本项研究通过探讨miR-98血管内皮损伤中的调控作用以及可能的作用机制,为AS分子治疗提供新的靶点和选择。现研究报告如下:
1 材料与方法
1.1 实验材料来源
1.1.1 受试细胞人主动脉内皮细胞(HAEC)和人主动脉平滑肌细胞(HASMC)来源于American Type Culture Collection(ATCC)细胞库。
1.1.2 受试动物野生型C57BL/6小鼠8只,清洁级,4~6周龄,22~25g,由北京维通利华实验动物中心提供,饲养于本单位SPF级动物房内。
1.1.3 实验对象及分组选取2017年3月~2017年10月于山东省医学科学院附属医院心血管内科就诊的AS患者60例,其中男性37例,女性23例,年龄48~82(64.08±10.24)岁;另外选择同一时期在我院体检中心进行健康体检的正常受试者20例作为健康对照组,其中男性10例,女性10例,年龄,年龄45~80(62.55±10.87)岁。
1.2 主要试剂ox-LDL(TBARs 90 nmol MDA/mg),Alfar Aesar公司;miR-98模拟物和抑制物由上海生工生物工程有限公司合成并提供;BCA蛋白浓度测定试剂盒,购自中国博士德生物工程有限公司;cDNA合成试剂盒、real-time PCR试剂盒、细胞凋亡试剂盒,购自美国OMEGA生物公司;细胞核因子κB (NF-κB p16)抗体和内皮素-1(ET-1)抗体,购自美国Abcam公司;LOX-1单克隆抗体,购自美国Santa Cruz公司;β-actin多克隆抗体购自中国博士德生物工程有限公司;脂质体Lipofectamine 2000、Opti-MEM培养基、血管细胞培养基,购自美国Invitrogen公司;DMEM高糖细胞培养基,购自美国GIBCO公司;胰蛋白酶-EDTA细胞消化液(0.25%),购自北京钮因华信科技发展有限公司;FBS胎牛血清和链霉素-青霉素双抗,购自美国Thermo Fisher公司;Trizol,购自美国Invitrogen公司;DEPC,购自美国Sigma公司;30% H2O2,购自上海碧云天生物技术有限公司;磷酸盐缓冲液、氯仿、异丙醇、无水乙醇,购自国药集团化学试剂有限公司。
1.3 主要仪器GTR16-2型高速台式冷冻离心机,北京时代北利离心机有限公司;5810R型台式冷冻离心机,德国Eppendorf;JB-CJ-1500FX超净工作台,苏州佳宝净化工程设备有限公司;实时定量PCR仪,美国MJ Research公司;UV-8000紫外分光光度计,上海精密仪器仪表公司;iMake多功能酶标仪,日本Bio-Rad公司;CX41倒置光学显微镜和OLS4100激光共聚焦显微镜,日本奥林巴斯;电子分析天平,上海玉研科学仪器有限公司;Amersham电泳仪,瑞典Bioscience;恒温水浴摇床和YCZ-40D型转移电泳槽,北京六一仪器厂;FluorChem FC3凝胶成像数码分析系统,美国ProteinSimple。
1.4 血液样本采集采集所有受试者空腹血液样本5 ml,置于血液采集管中,室温静置1 h后,低速离心,加入50 ml 0.1%无菌焦炭酸二乙酯溶液,混匀后,置于4℃保存备用。
1.5 血清LOX-1含量测定采用酶联免疫吸附测定(ELISA)测定外周血LOX-1含量,按照LOX-1 ELISA试剂盒说明书进行操作。
1.6 细胞培养将HAEC细胞或HAMSC细胞培养在含有10%FBS的血管细胞培养基中,将细胞置于37℃,5%CO2细胞培养箱中进行培养。24~48 h更换培养液,48 h传代一次。
1.7 提取小鼠腹腔巨噬细胞向5只野生型C57BL/6小鼠腹腔注射3 ml 3%巯基乙醇酸钠,3 d后颈椎脱臼将小鼠处死,向小鼠腹腔中注射5 ml预冷的无菌PBS缓冲液,5 min后采用无菌注射器将腹腔液抽出,放置5 ml无菌离心管中,低速离心,弃上清,加入DMEM培养液重悬,再次离心,弃上清,加入含有10%FBS的DMEM培养液,重悬细胞,将细胞和培养液移至培养瓶中,置于37℃,5%CO2细胞培养箱中进行培养24~48 h。待细胞贴壁后,更换培养液,保存备用。
1.8 MTT法检测ox-LDL对HAMSC细胞、HAEC细胞和巨噬细胞增殖的影响将HAEC细胞或巨噬细胞(1×103个/孔)单层接种到96孔板中,置于37℃,5%CO2细胞培养箱中进行培养,每组设置8个平行孔,每组分别加入不同终浓度的ox-LDL(0、5、15、45、135 μg/ml),继续培养48 h,每孔加入20 μl MTT,置于37℃,5%CO2细胞培养箱中孵育4 h后,弃除上清液,每孔加入200 μl DMSO,置于振动器上震动5 min,置于显微镜下观察无紫色结晶物。将96孔板放置于450酶标仪上,检测波长为570 nm,参比波长为450 nm处的吸光光度值(OD值),计算平均值。
1.9 ox-LDL干预实验将HAEC细胞、HASMC细胞或巨噬细胞(5×105个/孔)分别单层接种到6孔板中,置于37℃,5%CO2细胞培养箱中进行培养,24 h后,每组分别加入不同终浓度的ox-LDL,继续培养48 h,收集细胞,分别提取RNA或蛋白,备用。
1.10 细胞转染提前1 d在相应备行转染的6孔板上接种5×105个细胞,培养24 h后,融合率达到50%~60%,在不同2 ml无菌EP管中分别加入适量生理盐水,然后按照脂质体转染说明书,在EP管中分别加入5 μl miR-98模拟物或抑制物250μl无血清Opti-MEM培养基,混匀,室温放置10 min;另外在5 μl脂质体Lipofectamine 2000溶液中加入250 μl无血清Opti-MEM培养液,振荡混匀后,室温放置10 min;将上述两种溶液吹打混匀,室温放置30 min;将脂质体-质粒DNA复合液滴加至孔板细胞表面,置于37℃,5%CO2细胞培养箱中培养24~48 h。提取细胞RNA及蛋白,验证目的基因表达情况及转染效率。
1.11 RT-PCR方法检测miR-98、LOX-1、NF-κB p65、ET-1基因的表达①提取总RNA:收集细胞1×1010个,置于EP管中;加入1 ml预冷的Trizol,充分混合均匀,静置5~10 min;加入200μl氯仿,震荡30 s,静置5~10 min;12 000 rpm离心,取上清;加入500 μl异丙醇,震荡30 s,静置5~10 min;12 000 rpm离心,弃上清;加入1 ml 75%乙醇,震荡30 s,12000 rpm离心,弃上清;将EP管倒置于滤纸上,将RNA充分干燥;加入20 μl DEPC水溶解沉淀,分装,置于-80℃保存备用。采用凝胶电泳检测RNA分子量;采用分光光度计检测RNA浓度。②RNA反转录:根据试剂盒说明书操作进行。将cDNA保存至-20℃保存备用。③实时定量PCR:将20 μl反应体系置于37℃恒温水浴60 min,85℃ 5 s,加入去离子水至100 μl,各反应孔取2 μl进行PCR。冰浴中配制20 μlPCR反应体系,95℃30s预变性,95℃ 5 s,60℃ 30 s,循环45次。引物序列如下:miR-98(上游引物:5’-TTTTGTTTTTGCTGGTCTTAG-3’;下游引物:5’-AGCAGACAGTCAGGCAGGAT-3’);NF-κB p65(上游引物:5’-TGACTGGATTCG CTAGGTAGAAG-3’;下游引物:5’-GGCAA TTTTCAGAGCTATTAG-3’);ET-1(上游引物:5’-GCTTAGGGGCTAATCGGACT -3’;下游引物:5’- CGAAACCTACTGATGGCCCTAG-3’)β-actin(上游引物:5’-CAGCTTT GAGGTTCGTGTTTGT-3’;下游引物:5’-ATGCTCTTCTTTTTTGCGGAAA -3’)。
1.12 Western blot方法检测miR-98、LOX-1、NF-κB p65、ET-1蛋白的表达①提取蛋白样品;②蛋白样品凝胶电泳;③转膜;④封闭;⑤加入一抗孵育;⑥加入二抗孵育;⑦显影;⑧采用化学发光法检测膜上的蛋白表达条带,采用FluorChem FC3凝胶成像数码分析系统进行定量分析,以积分光密度(IOD)表示灰度值。
1.13 统计学处理本资料采用SPSS 19.0统计学软件进行处理;计量资料采用(±s)表示,多组间比较采用单因素方差分析,多组间两两比较采用SNK检验;P<0.05表示差异具有统计学意义。
2 结果
2.1 两组受试者血浆中miR-98和LOX-1水平比较经RT-PCR检测结果显示,AS组患者miR-98表达水平明显低于健康受试者;经ELISA检测结果显示,AS组患者LOX-1表达水平明显高于健康受试者。差异均具有统计学意义(P均<0.05)(图1~2)。
2.2 ox-LDL对HASMC细胞、HAEC细胞、巨噬细胞增殖活性的影响加入不同浓度ox-LDL分别干预48 h后,经MTT检测结果显示,在ox-LDL 15μg/ml干预下,HAEC细胞和小鼠巨噬细胞增殖抑制作用最强,与空白对照组相比,有统计学差异(P<0.05)。ox-LDL干预对HASMC细胞几乎无影响,HAMSC细胞一直正常生长(表1)。
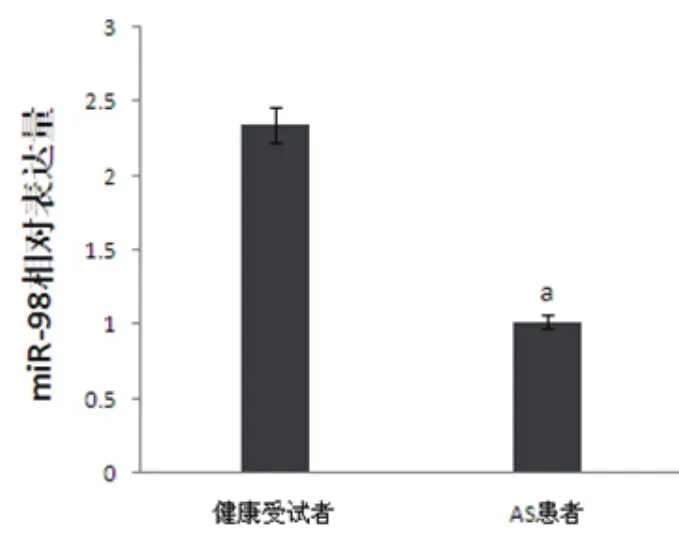
图1 健康受试者和AS患者血浆miR-98表达量比较(与健康受试者比较,aP<0.05)
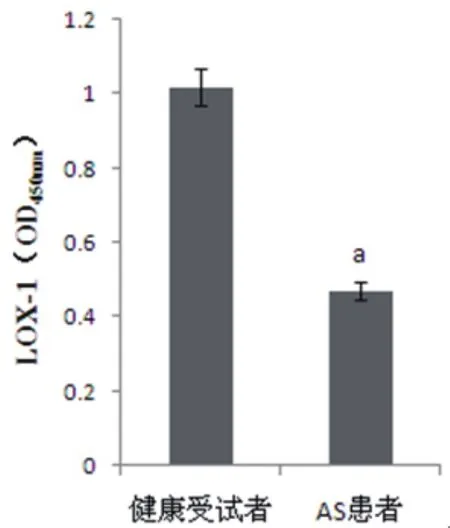
图2 健康受试者和AS患者血浆LOX-1水平比较(与健康受试者比较,bP<0.05)
2.3 HASMC细胞、HAEC细胞、巨噬细胞miR-98表达情况经RT-PCR检测结果显示,在对照组中(0 μg/ml ox-LDL干预)HAEC和巨噬细胞中miR-98表达量明显高于HASMC细胞,有统计学差异(P<0.05);且经15 μg/ml ox-LDL干预后,HAEC和巨噬细胞中miR-98表达量明显降低,与干预前比较有统计学差异(P<0.05)(图3)。
2.4 miR-98模拟物和抑制物对LOX-1表达的影响经RT-PCR和Western blot检测结果显示,miR-98可明显抑制HAEC细胞和巨噬细胞LOX-1 mRNA和蛋白的表达,与空白质粒对照组比较,具有统计学差异(P<0.05)(表2)。
2.5 miR-98模拟物和抑制物对NF-κB p65表达的影响经RT-PCR检测结果显示,miR-98模拟物转染和抑制物转染对NF-κB p65 mRNA的表达影响不明显,与空白对照组相比,无统计学差异(P>0.05);但是经Western blot检测结果显示,miR-98模拟物转染可明显抑制HAEC细胞和巨噬细胞NF-κB p65蛋白的表达,而miR-98抑制物转染可上调NF-κB p65蛋白的表达,与空白质粒对照组比较,具有统计学差异(P<0.05)(表3)。
2.6 miR-98模拟物和抑制物对ET-1表达的影响经RT-PCR和Western blot检测结果显示,miR-98模拟物转染可明显抑制HAEC细胞和巨噬细胞ET-1mRNA和蛋白的表达,而miR-98抑制物转染可上调ET-1 mRNA和蛋白的表达,与空白质粒对照组比较,具有统计学差异(P<0.05)(表4)。

图3 HASMC细胞、HAEC细胞、巨噬细胞miR-98表达量比较(与HASMC细胞组比较,aP<0.05;与HAEC细胞组比较,bP<0.05;与ox-LDL(0 μg/ ml)比较,cP<0.05)

表3 miR-98模拟物和抑制物对HAEC细胞和巨噬细胞NF-κB p65表达的影响

表4 miR-98模拟物和抑制物对HAEC细胞和巨噬细胞ET-1表达的影响
3 讨论
我国是动脉粥样硬化的高发地区,由AS引发的心脑血管疾病致死率是最重要的死亡原因之一。虽然AS的发病机制尚未研究清楚,但是“内皮损伤-反应”学说是目前公认的AS形成机制[7]。关于AS的治疗一直是全球医学界亟待攻克的难题。近年来MicroRNAs的研究为AS的治疗提供了新的思路[8]。miRNAs作为内源性非编码小分子RNA,可通过结合靶mRNA的3’端非编码区,编码区或5’非编码区,在转录后水平调节多种基因的表达,抑制或降解靶mRNA的翻译,参与细胞凋亡、增殖、分化等多种病理生理过程[9]。研究显示,至少有一半以上的miRNA基因位于炎性反应相关的基因组区域或者脆性位点,发挥促进或抑制炎症反应的作用[10],其中miR-98是早期发现的一类具有癌基因活性的小RNA,在很多恶性肿瘤细胞中呈高表达[11],但是目前关于miR-98与血管内皮损伤的关系研究尚少。本项研究在前期生物信息学预测结果的基础上,进一步探讨miR-98对血管内皮细胞损伤的调控机制。
ox-LDL作为参与动脉粥样硬化血管内皮细胞损伤的主要损伤因素之一,通过与清道夫受体结合,刺激单核细胞迁移并转化成巨噬细胞,进一步形成巨噬细胞源性泡沫细胞,同时ox-LDL可促使泡沫细胞坏死形成AS条纹或斑块,造成血管腔狭窄或阻塞[12]。因此干扰ox-LDL的表达是防治AS发生、发展的重要措施。LDX-1是位于血管内皮细胞、平滑细细胞表面的主要清道夫受体之一,与LDL氧化密切相关[13,14]。有研究认为[15],LOX-1上调可能是AS发生的启动因素,因此miR-98对LOX-1受体和ox-LDL的调控作用是笔者本项研究的重点,目前国内关于这方面的研究还处于起步阶段。笔者首先探讨了AS患者血浆中miR-98和LOX-1的表达情况,结果显示,AS组患者miR-98表达明显下调,而LOX-1表达却出现明显上调。提示miR-98与LOX-1的表达可能呈负相关性,同时也肯定了miR-98可能参与了AS的发生、发展过程。LOX-1是ox-LDL特异性结合受体,笔者通过采用ox-LDL干预对HMASC、HAMSC、HAEC和小鼠腹腔巨噬细胞增殖的影响,结果显示,ox-LDL在15 μg/ml时对miR-98的抑制作用最强。
在上述实验结果的基础上,笔者进一步探讨了miR-98对NF-κB信号通路的影响。ox-LDL通过刺激内皮细胞线粒体内活性氧自由基的表达,从而激活NF-κB信号通路以及下游调控因子,如内皮素-1(ET-1)的表达[16]。本项研究中,我们通过构建miR-98模拟物和抑制物转染细胞株,并检测经ox-LDL干预后细胞NF-κB p65和ET-1的表达情况。结果显示miR-98可明显改善内皮细胞的通透性,抑制内皮细胞损伤。
综上所述,miR-98在动脉粥样硬化早期可能通过抑制ox-LDL诱导的内皮细胞损伤作用进而抑制NF-κB炎性信号通路以及下游调控蛋白的激活,从而延缓AS的发展,为AS的治疗提供了潜在靶点。
